USO MEDICO DE INHIBIDORES DE GLUTAMINIL Y GLUTAMATO CICLASAS PARA EL TRATAMIENTO DE LA ENFERMEDAD DE ALZHEIMER Y EL SINDROME DE DOWN.
Una composición farmacéutica para administración parenteral, entérica u oral,
que comprende al menos un inhibidor de glutaminil ciclasa o una sal farmacéuticamente aceptable del mismo
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2004/004778.
Solicitante: PROBIODRUG AG.
Nacionalidad solicitante: Alemania.
Dirección: WEINBERGWEG 22 06120 HALLE/SAALE ALEMANIA.
Inventor/es: HOFFMANN, TORSTEN, DEMUTH, HANS-ULRICH, HEISER, ULRICH, DR., SCHILLING,STEPHAN, NIESTROJ,ANDRE,J.
Fecha de Publicación: .
Fecha Solicitud PCT: 5 de Mayo de 2004.
Fecha Concesión Europea: 21 de Abril de 2010.
Clasificación PCT:
- A61K31/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen ingredientes orgánicos activos.
- A61K31/4745 A61K […] › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › condensados con sistemas cíclicos teniendo el nitrógeno como heteroátomo de un ciclo, p. ej. fenantrolinas (derivados de la yohimbina, vinblastina A61K 31/475; derivados de la ergolina A61K 31/48).
- A61P25/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de trastornos del sistema nervioso.
Clasificación antigua:
- A61K31/00 A61K […] › Preparaciones medicinales que contienen ingredientes orgánicos activos.
- A61K31/4745 A61K 31/00 […] › condensados con sistemas cíclicos teniendo el nitrógeno como heteroátomo de un ciclo, p. ej. fenantrolinas (derivados de la yohimbina, vinblastina A61K 31/475; derivados de la ergolina A61K 31/48).
- A61P25/00 A61P […] › Medicamentos para el tratamiento de trastornos del sistema nervioso.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Campo de la invención
La invención se refiere a glutaminil ciclasa (QC, EC 2.3.2.5) que cataliza la ciclación intramolecular de restos de glutamina N-terminales a ácido piroglutámico (5ºxoprolina, pGlu*) con liberación de amoniaco y la ciclación intramolecular de restos de glutamato N-terminales a ácido piroglutámico con liberación de agua.
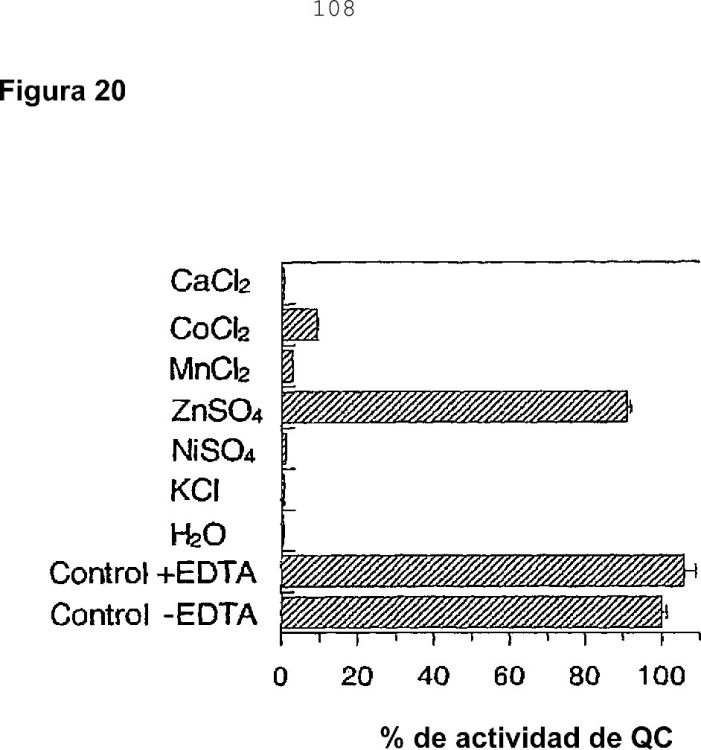
La presente invención identifica las QC de mamífero como metaloenzimas, proporciona sustratos fisiológicos novedosos de QC en mamíferos y el uso de inhibidores de QC y composiciones farmacéuticas que comprenden inhibidores de QC para el tratamiento de afecciones que pueden tratarse mediante la modulación de la actividad de QC. Adicionalmente, se muestra que la interacción metálica es un enfoque útil para el desarrollo de inhibidores de QC.
En una realización preferida, la presente invención proporciona el uso de inhibidores de la actividad de QC en combinación con inhibidores de DP IV o enzimas tipo DP IV para el tratamiento o el alivio de afecciones que pueden tratarse mediante la modulación de la actividad de QC y/o DP IV. Antecedentes
La glutaminil ciclasa (QC, EC 2.3.2.5) cataliza la ciclación intramolecular de restos de glutamina N-terminales a ácido piroglutámico (pGlu*) liberando amoniaco. Messer aisló por primera vez una QC a partir del látex de la planta tropical Carica papaya en 1963 (Messer,
M. 1963 Nature 4874, 1299). 24 años después, se descubrió una actividad enzimática correspondiente en pituitaria animal (Busby, W. H. J. y col. 1987 J. Biol. Chem. 262, 8532-8536; Fischer, W. H. y Spiess, J. 1987 Proc. Natl. Acad. Sci. USA 84, 3628-3632). Para la QC de mamífero, ha
podido demostrarse la conversión de Gln en pGlu por QC para los precursores de TRH y GnRH (Busby, W. H. J. y col. 1987
J. Biol. Chem. 262, 8532-8536; Fischer, W. H. y Spiess, J. 1987 Proc. Natl. Acad. Sci. USA 84, 3628-3632). Además, los experimentos de localización iniciales de QC revelaron una localización simultánea con sus presuntos productos de catálisis en pituitaria bovina, mejorando además la función sugerida en la síntesis de hormona peptídica (Bockers, T.
M. y col. 1995 J. Neuroendocrinol. 7, 445-453). En contraposición, la función fisiológica de la QC de planta es menos clara. En el caso de la enzima de C. papaya, se ha sugerido un papel en la defensa de la planta contra microorganismos patogénicos (El Moussaoui, A. y col. 2001 Cell. Mol. Life Sci. 58, 556-570). Se han identificado recientemente presuntas QC de otras plantas mediante comparaciones de secuencia (Dahl, S. W. y col. 2000 Protein Expr. Purif. 20, 27-36). Sin embargo, la función fisiológica de estas enzimas sigue siendo ambigua.
Las QC conocidas de plantas y animales muestran una especificidad estricta por L-glutamina en la posición N-terminal de los sustratos y se ha encontrado que su comportamiento cinético obedece la ecuación de Michaelis-Menten (Pohl, T. y col. 1991 Proc. Natl. Acad. Sci. USA 88, 10059-10063; Consalvo, A. P. y col. 1988 Anal. Biochem. 175, 131-138; Gololobov, M. Y. y col. 1996 Biol. Chem. Hoppe Seyler 377, 395-398). Sin embargo, una comparación de las estructuras primarias de las QC de C. papaya y las de la QC altamente conservada de mamíferos no reveló ninguna homología de secuencia (Dahl, S. W. y col. 2000 Protein Expr. Purif. 20, 27-36). Mientras que las QC de planta parecen pertenecer a una nueva familia de enzimas (Dahl, S.
W. y col. 2000 Protein Expr. Purif. 20, 27-36), se encontró que las QC de mamífero tenían una pronunciada homología de secuencia con aminopeptidasas bacterianas (Bateman, R. C. y col. 2001 Biochemistry 40, 11246-11250), conduciendo a la conclusión de que las QC de plantas y animales tienen diferentes orígenes evolutivos.
El documento EP 02011349.4 da a conocer polinucleótidos que codifican glutaminil ciclasa de insecto, así como los polipéptidos así codificados. Esta solicitud proporciona además células hospedadoras que comprenden vectores de expresión que comprenden polinucleótidos de la invención. Los polipéptidos aislados y células hospedadoras que comprenden QC de insecto son útiles en procedimientos de barrido de agentes que reduzcan la actividad glutaminil ciclasa. Dichos agentes se describen como útiles como plaguicidas.
La enfermedad de Alzheimer (EA) se caracteriza por una acumulación anormal de placas amiloidóticas extracelulares estrechamente asociadas a neuronas distróficas, astrocitos y microglia reactivos (Terry, R. D. y Katzman, R. 1983 Ann. Neurol. 14, 497-506; Glenner, G. G. y Wong, C. W. 1984 Biochem. Biophys. Res. Comm. 120, 885-890; Intagaki, S. y col. 1989 J. Neuroimmunol. 24, 173-182; Funato, H. y col. 1998 Am. J. Pathol. 152, 983-992; Selkoe, D. J. 2001 Physiol. Rev. 81, 741-766). Los péptidos β-amiloides (Aß) son los componentes principales de las placas seniles y se considera que están directamente implicados en la patogénesis y progresión de la EA, una hipótesis apoyada por estudios genéticos (Glenner, G. G. y Wong, C. W. 1984 Biochem. Biophys Res. Comm. 120, 885-890; Borchelt, D. R. y col. 1996 Neuron 17, 1005-1013; Lemere, C. A. y col. 1996 Nat. Med. 2, 1146-1150; Mann, D. M. e Iwatsubo, T. 1996 Neurodegeneration 5, 115-120; Citron, M. y col. 1997 Nat. Med. 3,67-72; Selkoe, D. J. 2001 Physiol. Rev. 81, 741766). El Aβ se genera mediante procesamiento proteolítico de la proteína precursora β-amiloide (APP) (Kang, J. y col. 1987 Nature 325, 733-736; Selkoe, D. J. 1998 Trends Cell. Biol. 8, 447-453), que se escinde secuencialmente por βsecretasa en el extremo N y por γ-secretasa en el extremo C de Aβ (Haass, C. y Selkoe, D. J. 1993 Cell 75, 1039-1042; Simons, M. y col. 1996 J. Neurosci. 16, 899-908). Además de los péptidos Aβ dominantes que empiezan por L-Asp en el extremo N (Aβ1-42/40), aparece una gran heterogeneidad de
formas truncadas N-terminales en placas seniles. Se ha notificado que dichos péptidos acortados son más neurotóxicos in vitro y que agregan más rápidamente que las isoformas completas (Pike, C. J. y col. 1995 J. Biol. Chem. 270 23895-23898). Los péptidos N-truncados son conocidos por sobreproducirse en sujetos con EA familiar de inicio temprano (EAF) (Saido, T. C. y col. 1995 Neuron 14, 457466; Russo, C. y col. 2000 Nature 405, 531-532), por aparecer temprano y aumentar con la edad en cerebros con síndrome de Down (SD) (Russo, C. y col. 1997 FEBS Lett. 409, 411-416, Russo, C. y col. 2001 Neurobiol. Dis. 8, 173180; Tekirian, T. L. y col. 1998 J. Neuropathol. Exp. Neurol. 57, 76-94). Finalmente, su cantidad refleja la gravedad progresiva de la enfermedad (Russo, C. y col. 1997 FEBS Lett. 409, 411-416). Los procesos postraduccionales adicionales pueden modificar además el extremo N mediante isomerización o racemización del aspartato en posición 1 y 7 y mediante ciclación del glutamato en los residuos 3 y
11. Las isoformas que contienen piroglutamato en posición 3 [pGlu3]Aβ3-40/42) representan las formas dominantes, aproximadamente un 50% de la cantidad total de Aβ, de la especie N-truncada en placas seniles (Mori, H. y col. 1992
J. Biol. Chem. 267, 17082-17086, Saido, T. C. y col. 1995 Neuron 14, 457-466; Russo, C. y col. 1997 FEBS Lett. 409, 411-416; Tekirian, T. L. y col. 1998 J. Neuropathol. Exp. Neurol. 57, 76-94; Geddes, J. W. y col. 1999 Neurobiol. Aging 20,75-79; Harigaya, Y. y col. 2000 Biochem. Biophys. Res. Commun. 276,422-427) y están también presentes en lesiones preamiloides (Lalowski, M. y col. 1996 J. Biol. Chem. 271, 33623-33631). La acumulación de péptidos AβN3(pE) es debida probablemente a la modificación estructural que potencia la agregación y confiere resistencia a la mayoría de aminopeptidasas (Saido, T. C. y col. 1995 Neuron 14, 457-466; Tekirian, T. L. y col. 1999
J. Neurochem. 73, 1584-1589). Esta evidencia proporciona pistas de un papel clave de los péptidos AßN3(pE) en la patogénesis de EA. Sin embargo, se sabe relativamente poco
sobre su neurotoxicidad y propiedades de agregación (He, W. y Barrow, C. J. 1999 Biochemistry 38, 10871-10877; Tekirian, T. L. y col. 1999 J. Neurochem. 73, 1584-1589). Además, la acción de estas isoformas sobre células gliales y la respuesta glial a estos péptidos son completamente desconocidas, aunque la glía activada está estrictamente asociada a placas seniles y podría contribuir activamente a la acumulación de depósitos amiloides. En estudios recientes, se investigaron la toxicidad, propiedades de agregación y catabolismo de los péptidos Aβ1-42, Aβ1-40, [pGlu3]Aβ3-42...
Reivindicaciones:
1. Una composición farmacéutica para administración parenteral, entérica u oral, que comprende al menos un inhibidor de glutaminil ciclasa o una sal farmacéuticamente aceptable del mismo.
2. La composición farmacéutica según la reivindicación 1, que comprende adicionalmente un inhibidor de DP IV o una enzima tipo DP IV, en la que la enzima tipo DP IV se selecciona de proteína α activadora de fibroblastos, dipeptidil peptidasa IV β, proteína tipo dipeptidil aminopeptidasa, dipeptidasa ácida N-acetilada-α-ligada, dipeptidasa de prolina de células quiescentes, dipeptidil peptidasa II, atractina y DPP 8, DP 6, DPL 2, DPP 9 y DPP
10.
3. Uso de una composición farmacéutica según las reivindicaciones 1 ó 2 para la preparación de un medicamento para la prevención o el tratamiento de una enfermedad seleccionada de enfermedad de Alzheimer y síndrome de Down.
4. Una composición farmacéutica según las reivindicaciones 1 ó 2 para el tratamiento de una enfermedad seleccionada de enfermedad de Alzheimer y síndrome de Down.
5. Uso de un inhibidor de glutaminil ciclasa, o una sal farmacéuticamente aceptable del mismo, para la preparación de un medicamento para la prevención o el tratamiento de una enfermedad seleccionada de enfermedad de Alzheimer y síndrome de Down.
6. Un inhibidor de glutaminil ciclasa, o una sal farmacéuticamente aceptable del mismo, para la prevención o el tratamiento de una enfermedad seleccionada de enfermedad
de Alzheimer y síndrome de Down.
7. El uso o el inhibidor de glutaminil ciclasa según las reivindicaciones 5 ó 6, en los que el inhibidor de 5 glutaminil ciclasa se usa en combinación con un inhibidor de DP IV o una enzima tipo DP IV, en los que la enzima tipo DP IV se selecciona de proteína α activadora de fibroblastos, dipeptidil peptidasa IV β, proteína tipo dipeptidil aminopeptidasa, dipeptidasa ácida N-acetilada-αligada, dipeptidasa de prolina de células quiescentes, dipeptidil peptidasa II, atractina y DPP 8, DP 6, DPL 2, DPP 9 y DPP 10.
8. La composición farmacéutica o el inhibidor de glutaminil ciclasa o el uso según una cualquiera de las reivindicaciones precedentes, en los que el inhibidor de glutaminil ciclasa es un inhibidor competitivo.
9. La composición farmacéutica o el inhibidor de glutaminil ciclasa o el uso según una cualquiera de las reivindicaciones precedentes, en los que el inhibidor de glutaminil ciclasa se selecciona de 3-(1H-Imidazol-1-il)-1-(3metilbenzo[b]tiofen-2-il)propan-1-ona
4-[(1-Metil-1H-imidazol-5-il)metil]-3propildihidrofuran-2-(3H)-ona
Ácido 4-[(2-1H-imidazol-1-il)etoxi]benzoico
**(Ver fórmula)**
3-[3-(1H-imidazol-1-il)propil]-2tioxoimidazolidin-4-ona
5-Nitro-2-[2-([{3-(1H-imidazol-1il)propil}amino]carbonil)fenil]furamida
**(Ver fórmula)**
1-Bencilimidazol
10. El inhibidor de glutaminil ciclasa o el uso según una cualquiera de las reivindicaciones 3 y 5 a 9, caracterizados por que se inhibe la conversión de residuos de ácido glutámico o glutamina N-terminales en residuos de ácido piroglutámico de al menos un sustrato de glutaminil ciclasa seleccionado de Aβ3-40/42, [Gln3]Aβ3-40/42, [Glu11]Aβ11-40/42 y [Gln11]Aβ11-40/42.
11. El inhibidor de glutaminil ciclasa o el uso según una cualquiera de las reivindicaciones 3 y 7 a 10, en los que se bloquea la actividad que genera H-isoAsp-Ala-OH de la enzima tipo DP IV.
12. El inhibidor de glutaminil ciclasa o el uso según una cualquiera de las reivindicaciones 3 y 7 a 11, en los que la enzima tipo DP IV es DP II.
13. El inhibidor de glutaminil ciclasa o el uso según una cualquiera de las reivindicaciones 3 y 7 a 10, en los que el inhibidor de DP IV se selecciona del grupo constituido por L-treo-isoleuciltiazolidina, L-aloisoleuciltiazolidina, L-treo-isoleucilpirrolidina, L-aloisoleucilpirrolidina, NVP-DPP728A (1-[[[2-[{5-cianopiridin2-il}amino]etil]amino]acetil]-2-ciano-(S)-pirrolidina), LAF-237 (1-[(3-hidroxiadamant-1-ilamino)acetil]pirrolidin2(S)-carbonitrilo), TSL-225 (ácido triptofil-1,2,3,4
tetrahidroisoquinolin-3-carboxílico), FE-999011, Nvalilprolilo, O-benzoilhidroxilamina, alanilpirrolidina, HAsn-pirrolidina, H-Asn-tiazolidina, H-Asp-pirrolidina, HAsp-tiazolidina, H-Asp(NHOH)-pirrolidina, H-Asp(NHOH)tiazolidina, H-Glu-pirrolidina, H-Glu-tiazolidina, HGlu(NHOH)-pirrolidina, H-Glu(NHOH)-tiazolidina, H-Hispirrolidina, H-His-tiazolidina, H-Pro-pirrolidina, H-Protiazolidina, H-Ile-azididina, H-lle-pirrolidina, H-L-alolle-tiazolidina, H-Val-pirrolidina y H-Val-tiazolidina, ácido 2-aminoctanoico-Pro-Ile, Abu-Pro-Ile, Aib-Pro-lle, Aze-Pro-Ile, Cha-Pro-Ile, Ile-Hyp-Ile, Ile-Pro-alo-Ile, Ile-Pro-terc-butil-Gly, Ile-Pro-Val, Nle-Pro-Ile, Nva-Pro-Ile, Orn-Pro-Ile, Phe-Pro-Ile, Phg-Pro-lle, Pip-Pro-Ile, Ser(Bzl)-Pro-lle, Ser(P)-Pro-Ile, Ser-Pro-Ile, terc-butil-Gly-Pro-D-Val, terc-butil-Gly-Pro-Gly, terc-butil-Gly-Pro-Ile, terc-butil-Gly-Pro-Ile-amida, terc-butil-Gly-Pro-tercbutil-Gly, terc-butil-Gly-Pro-Val, Thr-Pro-Ile, Tic-Pro-Ile, Trp-Pro-Ile, Tyr(P)-Pro-Ile, Tyr-Pro-alo-lle, Val-Proalo-lle, Val-Pro-terc-butil-Gly, Val-Pro-Val o una sal farmacéuticamente aceptable los mismos.
14. El inhibidor de glutaminil ciclasa o el uso según una cualquiera de las reivindicaciones 3 y 7 a 10, en los que el inhibidor de DP IV se selecciona del grupo constituido por
bromhidrato de 2-metilcarbonil-1-N-[(L)-alanil-(L)valinil]-(2S)-pirrolidina, bromhidrato de 2-metilcarbonil-1-N-[(L)-valinil-(L)prolil-(L)-valinil]-(2S)-pirrolidina, bromhidrato de 2-[(acetiloximetil)carbonil]-1-N-[(L)alanil-(L)-valinil]-(2S)-pirrolidina, bromhidrato de 2-[(benzoiloximetil)carbonil]-1-N[{(L)-alanil}-(L)-valinil]-(2S)-pirrolidina, 2-{[(2,6-diclorobencil)tiometil]carbonil}-1-N-[{(L)alanil}-(L)-valinil]-(2S)-pirrolidina, bromhidrato de 2-[(benzoiloximetil)carbonil]-1-N[glicil-(L)-valinil]-(2S)-pirrolidina,
trifluoroacetato de 2-[([1,3]-tiazoltiazol-2il)carbonil]-1-N-[{(L)-alanil}-(L)-valinil]-(2S)pirrolidina,
trifluoroacetato de 2-[(benzotiazoltiazol-2il)carbonil]-1-N-[N-{(L)-alanil}-(L)-valinil]-(2S)pirrolidina,
trifluorocetato de 2-[(benzotiazoltiazol-2il)carbonil]-1-N-[{(L)-alanil}glicil]-(2S)-pirrolidina,
trifluoroacetato de 2-[(piridin-2-il)carbonil]-1-N-[N{(L)-alanil}-(L)-valinil]-(2S)-pirrolidina
cloruro de 1-ciclopentil-3-metil-1-oxo-2-pentanaminio,
cloruro de 1-ciclopentil-3-metil-1-oxo-2-butanaminio,
cloruro de 1-ciclopentil-3,3-dimetil-1-oxo-2butanaminio,
cloruro de 1-ciclohexil-3,3-dimetil-1-oxo-2butanaminio,
cloruro de 3-(ciclopentilcarbonil)-1,2,3,4tetrahidroisoquinolinio,
cloruro de N-(2-ciclopentil-2-oxoetil)ciclohexanaminio
u otras sales farmacéuticamente aceptables de los mismos.
15. La composición farmacéutica o el inhibidor de glutaminil ciclasa o el uso según una cualquiera de las reivindicaciones precedentes, en los que el inhibidor de glutaminil ciclasa se une al ión metálico unido al sitio activo de glutaminil ciclasa.
Patentes similares o relacionadas:
Uso de inhibidores de la PDE4 para la profilaxis y/o la terapia de la dislipoproteinemia y trastornos relacionados, del 27 de Mayo de 2020, de Albert-Ludwigs-Universität Freiburg: Inhibidor específico de la fosfodiesterasa 4 (PDE 4) para uso en el tratamiento profiláctico o terapéutico de la dislipoproteinemia, en donde el inhibidor […]
Métodos y composiciones para trastornos relacionados con la proliferación celular, del 27 de Mayo de 2020, de Agios Pharmaceuticals, Inc: Un método in vitro para diagnosticar a un sujeto que tiene un trastorno relacionado con la proliferación celular o que se sospecha que tiene un trastorno relacionado con […]
Un canal catiónico no selectivo en células neurales y compuestos que bloquean el canal para su uso en el tratamiento de la inflamación del cerebro, del 6 de Mayo de 2020, de UNIVERSITY OF MARYLAND, BALTIMORE: Un antagonista de SUR1 que bloquea el canal de NCCa-ATP para su uso en (a) la prevención o el tratamiento de la inflamación de las células neurales […]
Inhibidores de ERK y sus usos, del 8 de Abril de 2020, de Celgene CAR LLC: Un compuesto de fórmula VIII: **(Ver fórmula)** o una de sus sales farmacéuticamente aceptables, en donde: el anillo A se selecciona de **(Ver fórmula)** […]
Procedimiento de uso de inmunoconjugados anti-CD79b, del 8 de Abril de 2020, de F. HOFFMANN-LA ROCHE AG: Un inmunoconjugado que comprende un anticuerpo anti-CD79b unido a un agente citotóxico para su uso en un procedimiento para tratar un trastorno proliferativo […]
IMIPRAMINA PARA USO COMO INHIBIDOR DE LA SOBREXPRESIÓN DE LA FASCINA 1, del 2 de Abril de 2020, de FUNDACION UNIVERSITARIA SAN ANTONIO: La presente invención se refiere a imipramina para su uso como inhibidor de la sobreexpresión de la fascina 1, preferiblemente dicha sobreexpresión de la fascina 1 está asociada […]
Mutación novedosa del receptor de andrógenos, del 25 de Marzo de 2020, de NOVARTIS AG: Una composicion terapeutica para su uso en el tratamiento de un paciente que padece cancer de prostata o de mama, asociado con una mutacion del receptor de […]
Composiciones y métodos para la distribución de moléculas en células vivas, del 25 de Marzo de 2020, de THE TEXAS A & M UNIVERSITY SYSTEM: Un compuesto que tiene la fórmula: **(Ver fórmula)** En donde X es un resto de unión, Y es un residuo de aminoácido acoplado de forma covalente […]