OPTIMIZACIÓN DEL TRATAMIENTO DE LEUCEMIA DE FILADELFIA POSITIVA CON EL IMATINIB INHIBIDOR DE LA TIROSINA QUINASA ABL.
Uso de Imatinib o una sal farmacéuticamente aceptable de este para la fabricación de un medicamento,
para el tratamiento de una leucemia Ph+, en donde (a) una cantidad diaria fija, predeterminada entre 200 y 800 mg de la sal mono-mesilato de Imatinib se debe administrar por vía oral a un paciente humano que sufre de una leucemia Ph+, (b) al menos una muestra de sangre de dicho paciente, que se recolecta en los primeros 3 meses de tratamiento, (c) el nivel mínimo en plasma (Cmin) de Imatinib se debe determinar, y (d) la dosis de Imatinib o una sal farmacéuticamente aceptable de este, se debe ajustar de una manera que una Cmin entre 1000 y 3000 ng/mL de Imatinib se logra, cuando el paciente no alcanza una Cmin entre 1000 y 3000 ng/mL de Imatinib, después de la administración de la cantidad fija, predeterminada de la sal mono-mesilato de Imatinib
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/078978.
Solicitante: NOVARTIS AG.
Nacionalidad solicitante: Suiza.
Dirección: LICHTSTRASSE 35 4056 BASEL SUIZA.
Inventor/es: MAHON,FRANCOIS-XAVIER, GATHMANN,Insa, MOLIMARD,Mathieu, PICARD,Stéphane, WANG,Yanfeng.
Fecha de Publicación: .
Fecha Solicitud PCT: 20 de Septiembre de 2007.
Clasificación Internacional de Patentes:
- A61K31/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen ingredientes orgánicos activos.
- A61K31/506 A61K […] › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › no condensadas y conteniendo otros heterociclos.
Clasificación PCT:
- A61K31/00 A61K […] › Preparaciones medicinales que contienen ingredientes orgánicos activos.
- A61K31/506 A61K 31/00 […] › no condensadas y conteniendo otros heterociclos.
- A61K49/00 A61K […] › Preparaciones para examen in vivo.
- A61P35/02 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 35/00 Agentes antineoplásicos. › específicos para la leucemia.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2359465_T3.pdf



Fragmento de la descripción:
La presente invención se relaciona con el uso de la sal mono-mesilato de imatinib, para tratar la leucemia positiva para Filadelfia (leucemia Ph+) en una población de pacientes humanos. En un aspecto particular, la presente invención se relaciona con el uso de la sal mono-mesilato de imatinib, para tratar la leucemia mieloide crónica (CML) 5 en una población de pacientes humanos.
En la CML una translocación cromosómica balanceada recíprocamente en células madre hematopoyéticas (HSCs) produce el gen hibrido BCR-ABL. Este último codifica la proteína de fusión oncogénica Bcr-Abl. Considerando que ABL codifica una proteína tirosina quinasa regulada firmemente, que juega un papel fundamental en la regulación de la proliferación, adherencia y apoptosis celular, el gen de fusión BCR-ABL codifica como quinasa activada 10 constitutivamente, que transforma HSCs para producir un fenotipo que muestra la proliferación clonal desregulada, la capacidad reducida a la adherencia con el estroma de la médula ósea y una respuesta apoptótica reducida a los estímulos mutagénicos, que le permiten acumular progresivamente más transformaciones malignas. Los granulocitos resultantes no se desarrollan en los linfocitos maduros y se liberan en la circulación, que conduce a una deficiencia en las células maduras y susceptibilidad aumentada a la infección. Se ha descrito que, los inhibidores 15 competitivos de ATP de Bcr-Abl previenen la quinasa a partir de la activación de rutas mitogénicas y anti-apoptóticas (por ejemplo quinasa P-3 y STAT5), que conducen a la muerte de las células del fenotipo BCR-ABL y proporcionando así una terapia efectiva contra CML.
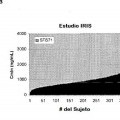
En mayo del 2001, la sal de mesilato de N-{5-[4-(4-metil-piperazino-metil)-benzoilamido]-2-metilfenil}-4-(3-piridil)-2-pirimidina-amina (Mesilato de imatinib, STI571, Glivec®) fue aprobado por la FDA para el tratamiento de CML, en 20 pacientes que no han podido beneficiarse de la terapia IFN-alfa. Ya en Junio 2000, los primeros pacientes con CML fueron incluidos en el Estudio Aleatorizado Internacional de Interferon y STI571 (IRIS). Esta ambiciosa prueba de 3 fases fue única tanto en tamaño como alcance. Los investigadores de IRIS, reclutaron a más de 1000 pacientes en 16 países para conducir un estudio comparativo entre Glivec e interferon-alfa (S.G. O'Brien, F. Guilhot, R.A. Larson, et al, N. Engl. J. Med. 2003, 348: 994-1004). El Imatinib a una dosis de 400 mg diarios ha mostrado una eficacia 25 superior al IFN+Ara-C en pacientes recién diagnosticados con CML en fase crónica (CML-CP). Recientemente, los datos del seguimiento de cinco años del IRIS, indicaron una velocidad acumulada estimada de la respuesta citogénica completa (CCR) del 87% entre los pacientes que recibieron imatinib como tratamiento de primera línea y una supervivencia global del 89% (Druker BJ, Guilhot F, O'Brien SG, et al on behalf of the IRIS Investigators. Five-Year Follow-up of Imatinib Therapy for Newly Diagnosed Myeloid Leukemia in Chronic-Phase Shows Sustained 30 Responses and High Overall Survival. New Eng J Med 2006; 355:2408-17). Cabe anotar que ningún paciente de los que alcanzaron la CCR y la respuesta molecular principal (MMR) dentro de los 18 meses del inicio de terapia ha progresado a una fase acelerada o blástica en los 60 meses.
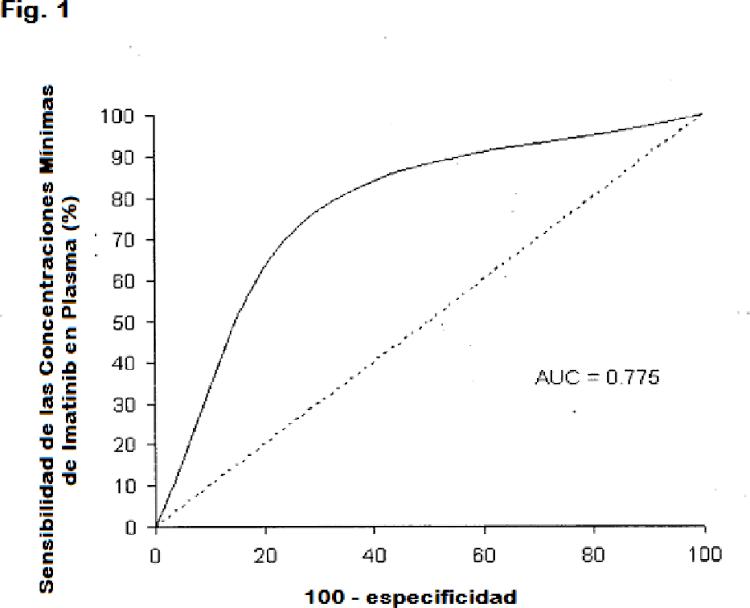
Sin embargo, las respuestas variables al Mesilato de imatinib en el tratamiento de CML crónica no se conocen suficientemente. Estudios previos se centraron en los mecanismos celulares de resistencia al Imatinib. Considerando 35 que el seguimiento farmacocinético, se utiliza ampliamente en diferentes especialidades médicas, tales como neurología, cardiología, y psiquiatría, rara vez esto se ha aplicado en la práctica oncológica clínica. Estudios farmacocinéticos en pacientes con CML que se tratan con Mesilato de imatinib, mostraron que las concentraciones mínimas en plasma de Imatinib se correlacionan con la dosis del Mesilato de imatinib, mientras que el peso corporal o superficie corporal son de menor importancia. Peng et al., determinó la concentración mínima de Imatinib en 40 plasma y ajustó el régimen de Imatinib de acuerdo con los parámetros de concentración en plasma (Peng B., Hayes M., Resta, D. et al, J. Clin. Oncol. 2004, 22, 935-942). Mahon et al. (Blood. 106(11, Part 1). Nov. 16 2005. 565A) midió la concentración de Imatinib en sangre en apoyo del régimen de tratamiento.
La presente invención resuelve el problema de minimizar o evitar los temas de tolerancia, la falta de eficacia y el riesgo de recaída en pacientes humanos con CML que se tratan con un inhibidor de la tirosina quinasa Bcr-Abl. 45 Basándose en el análisis de un estudio realizado en la Universidad de Burdeos y los datos del estudio IRIS que correlacionan los datos farmacocinéticos con la respuesta citogénica y molecular en pacientes recientemente diagnosticados con CML en fase crónica (CML-CP), en la actualidad se encontró sorprendentemente que el tratamiento de CML, utilizando un inhibidor de la tirosina quinasa Bcr-Abl, se puede optimizar ajustando la dosis del inhibidor de la tirosina quinasa Bcr-Abl aplicada a un paciente individual, de manera que un nivel mínimo en plasma 50 específico (Cmin), se logra en cada paciente individual. Un ajuste individual para cada paciente se necesita en vista de la alta intervariabilidad del paciente de los valores de Cmin, bajo la administración de la misma dosis del inhibidor de la tirosina quinasa Bcr-Abl a cada paciente como se observa en el estudio IRIS. La presente invención proporciona, por primera vez un programa de tratamiento individualizado para pacientes individuales con CML basándose en un umbral inferior de Cmin, el cual se ha demostrado que se correlaciona con una mayor probabilidad 55 de supervivencia.
CML pertenece al grupo de leucemia Ph+. Los resultados obtenidos con la población de pacientes con CML descritos en este documento se pueden transferir directamente a todo el grupo de las leucemias Ph+. La razón de ello es que el rasgo de caracterización de leucemias Ph+, es la existencia del cromosoma Filadelfia causante de la proteína de fusión Bcr-Abl. Esta última proteína es el objetivo de todos los inhibidores de Bcr-Abl.
La abreviatura "Ph+ ALL" como se utiliza en este documento indica leucemia linfoblástica aguda positiva para el 5 cromosoma de Filadelfia.
El término "respuesta molecular principal (MMR)" como se utiliza en este documento significa una reducción de 3 logaritmos en las transcripciones BCR-ABL, cuantificada de la sangre periférica utilizando la reacción en cadena de la polimerasa transcriptasa reversa cuantitativa de tiempo real, preferiblemente después de 12 meses de terapia, por ejemplo terapia con Mesilato de imatinib de 12 meses. 10
El término "respuesta citogénica completa (CCR)" como se utiliza en este documento significa 0 % de metafases positiva para el cromosoma Filadelfia entre al menos 20 o 25 células en metafase en el aspirado de médula ósea (Colombat M, Fort MP, Chollet C, et al. Molecular remission in chronic myeloid leukemia patients with sustained complete cytogenetic remission after imatinib mesylate treatment. Haematologica 2006;91:162-8.).
El término "uso" como se utiliza en este documento se relaciona también con la prevención de las enfermedades 15 mencionadas en este documento, i.e. la administración profiláctica de una composición farmacéutica que comprende un inhibidor de la tirosina quinasa Bcr-Abl de acuerdo con la invención a pacientes sanos para prevenir el desarrollo de las enfermedades mencionadas en este documento.
Los términos "ajuste de la dosis" y "la dosis de ... se ajustó" como se utiliza en este documento preferiblemente indica que la dosis se refiere a su aumento o disminución. En un sentido más amplio de la invención, los términos 20 "ajuste de la dosis" y la "dosis de ... se ajustó" abarca una situación en donde la dosis se mantiene sin cambio.
El término "inhibidor de la tirosina quinasa Bcr-Abl" de acuerdo con la invención como se utiliza en este documento se relaciona con la sal de monomesilato de imatinib que muestra inhibición de c-Abl o Bcr-Abl, a partir de lisados de células transfectadas con un valor de IC50 por debajo de 0.1 µM en ensayos de quinasa in vitro realizados en inmunoprecipitados en un ensayo como se describe por B.J. Druker et al in Nat. Med. 1996, 2, 561-566. ng/mL. El 25 límite superior del nivel de plasma corresponde al nivel más cercano por debajo del nivel sanguíneo que causa la toxicidad limitante de la dosis (DLT) en un paciente individual. Por... [Seguir leyendo]
Reivindicaciones:
1. Uso de Imatinib o una sal farmacéuticamente aceptable de este para la fabricación de un medicamento, para el tratamiento de una leucemia Ph+, en donde
(a) una cantidad diaria fija, predeterminada entre 200 y 800 mg de la sal mono-mesilato de Imatinib se debe administrar por vía oral a un paciente humano que sufre de una leucemia Ph+, 5
(b) al menos una muestra de sangre de dicho paciente, que se recolecta en los primeros 3 meses de tratamiento,
(c) el nivel mínimo en plasma (Cmin) de Imatinib se debe determinar, y
(d) la dosis de Imatinib o una sal farmacéuticamente aceptable de este, se debe ajustar de una manera que una Cmin entre 1000 y 3000 ng/mL de Imatinib se logra, cuando el paciente no alcanza una Cmin entre 1000 y 3000 ng/mL de Imatinib, después de la administración de la cantidad fija, predeterminada de la sal mono-mesilato de 10 Imatinib.
2. El uso de acuerdo con la reivindicación 1, en donde la leucemia Ph+, es una leucemia linfoblástica aguda positiva para el cromosoma de Filadelfia (Ph+ ALL) o una leucemia mieloide crónica (CML).
3. El uso de acuerdo con la reivindicación 1, en donde en la etapa (a), se administra una dosis diaria de 400 mg de la sal mono-mesilato de Imatinib. 15
Patentes similares o relacionadas:
Uso de inhibidores de la PDE4 para la profilaxis y/o la terapia de la dislipoproteinemia y trastornos relacionados, del 27 de Mayo de 2020, de Albert-Ludwigs-Universität Freiburg: Inhibidor específico de la fosfodiesterasa 4 (PDE 4) para uso en el tratamiento profiláctico o terapéutico de la dislipoproteinemia, en donde el inhibidor […]
Métodos y composiciones para trastornos relacionados con la proliferación celular, del 27 de Mayo de 2020, de Agios Pharmaceuticals, Inc: Un método in vitro para diagnosticar a un sujeto que tiene un trastorno relacionado con la proliferación celular o que se sospecha que tiene un trastorno relacionado con […]
Un canal catiónico no selectivo en células neurales y compuestos que bloquean el canal para su uso en el tratamiento de la inflamación del cerebro, del 6 de Mayo de 2020, de UNIVERSITY OF MARYLAND, BALTIMORE: Un antagonista de SUR1 que bloquea el canal de NCCa-ATP para su uso en (a) la prevención o el tratamiento de la inflamación de las células neurales […]
Inhibidores de ERK y sus usos, del 8 de Abril de 2020, de Celgene CAR LLC: Un compuesto de fórmula VIII: **(Ver fórmula)** o una de sus sales farmacéuticamente aceptables, en donde: el anillo A se selecciona de **(Ver fórmula)** […]
Procedimiento de uso de inmunoconjugados anti-CD79b, del 8 de Abril de 2020, de F. HOFFMANN-LA ROCHE AG: Un inmunoconjugado que comprende un anticuerpo anti-CD79b unido a un agente citotóxico para su uso en un procedimiento para tratar un trastorno proliferativo […]
IMIPRAMINA PARA USO COMO INHIBIDOR DE LA SOBREXPRESIÓN DE LA FASCINA 1, del 2 de Abril de 2020, de FUNDACION UNIVERSITARIA SAN ANTONIO: La presente invención se refiere a imipramina para su uso como inhibidor de la sobreexpresión de la fascina 1, preferiblemente dicha sobreexpresión de la fascina 1 está asociada […]
Mutación novedosa del receptor de andrógenos, del 25 de Marzo de 2020, de NOVARTIS AG: Una composicion terapeutica para su uso en el tratamiento de un paciente que padece cancer de prostata o de mama, asociado con una mutacion del receptor de […]
Composiciones y métodos para la distribución de moléculas en células vivas, del 25 de Marzo de 2020, de THE TEXAS A & M UNIVERSITY SYSTEM: Un compuesto que tiene la fórmula: **(Ver fórmula)** En donde X es un resto de unión, Y es un residuo de aminoácido acoplado de forma covalente […]