MÉTODOS PARA USAR CÉLULAS DERIVADAS DE TEJIDO ADIPOSO EN EL TRATAMIENTO DE AFECCIONES CARDIOVASCULARES.
El uso de una composición que comprende una población concentrada de células derivadas de tejido adiposo (ADC) en la fabricación de un medicamento para restablecer el flujo sanguíneo en un sujeto que se ha determinado que tiene una isquemia,
en el que dicha población concentrada de células derivadas de tejido adiposo (ADC) com- prende células progenitoras derivadas de tejido adiposo y células madre de tejido adiposo obtenidas procesando el tejido adiposo de dicho paciente en un sistema que está configurado para mantener una ruta de fluido/tejido cerrada estéril, y dicho sistema comprende una cámara de recogida conectada a una cámara de mezcla/procesamiento
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/005117.
Solicitante: CYTORI THERAPEUTICS, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 3020 CALLAN ROAD SAN DIEGO, CALIFORNIA 92121 ESTADOS UNIDOS DE AMERICA.
Inventor/es: FRASER,JOHN,K, HEDRICK,MARC,H, DANIELS,ERIC, ZHU,Min, STREM,Brian,M, WULUR,Isabella.
Fecha de Publicación: .
Fecha Solicitud PCT: 20 de Febrero de 2004.
Clasificación Internacional de Patentes:
- C12N5/06B26P
- C12N5/06B28
Clasificación PCT:
- A01N63/00 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01N CONSERVACION DE CUERPOS HUMANOS O ANIMALES O DE VEGETALES O DE PARTES DE ELLOS (conservación de alimentos o productos alimenticios A23 ); BIOCIDAS, p. ej. EN TANTO QUE SEAN DESINFECTANTES, PESTICIDAS O HERBICIDAS (preparaciones de uso médico, dental o para el aseo que eliminan o previenen el crecimiento o la proliferación de organismos no deseados A61K ); PRODUCTOS QUE ATRAEN O REPELEN A LOS ANIMALES; REGULADORES DEL CRECIMIENTO DE LOS VEGETALES. › Biocidas, productos que repelen o atraen a los animales perjudiciales, o reguladores del crecimiento de los vegetales, que contienen microorganismos, virus, hongos microscópicos, animales, o sustancias producidas por, u obtenidas a partir de microorganismos, virus, hongos microscópicos o animales, p. ej. encimas o productos de fermentación (que contienen compuestos de constitución determinada A01N 27/00 - A01N 59/00; algas unicelulares A01N 65/03).
- C12N5/00 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
Clasificación antigua:
- C12N1/00 C12N […] › Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2373551_T3.pdf
Fragmento de la descripción:
Metodos para usar celulas derivadas de tejido adiposo en el tratamiento de afecciones cardiovasculares ANTECEDENTES DE LA INVENCION
1. Campo de la Invenci6n
Esta invenci6n se refiere en general al uso de una composici6n que comprende una poblaci6n concentrada de celulas derivadas de tejido adiposo (ADC) en la fabricaci6n de un medicamento para restablecer el flujo sangufneo en un sujeto que se ha determinado que tiene una isquemia, en la que dicha poblaci6n concentrada de celulas derivadas de tejido adiposo (ADC) comprende celulas progenitoras derivadas de tejido adiposo y celulas madre de tejido adiposo obtenidas procesando el tejido adiposo de dicho paciente en un sistema que esta configurado para mantener una ruta de fluidos/tejidos cerrada esteril, y dicho sistema comprende una camara de recogida conectada a una camara de mezcla/procesamiento.
2. Descripci6n de la Tecnica Relacionada
Las enfermedades y trastornos cardiovasculares son la causa principal de muerte y discapacidad en todas las na
ciones industrializadas. Solamente en los Estados Unidos, la enfermedad cardiovascular es responsable de alrede
dor del 40 por ciento de la tasa de mortalidad, y afecta a 58 millones de americanos (AmericanHeartAssociation, 2002) . Uno de los factores principales que hace que la enfermedad cardiovascular sea especialmente devastadora es la incapacidad del coraz6n de repararse tras la lesi6n. Debido a que las celulas musculares cardiacas, es decir, las celulas miocardicas, son incapaces de dividirse y repoblar las areas lesionadas, la perdida de celulas cardiacas como resultado de la lesi6n o la enfermedad es en gran parte irreversible (Abbate et al, 2002; Remme, 2000) .
De las formas disponibles de terapia, los trasplantes de coraz6n de ser humano a ser humano han sido las mas eficaces para tratar las enfermedades y trastornos cardiovasculares graves. De hecho, actualmente la tasa de supervivencia a un ano y cinco anos del receptor de trasplante cardiaco medio es superior al 70 por ciento. Desafortunadamente, sin embargo, el trasplante es una forma gravemente limitada de terapia por varias razones, concretamente, la escasez de donantes adecuados, el coste del procedimiento y la probabilidad elevada de rechazo del injerto y problemas asociados tales como infecciones, disfunci6n renal y canceres relacionados con los inmunodepresores (AmericanHeartAssociation, 2002) .
Una alternativa a la terapia de trasplante es el uso de la medicina regenerativa para reparar y regenerar las celulas musculares cardiacas danadas. La medicina regenerativa aprovecha, de una manera dirigida clfnicamente, la capacidad de las celulas madre (es decir, las celulas maestras sin especializar del cuerpo) de renovarse indefinidamente y desarrollarse hasta celulas especializadas maduras. Las celulas madre se hallan en los embriones durante las etapas tempranas del desarrollo, en el tejido fetal y en algunos 6rganos y tejidos adultos (Pera et al., 2000) . Se sabe que las celulas madre embrionarias (denominadas mas adelante en la presente memoria "ESCs") se convierten en muchos, si no todos, los tipos de celulas y tejidos del cuerpo. Las ESCs no solamente contienen toda la informaci6n genetica del individuo, sino que tambien contienen la capacidad nata de convertirse en cualquiera de las mas de 200
celulas y tejidos del cuerpo. Asf, estas celulas tienen un potencial enorme para la medicina regenerativa. Por ejemplo, las ESCs se pueden cultivar hasta tejidos especfficos tales como coraz6n, pulm6n o rin6n, que se podrfan usar despues para reparar 6rganos lesionados y enfermos (Assady et al., 2001; Jacobson et al., 2001; Odorico et al., 2001) . Sin embargo, los tejidos derivados de ESCs tienen limitaciones clfnicas. Debido a que las ESCs derivan necesariamente de otro individuo, es decir, un embri6n, existe el riesgo de que el sistema inmunitario del receptor re
chace el material biol6gico nuevo. Aunque hay disponibles farmacos inmunodepresores para evitar dicho rechazo, se sabe que tales farmacos tambien bloquean respuestas inmunitarias deseables, tales como hacia las infecciones bacterianas y virus. Ademas, el debate etico sobre la fuente de las ESCs, es decir, los embriones, esta bien documentado y presenta un obstaculo adicional y, quizas, insuperable para un futuro previsible.
Las celulas madre de adulto (denominadas de forma intercambiable "ASCs" mas adelante en la presente memoria)
45 representan una alternativa al uso de ESCs. Las ASCs residen discretamente en muchos tejidos no embrionarios, supuestamente esperando para responder a traumatismos u otros procesos patol6gicos destructivos, de manera que puedan curar el tejido lesionado (Arvidsson et al., 2002; BonnerWeir y Sharma, 2002; Clarke y Frisen, 2001; Crosby y Strain, 2001; Jiang et al., 2002a) . Notablemente, las pruebas cientfficas emergentes indican que cada individuo porta un grupo de ASCs que pueden compartir con las ESCs la capacidad de convertirse en muchos, si no en todos, 50 los tipos de celulas y tejidos (Young et al., 2001; Jiang et al., 2002a; Jiang et al., 2002b; Schwartz et al., 2002) . Asf, las ASCs, como las ESCs, tienen un potencial enorme para las aplicaciones clfnicas de la medicina regenerativa.
Se ha demostrado que las poblaciones de ASCs estan presentes en uno o mas de medula 6sea, piel, musculo, hfgado y cerebro (Jiang et al., 2002b; Alison, 1998; Crosby y Strain, 2001) . Sin embargo, la frecuencia de ASCs en estos tejidos es baja. Por ejemplo, se estima que la frecuencia de las celulas madre mesenquimatosas en la medula 55 6sea es entre 1 en 100.000 y 1 en 1.000.000 de celulas nucleadas (D'Ippolito et al., 1999; Banfi et al., 2001; Falla et al., 1993) . De forma similar, la extracci6n de ASCs de la piel implica una serie complicada de etapas de cultivo celular durante varias semanas (Toma et al., 2001) y la aplicaci6n clfnica de ASCs derivadas de musculo esqueletico requiere una fase de cultivo de dos a tres semanas (Hagege et al., 2003) . Asf, cualquier aplicaci6n clfnica propuesta
de las ASCs a partir de tales tejidos requiere incrementar el numero de celulas, la pureza y la madurez mediante procedimientos de purificaci6n celular y de cultivo celular.
Aunque las etapas de cultivo celular pueden proporcionar un numero de celulas, pureza y madurez incrementadas, lo hacen con cierto coste. Este coste puede incluir una o mas de las siguientes dificultades tecnicas: perdida de la funci6n celular debido al envejecimiento celular, perdida de poblaciones de celulas que no son celulas madre potencialmente utiles, retrasos en la aplicaci6n potencial de las celulas a los pacientes, coste econ6mico incrementado y riesgo incrementado de contaminaci6n de las celulas con microorganismos ambientales durante el cultivo. Los estudios recientes que examinan los efectos terapeuticos de ASCs derivadas de medula 6sea han usado esencialmente medula 6sea completa para evitar los problemas asociados al cultivo celular (Horwitz et al., 2001; Orlic et al., 2001; Stamm et al., 2003; Strauer et al., 2002) . Los beneficios clfnicos, sin embargo, han sido sub6ptimos, un resultado relacionado casi con toda seguridad con la dosis y pureza limitadas de las ASCs disponibles intrfnsecamente en la medula 6sea.
Recientemente, se ha demostrado que el tejido adiposo es una fuente de ASCs (Zuk et al., 2001; Zuk et al., 2002) . El documento WO 00/53795 describe celulas madre derivadas de tejido adiposo y mallas, p.ej. celulas madre derivadas de tejido adiposo sustancialmente exentas de adipocitos y eritrocitos sangufneos y poblaciones clonales de celulas madre de tejido conectivo. Las celulas se pueden emplear, solas o en composiciones biol6gicamente compatibles, para generar tejidos y estructuras diferenciadas, tanto in vivo como in vitro. A diferencia de la medula 6sea, la piel, el musculo, el hfgado y el cerebro, el tejido adiposo es comparativamente facil de recoger en cantidades relativamente grandes (Commons et al., 2001; Katz et al., 2001b) . Ademas, se ha mostrado que las ASCs derivadas de tejido adiposo poseen la capacidad de generar multiples tejidos in vitro, lo que incluye hueso, grasa, cartflago y musculo (Ashjian et al., 2003; Mizuno et al., 2002; Zuk et al., 2001; Zuk et al., 2002) . Asf, el tejido adiposo representa una fuente 6ptima de ASCs para su uso en la medicina regenerativa. Los metodos adecuados para recoger ASCs derivadas de tejido adiposo, sin embargo, son escasos en la tecnica. Los metodos existentes poseen varios defectos. Por ejemplo, los metodos existentes carecen de la capacidad de acomodar de forma 6ptima un dispositivo de aspiraci6n... [Seguir leyendo]
Reivindicaciones:
1. El uso de una composici6n que comprende una poblaci6n concentrada de celulas derivadas de tejido adiposo (ADC) en la fabricaci6n de un medicamento para restablecer el flujo sangufneo en un sujeto que se ha determinado que tiene una isquemia, en el que dicha poblaci6n concentrada de celulas derivadas de tejido adiposo (ADC) comprende celulas progenitoras derivadas de tejido adiposo y celulas madre de tejido adiposo obtenidas procesando el tejido adiposo de dicho paciente en un sistema que esta configurado para mantener una ruta de fluido/tejido cerrada esteril, y dicho sistema comprende una camara de recogida conectada a una camara de mezcla/procesamiento.
2. El uso de acuerdo con la reivindicaci6n 1, en el que dicha poblaci6n concentrada de celulas comprende al menos 500 celulas progenitoras endoteliales/mill6n de celulas derivadas de tejido adiposo.
3. El uso de acuerdo con la reivindicaci6n 1, en el que dicha afecci6n isquemica comprende la insuficiencia cardiaca congestiva.
4. El uso de acuerdo con la reivindicaci6n 1, en el que dicha afecci6n isquemica es infarto de miocardio.
5. El uso de acuerdo con la reivindicaci6n 1, en el que dicho sujeto es diabetico.
6. El uso de acuerdo con la reivindicaci6n 1, en el que dicho sujeto es obeso.
7. El uso de acuerdo con la reivindicaci6n 1, en el que dicha composici6n comprende una inyecci6n rapida de dichas celulas derivadas de tejido adiposo.
8. El uso de acuerdo con la reivindicaci6n 1, en el que dicha composici6n proporciona entre 55.000 y 550.000 celulas madre derivadas de tejido adiposo.
9. El uso de acuerdo con la reivindicaci6n 1, en el que dicha composici6n comprende ademas uno o mas factores angiogenicos.
10. El uso de acuerdo con la reivindicaci6n 1, en el que dicha poblaci6n de celulas se caracteriza por tener expresi6n del factor de crecimiento endotelial vascular (VEGF) cuando se cultiva.
11. El uso de acuerdo con la reivindicaci6n 1, en el que dicha poblaci6n de celulas se caracteriza por tener expresi6n del factor de crecimiento de placenta (PLGF) cuando se cultiva.
12. El uso de acuerdo con la reivindicaci6n 1, en el que dicha composici6n comprende ademas uno o mas factores arteriogenicos.
13. El uso de acuerdo con la reivindicaci6n 1, en el que dicha composici6n comprende ademas uno o mas factores inmunodepresores.
14. El uso de acuerdo con la reivindicaci6n 1, en el que dichas celulas derivadas de tejido adiposo no se cultivan en un cultivo.
15. El uso de acuerdo con la reivindicaci6n 1, en el que dichas celulas derivadas de tejido adiposo se cultivan en un cultivo celular.
16. El uso de acuerdo con la reivindicaci6n 15, en el que dichas celulas derivadas de tejido adiposo se cultivan en condiciones de cultivo que favorecen la diferenciaci6n hacia un fenotipo miocftico.
17. El uso de acuerdo con la reivindicaci6n 16, en el que dicho fenotipo miocftico es un fenotipo miocftico cardiaco.
18. El uso de acuerdo con la reivindicaci6n 16, en el que dicho fenotipo miocftico es un fenotipo miocftico esqueletico.
19. El uso de acuerdo con la reivindicaci6n 16, en el que dicho fenotipo miocftico es un fenotipo miocftico de musculo liso vascular.
20. El uso de acuerdo con la reivindicaci6n 15, en el que dichas celulas derivadas de tejido adiposo se cultivan en condiciones de cultivo que favorecen la diferenciaci6n hacia un fenotipo endotelial.
21. El uso de acuerdo con la reivindicaci6n 15, en el que dicho cultivo celular se lleva a cabo en un material de soporte para generar una construcci6n bidimensional o tridimensional que se puede colocar sobre o dentro del coraz6n.
22. El uso de acuerdo con la reivindicaci6n 21, en el que dicho material de soporte es reabsorbible in vivo.
23. El uso de acuerdo con la reivindicaci6n 1, en el que las celulas progenitoras endoteliales derivadas de tejido adiposo se modifican mediante transferencia genica.
24. El uso de acuerdo con la reivindicaci6n 23, en el que dicha modificaci6n altera la angiogenesis.
25. El uso de acuerdo con la reivindicaci6n 23, en el que dicha modificaci6n altera la arteriogenesis.
26. El uso de acuerdo con la reivindicaci6n 23, en el que dicha modificaci6n altera la apoptosis.
27. El uso de acuerdo con la reivindicaci6n 26, en el que dichas celulas progenitoras endoteliales derivadas de tejido adiposo modificadas se pueden diferenciar hasta miocitos cardiacos con una apoptosis alterada.
28. El uso de acuerdo con la reivindicaci6n 23, en el que dicha modificaci6n altera las propiedades de guiado de dichas celulas derivadas de tejido adiposo.
Expresion de VEGF 'pg 106 celulasi
Expresion de VEGF por ADC
Don. Normal 1 Don. Normal 2 Diabetico Expresion de PIGF 'pg 106 celulasi
Expresion de PIGF por ADC
Don. Normal 1 Don. Normal 2 Diabetico ID del Donante ID del Donante
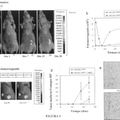
FIGURA 6
Figura 6: Tinci6n con UEA1 de una colonia de EPC derivadas de ADC
FIGURA 8
Flujo medio de sangre en el modelo de isquemia de las extremidades posteriores en ratones SCID tratados con PLA de humano diabetico
Porcentaje de ;lujo Contr. Neg. Trat. con PLA
Patentes similares o relacionadas:
PROCEDIMIENTOS DE USO DE CÉLULAS REGENERATIVAS PARA PROMOVER LA CICATRIZACIÓN DE HERIDAS, del 19 de Septiembre de 2011, de CYTORI THERAPEUTICS, INC: Uso de una población concentrada de células regenerativas obtenidas de tejido adiposo que comprende células madre en la preparación de un […]
CELULAS MADRE MULTIPOTENCIALES OBTENIDAS DEL TIMO DE UN ADULTO, del 15 de Septiembre de 2011, de FUNDACION INSTITUTO MEDITERRANEO PAA LA BIOTECNOLOGIA Y LA INVESTIGACION SANITARIA (IMABIS): La presente invención se refiere a células madre multipotenciales obtenidas del timo de un adulto y, preferiblemente, del tejido adiposo, con capacidad para diferenciarse y […]
PROCEDIMIENTO DE USO DE CÉLULAS DERIVADAS DE TEJIDO ADIPOSO EN EL TRATAMIENTO DE AFECCIONES CARDIOVASCULARES, del 12 de Septiembre de 2011, de CYTORI THERAPEUTICS, INC: Uso de una población concentrada de células que comprende células madre derivadas de tejido adiposo en la fabricación de un medicamento para el tratamiento de un […]
CELULAS MADRE MULTIPOTENTES DERIVADAS DE ESTROMA DE MESENTERIO, del 28 de Julio de 2011, de FUNDACION INSTITUTO MEDITERRANEO PARA LA BIOTECNOLOGIA Y LA INVESTIGACION SANITARIA (IMABIS): La presente invención se encuadra en el campo de la biomedicina y se refiere a células madre multipotentes derivadas de estroma de mesenterio, y, preferiblemente, […]
PROCEDIMIENTOS DE USO DE CÉLULAS REGENERATIVAS EN EL TRATAMIENTO DE TRASTORNOS Y ENFERMEDADES RENALES, del 3 de Febrero de 2011, de CYTORI THERAPEUTICS, INC: Uso de una composición que comprende células regenerativas derivadas de tejido adiposo en la fabricación de un medicamento para el tratamiento […]
IDENTIFICACION Y AISLAMIENTO DE CELULAS MULTIPOTENTES DE TEJIDO MESENQUIMAL NO OSTEOCONDRAL, del 23 de Diciembre de 2009, de CELLERIX, S.L. UNIVERSIDAD AUTONOMA DE MADRID: Esta invención se refiere a la identificación y aislamiento de células multipotentes de tejido mesenquimal no osteocondral. En concreto se refiere a una célula adulta multipotente […]
 CONSTRUCTOS DE TRASPLANTE TISULAR PREVASCULARIZADOS PARA LA RECONSTRUCCIÓN DE UN ÓRGANO HUMANO O ANIMAL, del 23 de Mayo de 2011, de UroTec GmbH: Procedimiento de fabricación de un constructo de trasplante tisular para reconstruir un órgano humano o animal, en el que el constructo de trasplante tisular consta de una […]
CONSTRUCTOS DE TRASPLANTE TISULAR PREVASCULARIZADOS PARA LA RECONSTRUCCIÓN DE UN ÓRGANO HUMANO O ANIMAL, del 23 de Mayo de 2011, de UroTec GmbH: Procedimiento de fabricación de un constructo de trasplante tisular para reconstruir un órgano humano o animal, en el que el constructo de trasplante tisular consta de una […]
 MODELO ANIMAL DE ANGIOGENESIS HUMANA Y SUS APLICACIONES, del 2 de Febrero de 2011, de UNIVERSIDAD AUTONOMA DE MADRID: La presente invención se relaciona con un modelo animal de angiogénesis humana para la monitorización cuantitativa y no invasiva de dicho proceso de angiogénesis in vivo mediante […]
MODELO ANIMAL DE ANGIOGENESIS HUMANA Y SUS APLICACIONES, del 2 de Febrero de 2011, de UNIVERSIDAD AUTONOMA DE MADRID: La presente invención se relaciona con un modelo animal de angiogénesis humana para la monitorización cuantitativa y no invasiva de dicho proceso de angiogénesis in vivo mediante […]