MODELO ANIMAL DE ANGIOGENESIS HUMANA Y SUS APLICACIONES.
La presente invención se relaciona con un modelo animal de angiogénesis humana para la monitorización cuantitativa y no invasiva de dicho proceso de angiogénesis in vivo mediante imagen molecular,
en particular, mediante imagen por bioluminiscencia. En concreto, los inventores han observado que cuando se inoculan en un animal no humano células endoteliales junto con células madre mesenquimales primarias, dichas células endoteliales tienen la capacidad de formar una red de vasos sanguíneos en dicho animal. Asimismo, la invención se relaciona con el uso de dichos modelos de angiogénesis para conseguir la secreción al torrente sanguíneo de proteínas de interés terapéutico
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200802993.
Solicitante: UNIVERSIDAD AUTONOMA DE MADRID.
Nacionalidad solicitante: España.
Provincia: MADRID.
Inventor/es: ALVAREZ VALLINA,LUIS, SANZ ALCOBER,LAURA, CUESTA MARTINEZ,ANGEL, COMPTE GRAU,MARTA, BONILLA VELASCO,FELIX, ALONSO CAMINO,VANESA, ALONSO CAMINO,VANESSA, SANCHEZ MARTIN,DAVID, SANTOS VALLE,PATRICIA.
Fecha de Solicitud: 22 de Octubre de 2008.
Fecha de Publicación: .
Fecha de Concesión: 21 de Enero de 2011.
Clasificación Internacional de Patentes:
- A01K67/027M
- C12N15/86 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Vectores virales.
- C12N5/06B21P
- C12N5/06B28
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
Clasificación PCT:
- A01K67/027 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01K CRÍA DE ANIMALES; AVICULTURA; APICULTURA; PISCICULTURA; PESCA; ANIMALES PARA CRIA O REPRODUCCIÓN, NO PREVISTOS EN OTRO LUGAR; NUEVAS VARIEDADES DE ANIMALES. › A01K 67/00 Cría u obtención de animales, no prevista en otro lugar; Nuevas razas de animales. › Nuevas razas de vertebrados.
- C12N15/86 C12N 15/00 […] › Vectores virales.
- C12N5/071 C12N 5/00 […] › Células o tejidos de vertebrados, p.ej. células o tejidos humanos.
- C12N5/077 C12N 5/00 […] › Células mesenquimales, p. ej. Células óseas, células cartilaginosas, Células del estroma de la médula ósea, células adiposas o células musculares.
- C12N5/10 C12N 5/00 […] › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
Fragmento de la descripción:
Modelo animal de angiogénesis humana y sus aplicaciones.
La presente invención se relaciona, en general, con un modelo animal de angiogénesis humana para la monitorización cuantitativa y no invasiva de dicho proceso de angiogénesis in vivo mediante imagen molecular.
Antecedentes de la invención
La angiogénesis es el proceso biológico que conduce a la formación de nuevos vasos sanguíneos a partir de los preexistentes en un órgano o tejido. La angiogénesis comienza con la descomposición de la membrana basal debido a la acción de las proteinasas secretadas por las células endoteliales, continúa con la migración y proliferación de dichas células endoteliales, para finalizar con la formación del lumen, el depósito de una nueva membrana basal y el reclutamiento de células de soporte.
En condiciones fisiológicas normales en un adulto sano no se produce angiogénesis con la excepción de los fenómenos asociados con el ciclo menstrual femenino y la cicatrización de heridas. Sin embargo, un desequilibrio en el proceso de la angiogénesis contribuye al desarrollo de desórdenes patológicos, tales como la artritis reumática, retinopatía diabética, psoriasis, y la proliferación y metástasis de los tumores, entre otros.
La angiogénesis juega, además, un papel importante en el crecimiento progresivo y dispersión metastásica de los tumores. Un tumor tiene que estimular continuamente el desarrollo de nuevos capilares para poder crecer. Los nuevos vasos generados en el tumor proporcionan a las células malignas una vía por donde pueden entrar en la circulación y establecer metástasis en lugares distantes. Actualmente, se acepta que los tumores no pueden crecer o metastatizar a otro órgano sin la generación de nuevos vasos sanguíneos, constituyendo el cambio ("switch") angiogénico un acontecimiento temprano en la progresión tumoral.
La angiogénesis es un proceso que comprende varias etapas y que conlleva interacciones moleculares y celulares complejas que no pueden recapitularse in vitro. Por ello, existe la necesidad de desarrollar un modelo animal que permita el estudio de dicho proceso de angiogénesis y para validar posibles dianas terapéuticas.
La imagen molecular ha emergido como una herramienta de gran utilidad para la evaluación longitudinal de eventos moleculares in vivo de forma no invasiva.
Aparte de sus aplicaciones básicas en diagnóstico, la imagen molecular juega un papel importante en la determinación de la eficacia terapéutica, en el descubrimiento de nuevos fármacos y en la comprensión de los mecanismos moleculares de los sistemas vivos. Tecnologías como microPET (micro positron emission tomography), imagen óptica por bioluminiscencia, imagen óptica por fluorescencia y la microCT (micro computerized axial tomography) han alcanzado un gran desarrollo en los últimos años. Así, la combinación de técnicas de imagen anatómica (microCT) y técnicas de imagen molecular (microPET), permite la obtención de información funcional y molecular relacionada con la formación y diseminación de tumores, y para monitorizar la eficacia de una terapia molecular específica.
Estas técnicas pueden reducir de manera significativa el número de animales requeridos en los ensayos in vivo y aumentar los datos experimentales obtenidos para cada animal en estudios longitudinales.
Sin embargo, ningún método de imagen puede considerarse como ideal para la monitorización del proceso de angiogénesis. Por lo tanto, existe aún una necesidad de desarrollar nuevos procedimientos para el estudio de este proceso, en particular de la angiogénesis humana, in vivo de manera no invasiva y a su vez que sea cuantificable.
La solicitud de patente US2003088885 describe un método para el seguimiento del crecimiento tumoral y la metástasis mediante el empleo de un animal que comprende una solapa en la piel que puede abrirse o cerrarse. Las patentes US6,232,523 y US6,235,967 describen técnicas para la detección de metástasis tumoral y angiogénesis usando marcadores fluorescentes como la GFP de forma que es posible detectar la angiogénesis mediante la extracción del tejido tumoral o en tiempo real mediante imagen del animal. Estas estrategias son invasivas y requieren mucho tiempo ya que comprenden técnicas de cirugía.
Koike, N. et al. (Nature, 2004, 428:138-139) han descrito la formación de vasos sanguíneos en un animal mediante la coimplantación de células endoteliales vasculares (HUVECs) y una línea celular de células mesenquimales precursoras de ratón (10T1/2). Dichas células endoteliales comprenden el gen que codifica para la EGFP lo que permite detectar la formación de vasos in vivo mediante microscopía.
Sanz, L. et al. (Microvasc. Res, 2008, 75:308-14) han descrito la generación de una vasculatura totalmente humana mediante la implantación de una combinación de células endoteliales humanas derivadas de cordón umbilical y de células mesenquimales primarias humanas (HMSC). Esta vasculatura es funcional, es decir, se conecta a la circulación sistémica del huésped como se demuestra mediante la detección en los vasos neo-formados de un fluorocromo inyectado por vía intravenosa.
A pesar de los esfuerzos realizados hasta la fecha, sigue existiendo la necesidad de generar nuevos modelos animales de angiogénesis que puedan desarrollar una red vascular humana estable y funcional de forma no invasiva y que permitan la detección y cuantificación de dicho proceso de angiogénesis in vivo.
Breve descripción de las figuras
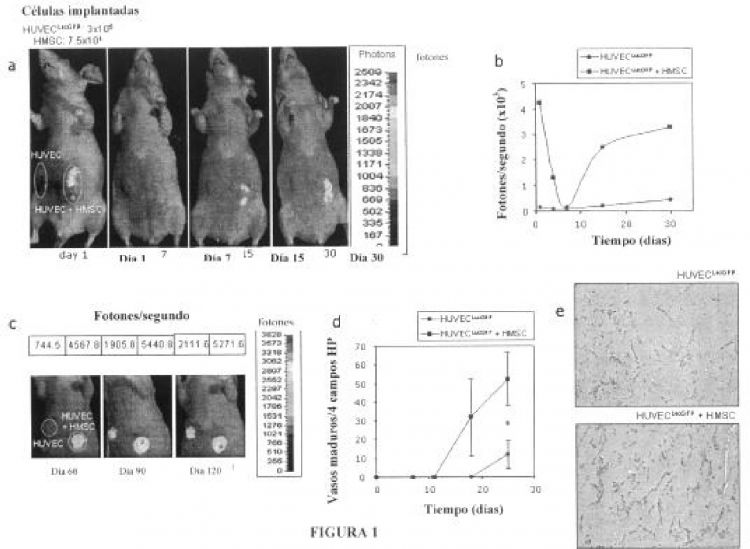
Figura 1. a) Imaging de la bioluminiscencia (BLI) in vivo de un animal representativo 1, 7, 15 y 30 días después de la colocación de implantes vasculares HMSC- (izquierda) y HMSC+ (derecha). b) Cuantificación de la emisión de fotones de ambos implantes durante este periodo. c) Los vasos neoformados son estables 120 días después de la implantación: BLI de implantes vasculares HMSC- y HMSC+ a días 60, 90 y 120. d) Cambios temporales en la densidad de vasos maduros (media+/- SD de vasos perfundidos en cuatro campos elegidos al azar); el asterisco indica diferencia significativa (p=0,029) entre los dos grupos (Mann-Whitney U-test). e) Imágenes (x100 aumentos) del estudio inmunohistoquímico de secciones de implantes HMSC- y HMSC+ con el anticuerpo anti-CD34 humano.
Figura 2. a) BLI de un ratón representativo 30 días tras la colocación de implantes vasculares HMSC- (izquierda) y HMSC+ (derecha), el día previo a la administración sistémica de la lectina UEA-1 conjugada a TRITC. b) Imágenes de los implantes vasculares tras la resección. c) Imaging ex vivo de la expresión de EGFP en los implantes vasculares. El bazo del mismo animal (línea punteada) se incluyó como un control negativo. d) Imaging ex vivo de la unión de la lectina TRITC-UEA-1 a los implantes vasculares y al bazo. e) Tinción inmunofluorescente del endotelio humano en implantes vasculares HMSC+ y HMSC- (verde, HUVEC que expresan EGFP; rojo, vasos funcionales teñidos con TRITC-UEA-1).
Figura 3. a) Representación esquemática del vector lentiviral bicistrónico (pRRL-Luc-IRES-EGFP) que contiene los genes reporteros luciferasa y proteína fluorescente verde (EGFP). LTR, long terminal repeat; ΔAGAG, ATG-deleted group-specific antigen; RRE, Rev-responsive element; EMCV IRES, encephalomyocarditis virus internal ribosomal entry site. b) Análisis mediante citometría de flujo de la expresión de EGFP en las células HUVECLucEGFP. c) Propiedades bioluminescentes de las HUVECLucEGFP. HUVEC transducidas con el lentivirus (HUVECLucEGFP) fueron diluidas seriadamente en una placa de 96 pocillos y se añadió el sustrato D-luciferina. La emisión de fotones media/segundo/pocillo +/- SD de triplicados se muestra en la gráfica de abajo.
Figura 4. El estudio fenotípico mediante citometría de flujo demostró que las células progenitoras mesenquimales de médula ósea humana (HMSC) expresaban homogéneamente los marcadores de superficie CD13, CD73 y CD90. No se detectó expresión de los antígenos CD34 y CD45.
Figura 5. Efecto del SU5416 sobre la actividad luciferasa de los implantes HMSC+. El tratamiento se inició dos días después de la implantación. Los animales recibieron por vía intraperitoneal diariamente 25 mg/kg de SU5416 (•; n=3) o solamente...
Reivindicaciones:
1. Una composición o kit que comprende, juntas o separadas, células endoteliales y células madre mesenquimales primarias.
2. Composición o kit según la reivindicación 1 donde dichas células endoteliales son células endoteliales primarias.
3. Composición o kit según la reivindicación 2 donde dichas células endoteliales primarias son células humanas.
4. Composición o kit según cualquiera de las reivindicaciones 1 a 3 en donde dichas células endoteliales primarias son de vena de cordón umbilical.
5. Composición según cualquiera de las reivindicaciones 1 a 4, donde dichas células madre mesenquimales primarias son humanas.
6. Composición según la reivindicación 5, donde dichas células madre mesenquimales primarias son de médula ósea.
7. Composición según la reivindicación 6, donde dichas células madre mesenquimales primarias son positivas para los marcadores de superficie celular CD13, CD73 y CD90 y negativas para los marcadores de superficie celular CD34, CD14 y CD45.
8. Composición según cualquiera de las reivindicaciones 1 a 7, donde dichas células endoteliales y células madre mesenquimales primarias están incluidas en una matriz.
9. Composición según la reivindicación 8, donde dicha matriz es una matriz extracelular de membrana basal de sarcoma de ratón.
10. Composición o kit según cualquiera de las reivindicación 1 a 9, donde dichas células endoteliales están genéticamente modificadas.
11. Composición o kit según la reivindicación 10, donde dichas modificación genética comprende la presencia de en dichas células de una secuencia de nucleótidos que codifica para un gen reportero.
12. Composición o kit según la reivindicación 11, donde dicho gen reportero se selecciona del grupo del gen de la luciferasa y el gen de una proteína fluorescente.
13. Composición o kit según la reivindicación 10, donde dichas modificación genética comprende la presencia en dichas células de una secuencia de nucleótidos que codifica para un gen terapéutico.
14. Composición o kit la reivindicación 13 en donde el gen terapéutico es un gen que codifica un anticuerpo.
15. Composición o kit según la reivindicación 14 en donde el anticuerpo es un anticuerpo biespecífico.
16. Composición o kit según la reivindicación 15 en donde el anticuerpo biespecífico contiene un dominio que se une específicamente a un ligando específico de tumores y un segundo dominio que se une a un antígeno de superficie de células T.
17. Composición o kit según la reivindicación 16 en donde el antígeno específico de células tumorales es CEA y/o el antígeno de superficie de células T es CD3.
18. Composición o kit según las reivindicaciones 16 ó 17 que comprende, adicionalmente, células mononucleares de sangre periférica activadas.
19. Uso de una composición o kit según cualquiera de las reivindicaciones 1 a 18, para promover la angiogénesis en un animal.
20. Un procedimiento para obtener un modelo animal de angiogénesis que comprende inocular subcutáneamente a un animal no humano una composición según cualquiera de las reivindicaciones 1 a 18.
21. Procedimiento según la reivindicación 20, que comprende, además, mantener dicho animal en las condiciones adecuadas de crecimiento para la formación de una red capilar a partir del inóculo subcutáneo.
22. Un animal no humano obtenido según el procedimiento de las reivindicaciones 20 ó 21.
23. Uso de un animal según la reivindicación 22 para el estudio de la angiogénesis.
24. Uso de la composición o kit según una cualquiera de las reivindicaciones 1 a 18 para promover la angiogénesis.
25. Uso de la composición según las reivindicaciones 11 ó 12 para la detección de la angiogénesis.
26. Método in vivo para la identificación de reguladores del proceso de angiogénesis que comprende:
en donde el compuesto ensayado es identificado como regulador de dicho proceso de angiogénesis si provoca una variación en la expresión del gen reportero con respecto a de los niveles de expresión de dicho gen reportero en ausencia de dicho compuesto.
27. Método según la reivindicación 26, donde dicho compuesto es identificado como activador del proceso de angiogénesis, si provoca un aumento en la expresión del gen reportero con respecto a los niveles de expresión de dicho gen reportero en ausencia de dicho compuesto.
28. Método según la reivindicación 26, donde dicho compuesto es identificado como inhibidor del proceso de angiogénesis, si provoca una disminución en la expresión del gen reportero con respecto a de los niveles de expresión de dicho gen reportero en ausencia de dicho compuesto.
29. Método según cualquiera de las reivindicación 25 a 28 en donde dicha detección se realiza in vitro por microscopía a partir de una preparación de tejido que expresa dicho gen reportero.
30. Método según la reivindicación 25 a 28 donde dicho gen reportero es el gen de la GFP.
31. Método según cualquiera de las reivindicaciones 25 a 30 donde dicha detección se realiza in vivo en un ratón provisto de ventanas transparentes.
32. Método según cualquiera de las reivindicaciones 25 a 28 en donde dicho gen reportero es el gen de la luciferasa.
33. Método según la reivindicación 32, donde dicha detección se realiza in vivo por detección de bioluminiscencia.
34. Método según la reivindicación 33, donde dicha detección se realiza mediante la medida del número de fotones emitidos.
35. Método según cualquiera de las reivindicaciones 25 a 34 en donde dicha detección se realiza mediante la visualización del tejido que expresa dicho gen reportero.
36. Uso de una composición o kit según cualquiera de las reivindicaciones 13 a 18 para la fabricación de un medicamento para el tratamiento de una enfermedad que requiera de la expresión de dicho gen terapéutico.
37. Uso de una composición o kit según cualquiera de las reivindicaciones 16 a 18 para la fabricación de un medicamento para el tratamiento del cáncer.
Patentes similares o relacionadas:
Método y medios para purificar vectores retrovíricos, del 29 de Julio de 2020, de Autolus Limited: Una célula productora de retrovirus que expresa una proteína de marcaje en la superficie celular, de tal manera que los vectores retrovíricos producidos por la célula se […]
Biblioteca de péptidos y su uso, del 8 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Una biblioteca de péptidos que comprende una pluralidad de péptidos diferentes en la que los péptidos comprenden cada uno una secuencia de aminoácidos […]
Marcador de células endoteliales corneales, del 17 de Junio de 2020, de OSAKA UNIVERSITY: Método para producir una célula endotelial corneal, comprendiendo el método la etapa de clasificar, a partir de una población celular que comprende una célula […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]
Reconocimiento de unión a diana celular mediante un agente bioactivo usando transferencia de energía de resonancia de bioluminiscencia intracelular, del 6 de Mayo de 2020, de PROMEGA CORPORATION: Un sistema de ensayo que comprende: (a) una biblioteca de agentes bioactivos, cada uno de los cuales está fijado a un fluoróforo; (b) una diana celular fusionada a […]
Anticuerpo contra péptido codificado por exón-21 de periostina y composición farmacéutica para prevenir o tratar enfermedades asociadas a inflamación que contienen el mismo, del 6 de Mayo de 2020, de OSAKA UNIVERSITY: Anticuerpo que se une a uno o más péptidos seleccionados del grupo que consiste en un péptido codificado por el exón-21 de periostina que […]
Combinación de dos elementos genéticos para el control del desarrollo del tipo floral de una planta dicotiledónea, y utilización en procedimientos de detección y selección, del 1 de Abril de 2020, de Institut national de recherche pour l'agriculture, l'alimentation et l'environnement: Utilización de una combinación de dos elementos genéticos para el control del desarrollo del tipo floral de una planta dicotiledónea, comprendiendo dicha combinación, respectivamente: […]
Producción de proteínas en medios de cultivo celular libres de glutamina, del 25 de Marzo de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para producir un polipéptido en una célula huésped de mamífero que expresa dicho polipéptido, que comprende cultivar la célula […]