Procedimiento para purificar colistina y componentes de colistina purificados.
Procedimiento para la purificación de colistina por cromatografía de fase inversa,
caracterizado porque presenta las etapas de
cargar una columna con base de colistina en ácido acético y etanol al 20-30% y eluir con etanol al 10-15%.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2010/064472.
Solicitante: Xellia Pharmaceuticals ApS.
Nacionalidad solicitante: Dinamarca.
Dirección: P.O. Box 1736 2300 Kobenhaven DINAMARCA.
Inventor/es: KOCH, TORBEN, OVERBALLE-PEDERSEN,CARSTEN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K7/62 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 7/00 Péptidos con 5 a 20 aminoácidos en una secuencia totalmente determinada; Sus derivados. › Polimixinas; Péptidos semejantes.
PDF original: ES-2532408_T3.pdf
Fragmento de la descripción:
Procedimiento para purificar colistina y componentes de colistina purificados.
Campo de la invención
La presente invención se refiere a un procedimiento para la purificación de antibióticos.
Antecedentes
El aumento de la multirresistencia en las bacterias gramnegativas, en particular, en Pseudomonas aeruginosa, Acinetobacter baumannii y Klebsiella pneumoniae, constituye un problema crítico. La limitación de las opciones terapéuticas ha obligado a los médicos y microbiólogos que se dedican a las enfermedades infecciosas a reevaluar la aplicación clínica de la colistina (también llamada polimixina E), un antibiótico polimixina similar, pero no idéntico, a la polimixina B. La colistina puede presentar ventajas sobre la polimixina B debido a su índice terapéutico más amplio.
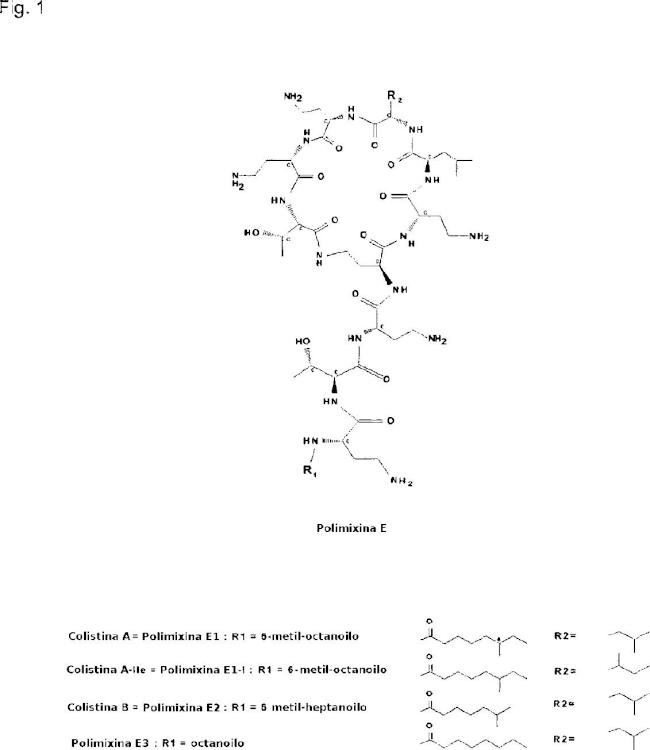
La colistina se aisló por primera vez en 1947 a partir de Bacillus polymyxa var. colistinus y se compone de una mezcla de polipéptidos producidos por fermentación. Los componentes principales son la polimixina Ei, E2, E3 y E1- lle (figura 1).
Comercialmente, la colistina se encuentra como sulfato de colistina, que se utiliza por vía oral para la descontaminación intestinal y por vía tópica como polvo para infecciones de la piel, y como colistimetato de sodio, que se utiliza por vía parenteral y por inhalación. Se ha determinado que el colistimetato de sodio es menos tóxico y tiene menos efectos secundarios indeseables que la colistina, pero también es menos potente. (Véase Critical Care 26, 1:R27 (doi: 1.1186/cc3995), de Falagasy Kasiokou).
El sulfato de colistina se formula a menudo en pomadas, suspensiones óticas y soluciones óticas y oftalmológicas. El sulfato de colistina también se administra por vía oral en forma de suspensiones o comprimidos para tratar infecciones intestinales o para eliminar la flora del colon.
El colistimetato de sodio es un profármaco semisintético de colistina que puede utilizarse para tratar infecciones por Pseudomonas aeruginosa en pacientes con fibrosis quística, y recientemente se ha utilizado para tratar infecciones por Acinetobacter multirresistente. El colistimetato de sodio también se ha administrado por vía ¡ntratecal e intraventricular en meningitis/ventriculitis por Acinetobacter baumannii y Pseudomonas aeruginosa. El colistimetato de sodio se hidroliza fácilmente, dando lugar a una variedad de derivados metanosulfonados en solución acuosa, y es muy difícil de analizar.
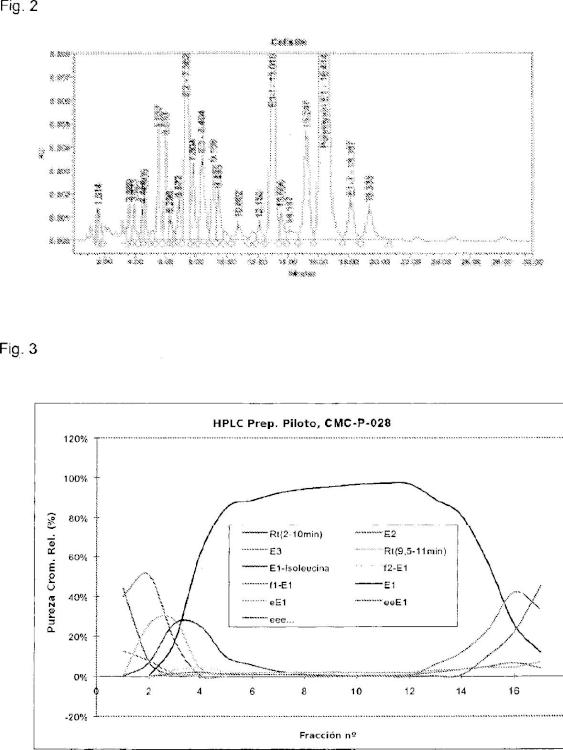
Dado que la colistina se introdujo en la práctica clínica hace más de 5 años, sus propiedades nunca se documentaron tan exhaustivamente como se hace con los fármacos modernos, por ejemplo con requisitos específicos en cuanto a su farmacología, toxlcología, contenido de impurezas, etc. Por esta razón, los productos de colistina disponibles en el mercado contienen, además de su componente principal, la polimixina E1, muchas sustanclas/lmpurezas activas e inactivas relacionadas, principalmente derivadas del proceso de fermentación. En la figura 2 se muestra un cromatograma de HPLC típico de la colistina.
Habitualmente, el componente principal de la colistina comercial, la polimixina E1, constituye aproximadamente el 6% del producto seco. Se han caracterizado algunas de las sustancias relacionadas en los productos de colistina (figura 1), pero la mayoría de las impurezas siguen sin conocerse. La potencia mínima del sulfato de colistina, tal como especifica la USP (United States Pharmacopeia) es "no menor de 5 pg/mg", pero la actividad antlmlcroblana específica de cada componente es, en gran medida, desconocida.
A pesar de que el producto se ha utilizado durante más de 5 años, no existe ninguna dosificación normalizada de la colistina y no se han publicado ensayos detallados sobre su farmacología o su farmacoclnétlca. Por lo tanto, se desconoce la dosificación óptima de colistina para la mayoría de las infecciones. Del mismo modo, la dosis "máxima" recomendada para cada preparación es diferente. Cada país tiene diferentes preparaciones genéricas de colistina y la dosis recomendada depende del fabricante.
El sulfato de colistina y el colistimetato de sodio se pueden administrar por vía intravenosa y como aerosoles, pero la dosificación es compleja. El colistimetato de sodio de algunos fabricantes se prescribe en unidades Internacionales, mientras que el mismo producto de otros fabricantes se prescribe en miligramos de base de colistina. Esta ausencia total de regulación o normalización de las dosis hace que la dosificación intravenosa de la colistina constituya una pesadilla para cualquier médico.
Las principales toxicidades descritas en el tratamiento intravenoso son la nefrotoxlcldad (afectación de los riñones) y la neurotoxlcldad (afectación del sistema nervioso), pero esto puede reflejar las dosis muy altas que se administraban al principio, mucho más elevadas que las recomendadas actualmente por cualquier fabricante, y para
las que no se realizaba ningún ajuste en caso de enfermedad renal. La toxicidad principal descrita en el tratamiento con aerosoles es el broncoespasmo.
En ausencia de datos de apoyo, se puede especular que parte de la toxicidad de la colistina se puede atribuir a las sustancias relacionadas e impurezas presentes en los productos comerciales actuales. Además, cuando se sintetiza el profármaco colistimetato utilizando colistina "Impura" como material de partida, cada sustancia relacionada y cada impureza formarán una base para diversos derivados metanosulfonados, creándose un producto final muy complejo, en el que se desconocen las propiedades toxicológlcas de cada sustancia Individual.
A partir de las consideraciones toxlcológicas y farmacológicas anteriores, pueden apreciarse grandes ventajas en la utilización de una variedad "monocomponente" de la colistina con fines médicos. Dicha colistina monocomponente contendrá una proporción muy elevada del componente principal pollmlxlna Ei (> 9%, en comparación con el actual 6%), y todas las impurezas principales estarán Identificadas y caracterizadas.
Una colistina monocomponente ofrece diversas ventajas:
1) Posibilidad de discernir las contribuciones toxicológlcas del componente principal (PEi), las sustancias relacionadas y las impurezas,
2) Producto susceptible de nuevas y más precisas Investigaciones farmacológicas y farmacoclnétlcas,
3) Posibilidad de sintetizar derivados bien definidos, por ejemplo el colistimetato, sin dar lugar a una multitud de sustancias mal definidas,
4) Posibilidad de desarrollar métodos analíticos mejores y más precisos para la colistina y el colistimetato, simplificándose los procedimientos reguladores,
5) Recomendaciones Inequívocas de dosis basadas en datos farmacológicos y toxlcológlcos claros,
6) Actualización de la colistina para convertirla en un antibiótico "moderno", lo que constituye una gran
necesidad.
En De Crescenzo Henriksen et al (Lett Appl Microbiol 45, 491-496 (27) se describe la purificación de la polimixina E a partir de cepas de P. amylolyticus en grado analítico mediante etapas de purificación por HPLC de fase inversa, utilizando gradientes de fase móvil de isopropanol y metanol. El documento WO98/2836 da a conocer protocolos de purificación de diversos componentes de la colistina, entre ellos la polimixina E, utilizando gradientes de acetonitrilo en HPLC de fase inversa.
Un segundo objetivo, a más largo plazo, sería someter la PEi purificada a nuevos estudios de eficacia in vitro e in vivo, así como a estudios toxicológicos, a fin de compararlos con los estudios anteriores del grupo de las polimixinas. Dichos ensayos aleatorizados y controlados se necesitan con urgencia para esclarecer diversas cuestiones relativas a la eficacia y la seguridad de las polimixinas (Crit Care Clin, abril de 28; 24(2):377-91, por Micholopoulos y Falagas).
Características de la invención
La presente invención se refiere a un procedimiento para purificar componentes de la colistina, y particularmente el componente principal, la polimixina Ei.
La presente invención se refiere a un procedimiento para producir una preparación prácticamente pura del componente principal de colistina, la polimixina Ei (9-98% de pureza), denominada colistina monocomponente.
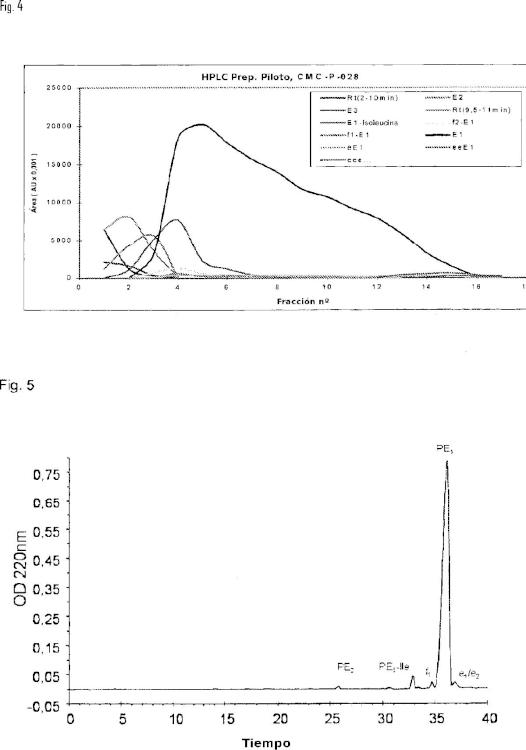
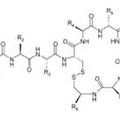
Dicho procedimiento es un método cromatográfico simple que utiliza disolventes de baja toxicidad. El procedimiento comprende una cromatografía de fase inversa (RP), que permite la purificación de la polimixina Ei hasta una pureza mayor del 9%, seguida por una cromatografía de interacción hidrófoba (HIC).
El procedimiento está caracterizado por
- la carga de una columna de fase inversa con base de colistina en ácido acético y etanol... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para la purificación de colistina por cromatografía de fase inversa, caracterizado porque presenta las etapas de
cargar una columna con base de colistina en ácido acético y etanol al 2-3% y eluir con etanol al 1-15%.
2. Procedimiento según la reivindicación 1, en el que la concentración de etanol es de 2% a 24%.
3. Procedimiento según la reivindicación 1, en el que la concentración de etanol es de 24%.
4. Procedimiento según la reivindicación 1, en el que la concentración de etanol es de 12%.
5. Procedimiento según la reivindicación 1, en el que la concentración de ácido acético es de ,1 M.
6. Procedimiento según la reivindicación 1, seguido por una etapa adicional de cromatografía de interacción hidrófoba.
7. Procedimiento según la reivindicación 1, en el que el pH de la fase móvil es de 7 a 8.
8. Procedimiento según la reivindicación 1, en el que el pH de la fase móvil es de 7,5.
9. Procedimiento según la reivindicación 1, en el que
la concentración alta de etanol es de 24%,
la concentración baja de etanol es de 12%, la concentración de ácido acético es de ,1 M, el pH de la fase móvil es de 7,5, y la fase estacionaria es una resina C8.
Patentes similares o relacionadas:
Polimixinas de baja sustitución y sus composiciones, del 7 de Agosto de 2019, de Xellia Pharmaceuticals ApS: Una polimixina representada por la Fórmula (I):**Fórmula** en donde R1 es un grupo acilo alifático lineal o ramificado C6-C10 , o**Fórmula** […]
Polimixinas, composiciones, métodos de fabricación y métodos de uso, del 23 de Agosto de 2017, de Xellia Pharmaceuticals ApS: Una composición que comprende una polimixina o una sal de la misma representada por la fórmula (I) **(Ver fórmula)** en la que R1 es un grupo […]
Derivados de Polimixina de ácido graso de cola corta y usos de los mismos, del 11 de Enero de 2017, de Northern Antibiotics Oy: Un derivado de polimixina de fórmula (I):**Fórmula** en donde: A es un resto de anillo de polimixina seleccionado de las de polimixina A, polimixina […]
Derivado de polimixina y usos del mismo, del 20 de Julio de 2016, de Northern Antibiotics Oy: Un compuesto de fórmula general (I), **(Ver fórmula)** en donde R1 es Dab R2 es Thr R3 es DThr R4 es Dab R5 es Dab R6 es […]
Derivados de polimixina y sus usos, del 11 de Mayo de 2016, de Northern Antibiotics Oy: Un derivado de polimixina de la fórmula general (I),**Fórmula** en donde R1 está ausente o es Abu; R2 se selecciona del grupo que […]
 COMPUESTOS PEPTÍDICOS ÚTILES COMO AGENTES ANTIBIÓTICOS, del 16 de Octubre de 2014, de UNIVERSITAT DE BARCELONA: Los compuestos de fórmula (I), donde R0 es un radical CH
COMPUESTOS PEPTÍDICOS ÚTILES COMO AGENTES ANTIBIÓTICOS, del 16 de Octubre de 2014, de UNIVERSITAT DE BARCELONA: Los compuestos de fórmula (I), donde R0 es un radical CH
 Compuestos peptídicos útiles como agentes antibióticos, del 13 de Octubre de 2014, de UNIVERSITAT DE BARCELONA: Compuestos peptídicos útiles como agentes antibióticos.
Los compuestos de fórmula (I), donde R0 es un radical CH3-(CH2)m-, donde m es un número entero entre 4 y 10; R1, […]
Compuestos peptídicos útiles como agentes antibióticos, del 13 de Octubre de 2014, de UNIVERSITAT DE BARCELONA: Compuestos peptídicos útiles como agentes antibióticos.
Los compuestos de fórmula (I), donde R0 es un radical CH3-(CH2)m-, donde m es un número entero entre 4 y 10; R1, […]
MÉTODO DE RECUPERACIÓN DE LA POLIMIXINA B A PARTIR DE UN CALDO DE FERMENTACIÓN, del 27 de Enero de 2011, de BIOTIKA A.S: Método para la recuperación de polimixina B a partir de un caldo de fermentación caracterizado porque el filtrado, que se obtiene del caldo de fermentación, es […]