Kits y productos para detección de ácidos nucleicos en células individuales y para identificación de células raras en grandes poblaciones de células heterogéneas.
Un kit que comprende:
al menos un reactivo para permeabilizar las células;
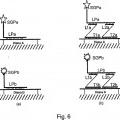
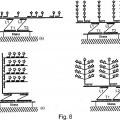
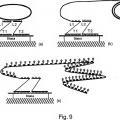
al menos un conjunto de sondas de captura que comprende dos o más sondas de captura susceptibles de hibridar con una secuencia de ácido nucleico diana;
una sonda marcadora que comprende una marca, en donde la sonda marcadora es susceptible de hibridar con dicho conjunto de dos o más sondas de captura; y
en donde cada una de dichas sondas de captura comprende una sección T que es complementaria a una región de dicha secuencia de ácido nucleico diana y una sección L que es complementaria a una región de dicha sonda marcadora; en donde las secciones de T de las dos o más sondas de captura en el conjunto de sondas de captura son complementarias a las regiones no solapantes de la secuencia de ácido nucleico diana, y las secciones L de dos o más sondas de captura en el conjunto de sondas de captura son complementarias a las regiones no solapantes de dicha sonda marcadora.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E12161252.
Solicitante: Advanced Cell Diagnostics, Inc.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 3960 Point Eden Way Hayward CA 94545 ESTADOS UNIDOS DE AMERICA.
Inventor/es: LUO,YULING, CHEN,SHIPING.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- B01L3/00 TECNICAS INDUSTRIALES DIVERSAS; TRANSPORTES. › B01 PROCEDIMIENTOS O APARATOS FISICOS O QUIMICOS EN GENERAL. › B01L APARATOS DE LABORATORIO PARA LA QUIMICA O LA FISICA, DE USO GENERAL (aparatos de uso médico o farmacéutico A61; aparatos para aplicaciones industriales o aparatos de laboratorio cuya estructura y funciones son comparables a las de aparatos industriales similares, ver las clases relativas a los aparatos industriales, en particular las subclases B01 y C12; aparatos de separación o de destilación B01D; dispositivos de mezcla o de agitación B01F; atomizadores B05B; tamices, cribas B07B; tapones, capuchones B65D; manipulación de líquidos en general B67; bombas de vacío F04; sifones F04F 10/00; grifos, válvulas F16K; tubos, empalmes para tubos F16L; aparatos especialmente adaptados al estudio y análisis de materiales G01, particularmente G01N; aparatos eléctricos u ópticos, ver las subclases apropiadas en las secciones G y H). › Recipientes o utensilios para laboratorios, p. ej. cristalería de laboratorio (botellas B65D; equipos para enzimología o microbiología C12M 1/00 ); Cuentagotas (recipientes para volumetría G01F).
- C07H21/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 21/00 Compuestos que contienen al menos dos unidades mononucleótido que tienen cada una grupos fosfato o polifosfato distintos unidos a los radicales sacárido de los grupos nucleósido, p. ej. ácidos nucleicos. › con desoxirribosilo como radical sacárido.
- C12Q1/68 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
PDF original: ES-2511218_T3.pdf
Fragmento de la descripción:
Kits y productos para detección de ácidos nucleicos en células individuales y para identificación de células raras en grandes poblaciones de células heterogéneas Campo de la invención La invención se refiere generalmente a la química de ácidos nucleicos y a análisis bioquímicos. Más concretamente, la invención se refiere a kits para la detección in situ de analitos de ácido nucleico en células individuales. La invención también se refiere a la detección y la identificación de células individuales, particularmente células raras.
Antecedentes de la invención Numerosas pruebas han demostrado que las células cancerosas pueden disociarse del tumor primario y circular en los ganglios linfáticos, la médula ósea, la sangre periférica u otros fluidos corporales. Se ha demostrado que estas células tumorales circulantes (CTC) reflejan las características biológicas de los tumores primarios, incluyendo el potencial para el desarrollo de metástasis y recurrencia del tumor. Por lo tanto, la detección de CTC puede indicar recurrencia de la enfermedad, propagación de células tumorales, y un alto potencial de metástasis a distancia. Todos estos son factores clínicos informativos importantes en la identificación del estado de la enfermedad de los pacientes de cáncer de alto riesgo (p. ej., Vogel et al., 2002; Gilbey et al., 2004; Molnar et al., 2003; Vlems et al, 2003; Ma et al., 2003) .
La validación de la utilidad clínica de la detección de CTC como indicador pronóstico no ha progresado tan rápidamente como se esperaba, en gran parte debido a la falta de tecnologías de detección adecuadas. Una dificultad clave en la detección de CTC en sangre periférica u otros fluidos corporales es que las CTC están presentes en la circulación a concentraciones extremadamente bajas, que se estima que se encuentran en el intervalo de una célula tumoral entre 106-107 glóbulos blancos normales. Como resultado, cualquier tecnología de detección para esta aplicación tiene que exhibir excepcional sensibilidad y especificidad con el fin de limitar la tasa tanto de falsos negativos como de falsos positivos a un nivel aceptable.
Uno de los enfoques existentes incorpora la tecnología de separación inmunomagnética en la detección de CTC intactas (documentos US 6.365.362; US 6.645.731) . Utilizando esta tecnología, una muestra de sangre de un paciente de cáncer se incuba con cuentas magnéticas recubiertas con anticuerpos dirigidos contra un antígeno epitelial de superficie como por ejemplo EpCAM (Cristofanilli et al., 2004) . Las células marcadas magnéticamente se aíslan a continuación, utilizando un separador magnético. La fracción enriquecida inmunomagnéticamente se procesa adicionalmente para el análisis aguas abajo para la identificación de CTC. Utilizando esta tecnología, se demostró en un estudio prospectivo que el número de CTC después del tratamiento es un indicador independiente de la supervivencia sin progresión y la supervivencia global en pacientes con cáncer de mama metastásico (Cristofanilli et al., 2004) . Aunque esta tecnología ha manifestado alta sensibilidad, su aplicabilidad está limitada por la disponibilidad de anticuerpos de detección que son altamente sensibles y específicos para tipos concretos de CTC. Los anticuerpos pueden presentar unión no específica a otros componentes celulares que puede conducir a baja proporción de señal a ruido y perjudicar la detección posterior. Los anticuerpos que se unen a CTC también se pueden unir a antígenos presentes en otros tipos de células a bajo nivel, dando como resultado un alto nivel de falsos positivos.
Otro enfoque para determinar la presencia de CTC ha sido someter a ensayo la expresión específica en células tumorales del ARN mensajero en la sangre. La reacción en cadena de la polimerasa con transcripción inversa en tiempo real de (QPCR) se ha utilizado para correlacionar la detección de CTC con el pronóstico del paciente. La RT-PCR en tiempo real se ha utilizado para la detección de ARNm de CEA en la sangre periférica de pacientes con cáncer colorrectal (Ito et al., 2002) . La supervivencia sin enfermedad de los pacientes con ARNm positivo para CEA en sangre en el postoperatorio fue significativamente menor que en los casos que fueron negativos para ARNm de CEA. Estos resultados sugieren que las células tumorales se vertieron al torrente sanguíneo y dieron lugar a pobres resultados en paciente para pacientes con cáncer colorrectal. Otro informe demostró la utilidad clínica de la detección molecular de CTC en pacientes de melanoma en fase IIBC y IIIAB de AJCC de alto riesgo utilizando marcadores de ARNm múltiples mediante QPCR (Mocellin et al., 2004) . La ventaja de la detección de ARNm específico de tumor es que la expresión de cualquier gen específico de tumor se puede utilizar para que sirva como marcador de diagnóstico/pronóstico. Sin embargo, el enfoque QPCR requiere el procedimiento laborioso de aislamiento del ARNm de la muestra de sangre y la transcripción inversa antes de la reacción de PCR. Con frecuencia se observan falsos positivos utilizando esta técnica debido a la contaminación de la muestra por el ADN cromosómico o la expresión de bajo nivel del gen marcador elegido en las células de la sangre normales (Fava et al. 2001) . Además, el límite de la sensibilidad de detección de esta técnica es como máximo alrededor de una célula tumoral por 1 ml de sangre, y la tecnología no puede proporcionar un recuento preciso del número de CTC.
Es muy deseable detectar y cuantificar la expresión del ARNm específico de células tumorales a nivel de una sola células en la sangre u otros fluidos corporales. Una tecnología que puede detectar la expresión de múltiples ARNm específicos en las células individuales en suspensión permitiría tanto la detección sensible y específica como la enumeración de las CTC en la sangre u otros fluidos corporales. Además, esta tecnología podría permitir la recogida
de las células CTC para análisis citológico y molecular aguas abajo. Las técnicas disponibles actualmente no satisfacen estas necesidades.
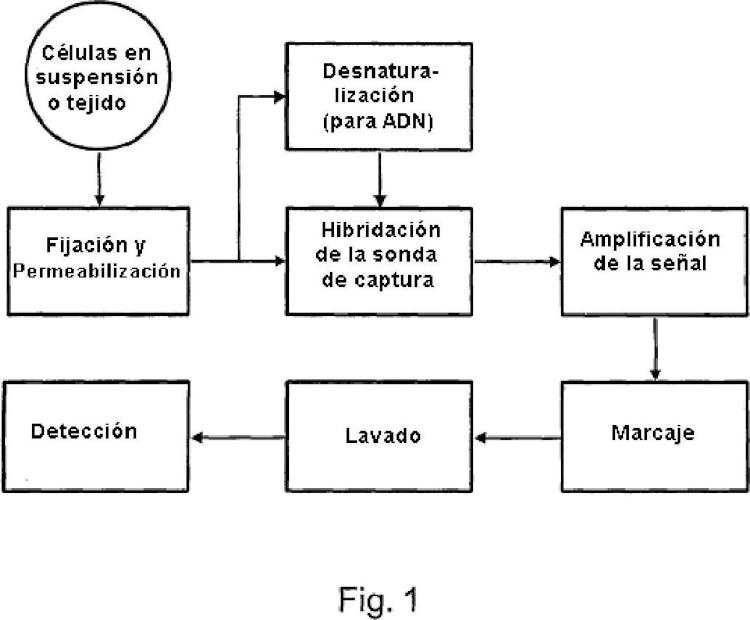
La tecnología de hibridación in situ (HIS) es un método establecido para localizar y detectar secuencias de ARNm específicas en secciones de tejido o preparaciones celulares morfológicamente conservadas (Hicks et al., 2004) . Los especímenes más comunes que se utilizan son las secciones congeladas, las secciones embebidas en parafina o las células en suspensión que fueron sometidas a citocentrifugación en portaobjetos de vidrio y fijadas con metanol. La detección se llevó a cabo utilizando sondas de ácido nucleico que son complementarias a e hibridan con secuencias de nucleótidos específicas dentro de las células y tejidos. La sensibilidad de la técnica es tal que los niveles umbral de detección están en el intervalo de 10-20 copias de ARNm por célula.
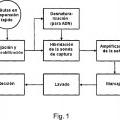
Sin embargo, la tecnología HIS se enfrenta a una serie de desafíos técnicos que limitan su uso generalizado. En primer lugar, las células inmovilizadas sobre una superficie sólida exhiben pobres cinéticas de hibridación. En segundo lugar, generalmente se requiere la optimización del análisis para un ARNm diana en la selección de la sonda, el marcaje y la detección, para cada sección de tejido en la fijación y permeabilización, y en la hibridación y el lavado. Además, se necesita realizar diversos experimentos para controlar la especificidad de la sonda, para determinar la calidad del ARNm del tejido, y para determinar la eficacia de hibridación del procedimiento experimental. Además de los problemas técnicos, la tecnología HIS actual tiene criterios de funcionamiento relativamente bajos en lo que respecta a su sensibilidad de detección y reproducibilidad. La tasa de falsos positivos es todavía alta a menos que las células de interés se vuelvan a examinar manualmente utilizando su morfología, que consume tiempo y mano de obra intensiva. La tecnología HIS actual tampoco tiene la capacidad de determinar cuantitativamente el nivel de expresión del ARNm o medir simultáneamente la expresión de múltiples ARNm diana dentro de las células, lo que puede proporcionar valiosa información clínica como el aumento de la sensibilidad y especificidad de detección, y la identificación del tipo, fuente y escenario de tumor primario.
Existen cuatro tipos principales de sondas que se utilizan normalmente para realizar la hibridación in situ dentro de las células: sondas de oligonucleótidos (normalmente 20-40 bases de longitud) , sondas de ADN de hebra sencilla (200-500 bases de longitud) , sondas de ADN de cadena doble, o sondas de ARN (200-5000 bases de longitud) . Las sondas de ARN son actualmente las sondas más ampliamente utilizadas para la hibridación in... [Seguir leyendo]
Reivindicaciones:
1. Un kit que comprende:
al menos un reactivo para permeabilizar las células;
al menos un conjunto de sondas de captura que comprende dos o más sondas de captura susceptibles de hibridar con una secuencia de ácido nucleico diana;
una sonda marcadora que comprende una marca, en donde la sonda marcadora es susceptible de hibridar con dicho conjunto de dos o más sondas de captura; y en donde cada una de dichas sondas de captura comprende una sección T que es complementaria a una región de dicha secuencia de ácido nucleico diana y una sección L que es complementaria a una región de dicha sonda marcadora; en donde las secciones de T de las dos o más sondas de captura en el conjunto de sondas de captura son complementarias a las regiones no solapantes de la secuencia de ácido nucleico diana, y las secciones L de dos o más sondas de captura en el conjunto de sondas de captura son complementarias a las regiones no solapantes de dicha sonda marcadora.
2. El kit de la reivindicación 1, en donde dicha sonda marcadora comprende: (i) una sonda marcadora susceptible de hibridar con dicho conjunto de dos o más sondas de captura, o (ii) una sonda marcadora, y un amplificador hibridado con la sonda marcadora y susceptible de hibridar con dicho conjunto de dos o más sondas de captura, o (iii) una sonda marcadora, un amplificador hibridado con la sonda marcadora, y un preamplificador hibridado con el amplificador y susceptible de hibridar con dicho conjunto de dos o más sondas de captura.
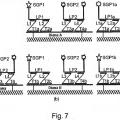
3. El kit de las reivindicaciones 1 o 2, en donde la diana de ácido nucleico comprende una pluralidad de diferentes secuencias diana de ácidos nucleicos, y cada diana de ácido nucleico tiene su sonda marcadora, sondas de captura, preamplificador y/o amplificador asociados; y cada sonda marcadora comprende una marca, en donde la señal de cada una de dichas marcas es indistinguible o es distinguible de las demás.
4. Una muestra de células fijadas y permeabilizadas, que comprende:
a. al menos una célula fijada y permeabilizada que contiene un ácido nucleico diana,
b. al menos un conjunto de sondas de captura que comprende dos o más sondas de captura hibridadas con dicho ácido nucleico diana, y
c. una sonda marcadora hibridada con dicho conjunto de dos o más sondas de captura,
en donde cada una de dichas sonda de captura comprende una sección T que es complementaria a una región de dicho ácido nucleico diana y una sección L que es complementaria a una región de dicha sonda marcadora; en donde las secciones T de dos o más sondas de captura en el conjunto de sondas de captura son complementarias a las regiones no solapantes del ácido nucleico diana y las secciones L de dos o más sondas de captura en el conjunto son complementarias a las regiones no solapantes de dicha sonda marcadora.
5. La muestra de la reivindicación 4, en donde dicha sonda marcadora comprende: (i) una sonda marcadora susceptible de hibridar con dicho conjunto de dos o más sondas de captura, o (ii) una sonda marcadora, y un amplificador hibridado con la sonda marcadora y susceptible de hibridar con dicho conjunto de dos o más sondas de captura, o (iii) una sonda marcadora, un amplificador hibridado a la marca, y un preamplificador hibridado con el amplificador y susceptible de hibridar con dicho conjunto de dos o más sondas de captura.
6. La muestra de las reivindicaciones 4 o 5, en donde dichas células se suspenden en solución o se inmovilizan en un portaobjetos.
7. La muestra de las reivindicaciones 4-6, en donde dichas células derivan de un fluido corporal o de sangre.
8. La muestra de cualquiera de las reivindicaciones 4-7, en donde dichas células comprenden una mezcla de tipos celulares, en donde dicha mezcla comprende al menos una célula de un tipo especificado.
9. La muestra de la reivindicación 8, en donde la razón de las células de un tipo especificado con respecto a las células de todos los otros tipos en la mezcla es inferior a 1:1x104 o menor de 1:1x105.
10. La muestra de cualquiera de las reivindicaciones 4-9, en donde dichas células de un tipo especificado son células tumorales, o específicamente, células tumorales circulantes o células tumorales diseminadas.
11. Un portaobjetos de tejido, que comprende:
a. un portaobjetos con una pluralidad de células fijadas y permeabilizadas inmovilizadas sobre el mismo que comprende al menos una célula fijada e inmovilizada que contiene un ácido nucleico diana, 43
b. al menos un conjunto de sondas de captura que comprende dos o más sondas de captura hibridadas con dicho ácido nucleico diana, y
c. una sonda marcadora hibridada con dicho conjunto de dos o más sondas de captura,
en donde cada una de dichas sonda de captura comprende una sección T que es complementaria a una región de dicho ácido nucleico diana y una sección L que es complementaria a una región de dicha sonda marcadora; en donde las secciones T de dos o más sondas de captura en el conjunto de sondas de captura son complementarias a las regiones no solapantes del ácido nucleico diana y las secciones L de dos o más sondas de captura en el conjunto son complementarias a las regiones no solapantes de dicha sonda marcadora.
12. El portaobjetos de tejido de la reivindicación 11, en donde dichas células se encuentran en una sección de tejido 10 de un bloque de tejido fijado con formalina e incluido en parafina.
13. El portaobjetos de tejido de las reivindicaciones 11 o 12, en donde dicha sonda marcadora comprende: (i) una sonda marcadora susceptible de hibridar con dicho conjunto de dos o más sondas de captura, o (ii) una sonda marcadora, y un amplificador hibridado con la sonda marcadora y susceptible de hibridar con dicho conjunto de dos o más sondas de captura, o (iii) una sonda marcadora, un amplificador hibridado con la marca, y un preamplificador 15 hibridado con el amplificador y susceptible de hibridar con dicho conjunto de dos o más sondas de captura.
14. El portaobjetos de tejido de cualquiera de las reivindicaciones 11-13, en donde el complejo formado entre dos o más sondas de captura diferentes con la sonda marcadora, el amplificador, o el preamplificador tiene una temperatura de hibridación que es superior a la temperatura de fusión del complejo entre cada sonda de captura individual y la sonda marcadora, el amplificador o el preamplificador.
15. El portaobjetos de tejido de una cualquiera de las reivindicaciones 11-14, en donde la diana de ácido nucleico comprende una pluralidad de dianas de ácido nucleico diferentes; y cada diana de ácido nucleico tiene su sonda marcadora, sonda de captura, preamplificador y/o amplificador asociados; y cada sonda marcadora comprende una marca, en donde la señal de cada una de dichas marcas es indistinguible o distinguible de las demás.
Patentes similares o relacionadas:
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]
MÉTODOS PARA EL DIAGNÓSTICO DE ENFERMOS ATÓPICOS SENSIBLES A COMPONENTES ALERGÉNICOS DEL POLEN DE OLEA EUROPAEA (OLIVO), del 23 de Julio de 2020, de SERVICIO ANDALUZ DE SALUD: Biomarcadores y método para el diagnostico, estratificación, seguimiento y pronostico de la evolución de la enfermedad alérgica a polen del olivo, kit […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Secuenciación dirigida y filtrado de UID, del 15 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para generar una biblioteca de polinucleótidos que comprende: (a) generar una primera secuencia del complemento (CS) de un polinucleótido diana a partir […]
Métodos para la recopilación, estabilización y conservación de muestras, del 8 de Julio de 2020, de Drawbridge Health, Inc: Un método para estabilizar uno o más componentes biológicos de una muestra biológica de un sujeto, comprendiendo el método obtener un […]
Evento de maíz DP-004114-3 y métodos para la detección del mismo, del 1 de Julio de 2020, de PIONEER HI-BRED INTERNATIONAL, INC.: Un amplicón que consiste en la secuencia de ácido nucleico de la SEQ ID NO: 32 o el complemento de longitud completa del mismo.
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Aislamiento de ácidos nucleicos, del 24 de Junio de 2020, de REVOLUGEN LIMITED: Un método de aislamiento de ácidos nucleicos que comprenden ADN de material biológico, comprendiendo el método las etapas que consisten en: (i) efectuar un lisado […]