Fitasas, ácidos nucleicos que las codifican y métodos para su producción y uso.
Un ácido nucleico aislado, sintético o recombinante que comprende
(a) una secuencia de ácido nucleico que codifica un polipéptido que tiene una actividad fitasa y que tiene almenos 95%,
96%, 97%, 98% o 99% o más identidad de secuencia con SEC ID Nº: 1, y que tiene unamodificación de nucleótidos donde los nucleótidos en las posiciones 139 a 141 de SEC ID Nº: 1 se cambian aTTT o TTC, donde el polipéptido tiene termoestabilidad mejorada sobre la fitasa de SEC ID Nº: 2;
(b) un ácido nucleico que codifica un polipéptido que tiene una actividad fitasa y que tiene al menos 95%, 96%,97%, 98% o 99% o más identidad de secuencia de SEC ID Nº: 2, y que tiene una modificación de aminoácidosdonde el aminoácido alanina en la posición de aminoácido 47 de SEC ID Nº: 2 se reemplaza por una fenilalanina,donde el polipéptido tiene termoestabilidad mejorada sobre la fitasa de SEC ID Nº: 2;
(c) la secuencia de ácido nucleico de (a) o (b) que codifica un polipéptido que tiene una actividad fitasa pero quecarece de: una secuencia señal o secuencia de proproteína, o una secuencia promotora homóloga;
(d) el ácido nucleico de cualquiera de (a) a (c) que codifica un polipéptido que tiene una actividad fitasa y quecomprende además una secuencia de aminoácidos heteróloga, o el ácido nucleico de cualquiera de (a) a (c) quecomprende además una secuencia de nucleótidos heteróloga;
(e) el ácido nucleico de (d), donde la secuencia de aminoácidos heteróloga comprende, o consiste en unasecuencia que codifica una secuencia señal heteróloga (líder), o un marcador o un epítopo, o la secuencia denucleótidos heteróloga que comprende un promotor heterólogo o codifica una secuencia diana; o
(f) una secuencia de ácido nucleico completamente complementaria de la secuencia de ácido nucleico decualquiera de (a) a (e).
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/079187.
Solicitante: VERENIUM CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 3550 John Hopkins Court San Diego CA 92121 ESTADOS UNIDOS DE AMERICA.
Inventor/es: FREY,Gerhard, STEER,BRIAN, DYCAICO,MARK, KLINE,KATIE, TREFZER,AXEL, TODARO,TOM, SOLBAK,ARNE, EL-FARRAH,FATIMA, ALVARADO,ALBERTO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A01H5/00 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01H NOVEDADES VEGETALES O PROCEDIMIENTOS PARA SU OBTENCION; REPRODUCCION DE PLANTAS POR TECNICAS DE CULTIVO DE TEJIDOS. › Angiospermas,es decir, plantas con flores, caracterizadas por sus partes vegetales; Angiospermas caracterizadas de forma distinta que por su taxonomía botánica.
PDF original: ES-2438268_T3.pdf
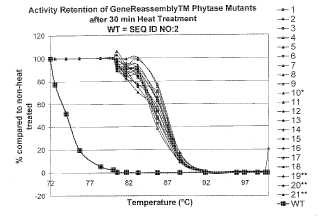
Fragmento de la descripción:
Fitasas, ácidos nucleicos que las codifican y métodos para su producción y uso
Campo de la invención La presente invención se refiere a fitasas, a polinucleótidos que las codifican, a usos de los polinucleótidos y polipéptidos de la invención, así como a la producción y aislamiento de dichos polinucleótidos y polipéptidos. En particular, la invención proporciona polipéptidos que, en condiciones de alta temperatura, tienen actividad fitasa, y fitasas que conservan su actividad después de exposición a altas temperaturas. Las fitasas de la invención pueden ser termotolerantes y/o termoestables a bajas temperaturas, además de a altas temperaturas. Las fitasas de la invención pueden usarse en productos alimenticios para mejorar el valor nutritivo de los ingredientes ricos en fitasas. Las fitasas de la invención pueden formularse como alimentos, como piensos o como complementos, por ejemplo, para ayudar a realizar la digestión del fitato. Los alimentos o piensos de la invención pueden estar en forma de gránulos, líquidos, polvos y similares. En un aspecto, las fitasas de la invención son estables frente a la desnaturalización térmica durante la granulación, y esto disminuye el coste del producto fitasa manteniendo al mismo tiempo la eficacia in vivo y la detección de la actividad en la alimentación.
Antecedentes Los minerales son alimentos esenciales para el crecimiento de todos los organismos. Los minerales dietéticos pueden proceder de muchas fuentes materiales, incluidas las plantas. Por ejemplo, las semillas de las plantas son una fuente rica de minerales ya que contienen iones formando complejos con los grupos fosfatos de moléculas de ácido fítico. Estos minerales asociados a fitato pueden, en algunos casos, satisfacer las necesidades dietéticas de algunas especies de animales de granja, tales como rumiantes multigástricos. Por consiguiente, en algunos casos, los rumiantes requieren menos complementación dietética con fosfato inorgánico y minerales debido a que los microorganismos que se encuentran en el rumen producen enzimas que catalizan la conversión del fitato (hexafosfato de mioinositol) a inositol y fosfato inorgánico. En el proceso, se liberan los minerales que han formado complejo con el fitato. Sin embargo, la mayoría de las especies de animales de granja, no pueden utilizar eficazmente los minerales asociados a fitato. Por tanto, por ejemplo, en la producción pecuaria de animales monogástricos (por ejemplo, cerdos, aves y peces) , para mejorar las tasas de crecimiento, el pienso se complementa normalmente con minerales y/o con antibióticos que modifican el medio de la flora digestiva del organismo consumidor.
Como tal, existen muchas cargas problemáticas -relacionadas con nutrición, etapas de tratamiento ex vivo, salud y medicina, conservación ambiental y gestión de recursos-que están asociadas con una hidrólisis insuficiente de fitato en muchas aplicaciones. A continuación se indican ejemplos no limitantes de estos problemas:
1) La complementación de dietas con minerales inorgánicos tiene un coste elevado. 2) La presencia de fitato no hidrolizado es indeseable y problemática en muchas aplicaciones ex vivo (por ejemplo, ocasionando la presencia de sedimento residual no deseado) . 3) La complementación de dietas con antibióticos plantea una amenaza médica en seres humanos y en animales por igual, aumentando la abundancia de patógenos tolerantes a antibióticos 4) La liberación de minerales fecales no absorbidos en el medio ambiente altera y daña los ecosistemas de 45 suelos circundantes, aguas de piscifactorías y aguas de superficie en general. 5) Las valiosas ofertas nutricionales de muchos productos alimenticios posibles permanecen sin explotar y desaprovechadas, de un modo significativo.
Por consiguiente, los productos alimenticios que contienen fitato requieren complementación con nutrientes exógenos y/o con una fuente de actividad fitasa para corregir sus deficientes ofertas nutricionales tras el consumo por una gran cantidad de especies de organismos.
Por consiguiente, en diversas aplicaciones existe una necesidad de medios que consigan una hidrólisis eficaz y rentable del fitato. Particularmente, existe una necesidad de medios que optimicen la hidrólisis del fitato en 55 aplicaciones comerciales. En un aspecto particular, existe una necesidad de optimizar métodos de tratamiento convencionales que mejoren las ofertas nutricionales de los productos alimenticios que contienen fitato para el consumo en seres humanos y en animales de granja.
Sumario de la invención La presente invención proporciona polipéptidos que tienen actividad fitasa, polinucleótidos que los codifican, usos de los polipéptidos y polinucleótidos de la invención y métodos para la producción y aislamiento de dichos polipéptidos y polipéptidos. En un aspecto, la invención proporciona polipéptidos que tienen actividad fitasa en condiciones de alta temperatura, y fitasas que conservan su actividad después de exposición a altas temperaturas. Las fitasas de la 65 invención pueden usarse en productos alimenticios para mejorar el valor nutritivo de los ingredientes ricos en fitato. Las fitasas de la invención pueden formularse como alimentos o piensos o complementos para, por ejemplo, ayudar
a realizar la digestión del fitato. Los alimentos o piensos de la invención pueden estar en forma de gránulos, comprimidos, píldoras, líquidos, polvos, aerosoles y similares. En un aspecto, las fitasas de la invención son estables frente a desnaturalización térmica durante la granulación; y esto disminuye el coste del producto fitasa manteniendo al mismo tiempo la eficacia in vivo y la detección de la actividad en la alimentación.
SUMARIO:
La invención proporciona ácidos nucleicos aislados, sintéticos o recombinantes, que comprenden (a) una secuencia de ácido nucleico que codifica un polipéptido que tiene actividad fitasa y que tiene una identidad de secuencia de al menos 95 %, 96 % 97 %, 98 % o 99 % con la SEC ID Nº: 1, y que tiene una modificación de nucleótidos donde los nucleótidos en las posiciones 139 a 141 de la SEC ID Nº: 1 son TTT o TTC, donde el polipéptido tiene termoestabilidad mejorada sobre la fitasa de la SEC ID Nº: 2. Opcionalmente, la secuencia puede comprender adicionalmente al menos de una a todas las trece modificaciones de la SEC ID Nº: 15 11 seleccionadas de los nucleótidos en las posiciones 289 a 291 que son GTT, GTC, GTA o GTG; de los nucleótidos en las posiciones 289 a 291 que son GAA o GAG; de los nucleótidos en las posiciones 406 a 408 que son CAT o CAC; de los nucleótidos en las posiciones 475 a 477 que son GTT, GTC, GTA o GTG; de los nucleótidos en las posiciones 475 a 477 que son GAA o GAG; de los nucleótidos en las posiciones 487 a 489 que son CGT, CGC, CGA, CGG, AGA o AGG; de los nucleótidos en las posiciones 490 a 492 que son CGT, CGC, CGA, CGG, AGA o AGG; de los nucleótidos en las posiciones 502 a 504 que son CGT, CGC, CGA, CGG, AGA o AGG; de los nucleótidos en las posiciones 535 a 537 que son CGT, CGC, CGA, CGG, AGA o AGG; de los nucleótidos en las posiciones 676 a 678 que son GAT o GAC; de los nucleótidos en las posiciones 697 a 699 que son TGG; de los nucleótidos en las posiciones 823 a 825 que son GTT, GTC, GTA o GTG; de los nucleótidos en las posiciones 865 a 867 que son GCT, GCC, GCA o GCG; de los nucleótidos en las posiciones 1045 a 1047 que son TAT o TAC; y de los nucleótidos en las posiciones 1087 a 1089 que son CCA, CCC, CCG o CCT; o,
(b) un polipéptido que codifica un polipéptido que tiene actividad fitasa y que tiene una identidad de secuencia de al menos 95 %, 96 %, 97 %, 98 % o 99 % o más con la SEC ID Nº: 2 y que tiene una secuencia que comprende al menos una modificación de restos de aminoácidos donde el aminoácido alanina en la posición de aminoácido 47 de la SEC ID Nº: 2 se reemplaza por una fenilalanina donde el polipéptido tiene termoestabilidad mejorada sobre la fitasa de la SEC ID Nº: 2;
(c) la secuencia de ácido nucleico de (a) o (b) que codifica un polipéptido que tiene una actividad fitasa pero que carece de una secuencia señal o secuencia proproteína, o una secuencia promotora homóloga;
(d) el ácido nucleico de cualquiera de (a) a (c) que codifica un polipéptido que tiene una actividad fitasa y que 35 adicionalmente comprende una secuencia de aminoácidos heteróloga, o el ácido nucleico de cualquiera de (a) a
(c) que comprende adicionalmente una secuencia de nucleótidos heteróloga;
(e) el ácido nucleico de (d) , donde la secuencia de aminoácidos heteróloga comprende, o consta de una secuencia que codifica una secuencia señal (líder) heteróloga, o una etiqueta o un epítopo, o la secuencia de nucleótidos heteróloga... [Seguir leyendo]
Reivindicaciones:
1. Un ácido nucleico aislado, sintético o recombinante que comprende
(a) una secuencia de ácido nucleico que codifica un polipéptido que tiene una actividad fitasa y que tiene al menos 95%, 96%, 97%, 98% o 99% o más identidad de secuencia con SEC ID Nº: 1, y que tiene una modificación de nucleótidos donde los nucleótidos en las posiciones 139 a 141 de SEC ID Nº: 1 se cambian a TTT o TTC, donde el polipéptido tiene termoestabilidad mejorada sobre la fitasa de SEC ID Nº: 2;
(b) un ácido nucleico que codifica un polipéptido que tiene una actividad fitasa y que tiene al menos 95%, 96%, 97%, 98% o 99% o más identidad de secuencia de SEC ID Nº: 2, y que tiene una modificación de aminoácidos donde el aminoácido alanina en la posición de aminoácido 47 de SEC ID Nº: 2 se reemplaza por una fenilalanina, donde el polipéptido tiene termoestabilidad mejorada sobre la fitasa de SEC ID Nº: 2;
(c) la secuencia de ácido nucleico de (a) o (b) que codifica un polipéptido que tiene una actividad fitasa pero que carece de: una secuencia señal o secuencia de proproteína, o una secuencia promotora homóloga;
(d) el ácido nucleico de cualquiera de (a) a (c) que codifica un polipéptido que tiene una actividad fitasa y que comprende además una secuencia de aminoácidos heteróloga, o el ácido nucleico de cualquiera de (a) a (c) que comprende además una secuencia de nucleótidos heteróloga;
(e) el ácido nucleico de (d) , donde la secuencia de aminoácidos heteróloga comprende, o consiste en una secuencia que codifica una secuencia señal heteróloga (líder) , o un marcador o un epítopo, o la secuencia de nucleótidos heteróloga que comprende un promotor heterólogo o codifica una secuencia diana; o
(f) una secuencia de ácido nucleico completamente complementaria de la secuencia de ácido nucleico de cualquiera de (a) a (e) .
2. El ácido nucleico aislado, sintético o recombinante de la reivindicación 1, donde el ácido nucleico comprende además al menos una, dos, tres, cuatro, cinco, seis, siete, ocho, nueve, diez, once, doce, o las trece modificaciones de secuencia de pares de bases de nucleótidos de SEC ID Nº: 1, seleccionadas del grupo que consiste en:
los nucleótidos en las posiciones 289 a 291 son GTT, GTC, GTA o GTG; los nucleótidos en las posiciones 289 a 291 son GAA o GAG; los nucleótidos en las posiciones 406 a 408 son CAT o CAC; los nucleótidos en las posiciones 475 a 477 son GTT, GTC, GTA o GTG; los nucleótidos en las posiciones 475 a 477 son GAA o GAG; los nucleótidos en las posiciones 487 a 489 son CGT, CGC, CGA, CGG, AGA o AGG; los nucleótidos en las posiciones 490 a 492 son CGT, CGC, CGA, CGG, AGA o AGG; los nucleótidos en las posiciones 502 a 504 son CGT, CGC, CGA, CGG, AGA o AGG; los nucleótidos en las posiciones 535 a 537 son CGT, CGC, CGA, CGG, AGA o AGG; los nucleótidos en las posiciones 676 a 678 son GAT o GAC; los nucleótidos en las posiciones 697 a 699 son TGG; los nucleótidos en las posiciones 823 a 825 son GTT, GTC, GTA o GTG; los nucleótidos en las posiciones 865 a 867 son GCT, GCC, GCA o GCG; los nucleótidos en las posiciones 1045 a 1047 son TAT o TAC; y los nucleótidos en las posiciones 1087 a 1089 son CCA, CCC, CCG o CCT,
donde el polipéptido tiene termoestabilidad mejorada sobre la fitasa de SEC ID Nº: 2.
3. Un casete de expresión, vector, vehículo de clonación, vector de expresión, vector de clonación (i) que comprende el ácido nucleico de la reivindicación 1 o 2, o que tiene contenido en el mismo un ácido nucleico de la reivindicación 1 o 2; o (ii) el casete de expresión, vector, vehículo de clonación, vector de expresión, vector de clonación de (i) , donde el vehículo de clonación comprende o es un vector viral, un plásmido, un fago, un fagémido, un cósmido, un fósmido, un bacteriófago o un cromosoma artificial, y opcionalmente el vector viral comprende un vector adenoviral, un vector retroviral o un vector viral adenoasociado y opcionalmente el casete de expresión, vector, vehículo de clonación, vector de expresión, vector de clonación comprende o está contenido en un cromosoma artificial bacteriano (BAC) , un plásmido, un vector derivado de bacteriófago P1 (PAC) , un cromosoma artificial de levadura (YAC) , un cromosoma artificial de mamífero (MAC) .
4. Una célula transformada o célula hospedadora (i) que comprende: el ácido nucleico de la reivindicación 1 o 2, o el casete de expresión, vector, vehículo de clonación, vector de expresión, vector de clonación de la reivindicación 3; o
(ii) la célula transformada o célula hospedadora de (i) , donde la célula es una célula bacteriana, una célula de mamífero, una célula fúngica, una célula de levadura, una célula de insecto o una célula vegetal; (iii) la célula transformada o célula hospedadora de (ii) , donde la célula bacteriana es cualquier especie dentro de los géneros Escherichia, Bacillus, Streptomyces, Salmonella, Pseudomonas o Staphylococcus o Escherichia coli, Lactococcus lactis, Bacillus subtilis, Bacillus cereus, Salmonella typhimurium o Pseudomonas fluorescens.
5. Una planta o semilla transgénica (i) que comprende: el ácido nucleico de la reivindicación 1 o 2, o el casete de expresión, vector, vehículo de clonación, vector de expresión, vector de clonación de la reivindicación 3; o la célula transformada o célula hospedadora de la reivindicación 4; o (ii) la planta o semilla transgénica de (i) , y
opcionalmente donde la planta es una planta de maíz, una planta de patata, una planta de tomate, una planta de trigo, una planta oleaginosa, una planta de colza, una planta de soja o una planta de tabaco, o una planta de forraje y/o pienso para un animal, o para un animal rumiante, y opcionalmente donde la planta de forraje o pienso es o comprende heno, maíz, mijo, soja, trigo, alforfón, cebada, alfalfa, centeno, una planta herbácea anual, sorgo, pasto del Sudán, pasto de Veldt o pasto de búfalo; o, la semilla es una semilla de maíz, un grano de trigo, una semilla oleaginosa, una semilla de colza, una semilla de soja, un grano de palma, una semilla de girasol, una semilla de sésamo, un cacahuete o una semilla de cacahuete, una semilla de alfalfa, una semilla de algodón, una semilla de cártamo, una semilla de sorgo, un grano de avena, una semilla de centeno, una semilla de mijo, una semilla de cebada, un grano de arroz, una semilla de guisante o una semilla de planta de tabaco, y opcionalmente la planta es maíz, alfalfa, girasol, Brassica, soja, caña de azúcar, algodón, cártamo, cacahuete, sorgo, trigo, avena, centeno, mijo, cebada, arroz, coníferas, guisante, judía, soja, patata, batata, yuca, taro, caña de azúcar o remolacha azucarera.
6. Un polipéptido de fitasa aislado, sintético o recombinante que comprende
(a) una secuencia de aminoácidos que tiene al menos 95%, 96%, 97%, 98% o 99% de identidad de secuencia con SEC ID Nº: 2 y codificado por un ácido nucleico que comprende una modificación de nucleótido, donde los nucleótidos en las posiciones 139 a 141 de SEC ID Nº: 1 son TTT o TTC, donde el polipéptido tiene termoestabilidad mejorada sobre la fitasa de SEC ID Nº: 2;
(b) un secuencia de aminoácidos que tiene al menos 95%, 96%, 97%, 98% o 99% de identidad de secuencia con SEC ID Nº: 2, y que tiene una modificación de aminoácido donde el aminoácido alanina en la posición de aminoácido 47 de SEC ID Nº: 2 se reemplaza por una fenilalanina, donde el polipéptido tiene termoestabilidad mejorada sobre la fitasa de SEC ID Nº: 2;
(c) el polipéptido de (a) o (b) que tiene una actividad fitasa pero carece de: una secuencia señal o secuencia de proproteína;
(d) el polipéptido de cualquiera de (a) a (c) que tiene una actividad fitasa y que comprende además una secuencia heteróloga;
(e) el polipéptido de (d) donde la secuencia de aminoácidos heteróloga comprende, o consiste en una secuencia señal heteróloga (líder) , o un marcador o un epítopo, o la secuencia heteróloga comprende un péptido de identificación o una secuencia de dirección; o
(f) el polipéptido de cualquiera de (a) a (e) , donde (i) el polipéptido está glicosilado, o el polipéptido comprende al menos un sitio de glicosilación, (ii) el polipéptido de (i) donde la glicosilación es una glicosilación ligada a N o una glicosilación ligada a O; (iii) el polipéptido de (i) o (ii) donde el polipéptido está glicosilado después de expresarse en una célula de levadura; o (iv) el polipéptido de (iii) donde la célula de levadura es una P. pastoris o una S. pombe.
7. El polipéptido aislado, sintético o recombinante de la reivindicación 6, donde la secuencia de aminoácidos comprende además al menos dos, tres, cuatro, cinco, seis, siete, ocho, nueve, diez, once, doce o las trece modificaciones de restos de aminoácidos de SEC ID Nº: 2, seleccionadas del grupo que consiste en:
el aminoácido cisteína en la posición de aminoácido 97 de SEC ID Nº: 2 se reemplaza por una valina; el aminoácido cisteína en la posición de aminoácido 97 de SEC ID Nº: 2 se reemplaza por un ácido glutámico; el aminoácido en el equivalente de la treonina en la posición de aminoácido 136 de SEC ID Nº: 2 se reemplaza por una histidina; el aminoácido asparagina en la posición de aminoácido 159 de SEC ID Nº: 2 se reemplaza por una valina; el aminoácido asparagina en la posición de aminoácido 159 de SEC ID Nº: 2 se reemplaza por un ácido glutámico; el aminoácido en el equivalente de la treonina en la posición de aminoácido 163 de SEC ID Nº: 2 se reemplaza por una arginina; el aminoácido ácido aspártico en la posición de aminoácido 164 de SEC ID Nº: 2 se reemplaza por una arginina; el aminoácido ácido glutámico en la posición de aminoácido 168 de SEC ID Nº: 2 se reemplaza por una arginina; el aminoácido glicina en la posición de aminoácido 179 de SEC ID Nº: 2 se reemplaza por una arginina; el aminoácido cisteína en la posición de aminoácido 226 de SEC ID Nº: 2 se reemplaza por un ácido aspártico; el aminoácido valina en la posición de aminoácido 233 de SEC ID Nº: 2 se reemplaza por un triptófano; el aminoácido glutamina en la posición de aminoácido 275 de SEC ID Nº: 2 se reemplaza por una valina; el aminoácido arginina en la posición de aminoácido 289 de SEC ID Nº: 2 se reemplaza por una alanina; el aminoácido treonina en la posición de aminoácido 349 de SEC ID Nº: 2 se reemplaza por una tirosina; y el aminoácido leucina en la posición de aminoácido 363 de SEC ID Nº: 2 se reemplaza por una prolina, donde el polipéptido tiene termoestabilidad mejorada sobre la fitasa de SEC ID Nº: 2.
8. Un método para producir un polipéptido recombinante de la reivindicación 6 o reivindicación 7 que comprende las etapas de: (a) proporcionar un ácido nucleico de la reivindicación 1 o 2; y (b) expresar el ácido nucleico de la etapa
(a) en condiciones que permitan la expresión del polipéptido, produciendo de este modo un polipéptido recombinante, y opcionalmente el método comprende además transformar una célula hospedadora con el ácido nucleico de la etapa (a) seguido de expresar el ácido nucleico de la etapa (a) , produciendo de este modo el polipéptido recombinante en una célula hospedadora transformada.
9. Un método para hidrolizar un hexafosfato de inositol a inositol y fosfato inorgánico que comprende:
(i) (a) proporcionar un polipéptido que tenga una actividad fitasa, donde el polipéptido comprende la secuencia de aminoácidos de la reivindicación 6 o 7, o un polipéptido codificado por el ácido nucleico de la reivindicación 1 o 2;
(b) proporcionar una composición que comprenda un hexafosfato de inositol; y (c) poner en contacto el polipéptido de la etapa (a) con la composición de la etapa (b) en condiciones donde el polipéptido hidrolice el hexafosfato de inositol para producir inositol y fosfato inorgánico;
(ii) el método de (i) , donde las condiciones comprenden una temperatura de entre aproximadamente 37 ºC y aproximadamente 70 ºC, entre aproximadamente 50 ºC y aproximadamente 80 ºC o entre aproximadamente 60 ºC y aproximadamente 90 ºC; o
(iii) el método de (i) o (ii) , donde la composición comprende un ácido fítico.
10. Un método para desgomado de aceites que comprende: (a) proporcionar un polipéptido que tenga una actividad fitasa, donde el polipéptido comprende la secuencia de aminoácidos de la reivindicación 6 o 7, o un polipéptido codificado por el ácido nucleico de la reivindicación 1 o 2; (b) proporcionar una composición que comprenda un aceite vegetal; y (c) poner en contacto el polipéptido de la etapa (a) y el aceite vegetal de la etapa (b) en condiciones donde el polipéptido pueda escindir un enlace de fosfato inorgánico de inositol, desgomando de este modo el aceite vegetal.
11. Un método para producir una matriz comestible de liberación enzimática en forma de gránulos, que comprende:
(a) proporcionar el polipéptido de la reivindicación 6 o 7 o un polipéptido codificado por el ácido nucleico de la reivindicación 1 o 2; (b) proporcionar un grano, un germen de grano o un sustrato basado en grano; y (c) combinar el polipéptido de (a) y el grano, germen de grano o sustrato basado en grano de (b) para formar una matriz comestible de liberación enzimática en forma de gránulos, donde la matriz comestible de liberación se forma granulando para producir una partícula y opcionalmente los gránulos se realizan en condiciones que comprenden aplicación de vapor, opcionalmente los gránulos se realizan en condiciones que comprenden aplicación de una temperatura de más de 80 ºC durante aproximadamente 5 minutos y opcionalmente el gránulo comprende una enzima fitasa que comprende una actividad específica de al menos 350 a aproximadamente 900 unidades por miligramo de enzima.
12. Un método no terapéutico para suministrar un complemento de enzima fitasa a un animal o un ser humano, comprendiendo dicho método:
(a) preparar una matriz comestible de liberación en forma de gránulos en un método de acuerdo con la reivindicación 11, y
(b) administrar la matriz comestible de liberación enzimática al animal o ser humano.
13. Un método para procesar granos de maíz y sorgo que comprende (a) proporcionar un polipéptido que tenga una actividad fitasa, donde el polipéptido comprende el polipéptido de la reivindicación 6 o 7; (b) proporcionar una composición que comprenda un agua de macerado de maíz o un agua de macerado de sorgo y (c) poner en contacto el polipéptido de la etapa (a) y la composición de la etapa (b) en condiciones donde el polipéptido pueda escindir una enlace de fosfato inorgánico de inositol.
14. Una composición para aliviar (ralentizar el progreso de, tratar o prevenir) osteoporosis que comprende el polipéptido de la reivindicación 6 o 7; donde opcionalmente el polipéptido está glicosilado, y donde la actividad fitasa es termotolerante o termoestable.
15. Una preparación proteica que comprende el polipéptido de la reivindicación 6 o 7, donde la preparación proteica comprende un líquido, una pasta espesa, un polvo, una pulverización, una suspensión, una composición/formulación liofilizada, un sólido, un comprimido recubierto con película, una píldora, un implante, un gel o una formulación farmacéutica, un alimento o un pienso o un complemento de los mismos.
16. Una composición que comprende el polipéptido de la reivindicación 6 o 7, donde la composición se selecciona de una unidad de Comida Individual Lista para Consumir (MRE) , una bebida, un agente de hidratación, un comprimido masticable, una barra nutricional, un alimento precocinado, un cereal de desayuno, un producto farmacéutico, una formulación dietética, una harina de soja, un alimento, un pienso y una matriz comestible de liberación enzimática en forma de gránulos.
Patentes similares o relacionadas:
Producción de partículas similares al virus de la gripe en plantas, del 6 de Mayo de 2020, de MEDICAGO INC.: Un ácido nucleico que comprende una región reguladora activa en una planta y un potenciador de la expresión activo en una planta, la región […]
Combinación de dos elementos genéticos para el control del desarrollo del tipo floral de una planta dicotiledónea, y utilización en procedimientos de detección y selección, del 1 de Abril de 2020, de Institut national de recherche pour l'agriculture, l'alimentation et l'environnement: Utilización de una combinación de dos elementos genéticos para el control del desarrollo del tipo floral de una planta dicotiledónea, comprendiendo dicha combinación, respectivamente: […]
Proteínas insecticidas y métodos para su uso, del 12 de Febrero de 2020, de PIONEER HI-BRED INTERNATIONAL, INC.: Una construcción de ADN que comprende una molécula de ácido nucleico heteróloga que codifica un polipéptido de PIP-72 que tiene actividad insecticida contra el gusano de […]
Polinucleótidos y polipéptidos aislados, y métodos para usar los mismos para incrementar la eficiencia en el uso de nitrógeno, rendimiento, tasa de crecimiento, vigor, biomasa, contenido de aceite, y/o tolerancia al estrés abiótico, del 13 de Noviembre de 2019, de Evogene Ltd: Un método para incrementar la eficiencia en el uso de nitrógeno, biomasa en condiciones limitantes de nitrógeno, y/o tasa de crecimiento de una planta que comprende: […]
Moléculas pequeñas de ARN que median en la interferencia de ARN, del 22 de Octubre de 2019, de MAX-PLANCK-GESELLSCHAFT ZUR FORDERUNG DER WISSENSCHAFTEN E.V.: Molécula de ARN de doble hebra aislada, en la que cada hebra de ARN tiene una longitud de 19-25 nucleótidos y al menos una hebra tiene un saliente […]
Receptor de reconocimiento de patrones de plantas y quimeras del mismo para su uso contra infecciones bacterianas, del 11 de Septiembre de 2019, de EBERHARD-KARLS-UNIVERSITAT TUBINGEN: Un receptor de reconocimiento de patrones quiméricos (PRR) para reconocer patrones moleculares asociados a patógenos de plantas, que comprende al menos un ectodominio […]
Planta Brassica que comprende un alelo indehiscente mutante, del 11 de Septiembre de 2019, de BASF Agricultural Solutions Seed US LLC: Un alelo mutante defectivo parcial de un gen IND, en el que el gen IND comprende una molécula de ácido nucleico seleccionada del grupo que […]
Plantas de arroz que tienen tolerancia incrementada frente a herbicidas de imidazolinona, del 31 de Julio de 2019, de INSTITUTO NACIONAL DE TECNOLOGIA AGROPECUARIA: Un método para la caracterización molecular de una planta de arroz que comprende amplificar, mediante PCR, un gen AHAS de una planta de arroz, en donde la […]