Células madre estromales.
Una población de células madre estromales de mamíferos, en donde 30% o más de las células son positivas para Syndecan-2.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2013/052692.
Solicitante: Orbsen Therapeutics Limited.
Inventor/es: ELLIMAN,STEPHEN JOSEPH.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K35/28 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Médula ósea; Células madre hematopoyéticas; Células madre mesenquimales de cualquier origen, por ejemplo células madre derivadas de tejido adiposo.
- C12N5/071 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células o tejidos de vertebrados, p.ej. células o tejidos humanos.
PDF original: ES-2539186_T3.pdf




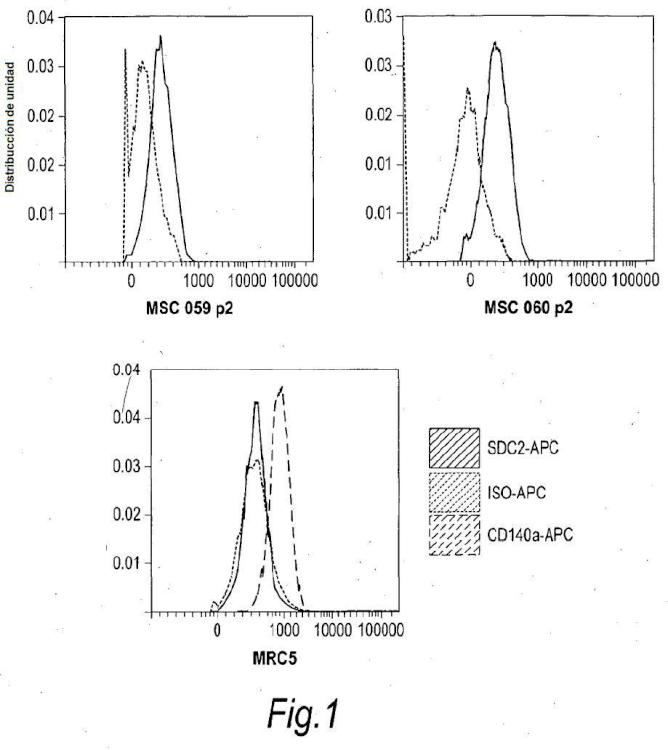
Fragmento de la descripción:
Células madre estromales Introducción La presente invención se relaciona con métodos para el aislamiento de células madre, con poblaciones de células madre obtenidas a partir de células aisladas y con usos de estas poblaciones.
Fundamento En las décadas de 1960 y 1970, Friedenstein y sus colegas demostraron que el potencial osteogénico -revelado por trasplante heterotópico de células de médula ósea (BM) -estaba asociado con una sub-población menor de células mononucleares (MNCs) de BM (revisado en Friedenstein, 1990) . Estas MNCs podían ser distinguidas de la mayoría de las MNC hematopoyéticas por su rápida adherencia a recipientes plásticos para cultivo de tejidos y por una apariencia de su progenie en cultivo similar a fibroblastos, sugiriendo un origen del compartimiento estromal de BM. A la vez que establecieron el estroma BM como la fuente, Friedenstein, Owen y sus colegas suministraron un segundo avance mostrando que la inoculación de suspensiones celulares de BM a densidad clonal da como resultado el establecimiento de colonias discretas iniciadas por células individuales (unidad fibroblástica formadora de colonia, CFU-F [Friedenstein et al., 1970]) .
Posteriormente Friedenstein y Owen llamaron a esta célula generadora de CFU-F, la célula madre estromal (SSC) (Owen y Friedenstein, 1988) y las referencias a SSC se basan aquí en aquella definición original de célula.
Las SSCs derivadas de BM pueden ser identificadas en una población mixta de MNCs fibroblásticas que se adhieren al plástico (PA) , que dan lugar a hueso, grasa o cartílago y segregan potentes proteínas immunomodulatorias y angiogénicas. Los estudios pre-clínicos demuestran que las PA-SSC median potentes respuestas immunomodulatorias y angiopoyéticas in vivo. Actualmente, los ensayos clínicos están probando PA-SSC en 40 distintas enfermedades degenerativas, autoinmunes e isquémicas.
En la médula humana, aproximadamente 1 célula mononuclear (MNC) BM por cada 80, 000 MNC es una SSC que forma CFU-F. A la fecha, el método más simple y frecuentemente usado para aislar estas SSC de BM depende de la adherencia previamente notada a plástico para el cultivo de tejidos, de acuerdo con lo cual se dejan las MNC en incubación por 10-14 días y en este intervalo las CFU-F se unirán y formarán colonias a una frecuencia reconocida de 1:80000. A los 10-14 días se recogen estas CFU-F por digestión con tripsina y se siembran en placa nuevamente en un medio rico en suero a una densidad de 3-8000 CFU-F por cm2. Estas CFU-F son entonces propagadas in vitro hasta que se obtiene un número de células suficiente para permitir la evaluación bioquímica y citológica. Esta aproximación es usada ampliamente pero es mirada como inadecuada para definir o purificar SSC para uso clínico en la medida en que sólo 1:80, 000 BMMNC sembradas en placa son SSC y los métodos no cumplen con los buenos protocolos de fabricación requeridos para la aprobación clínica de productos relacionados.
Por ello, en la técnica previa se han identificado las poblaciones de células madre con base en una habilidad inicial para adherirse a una superficie plástica. A partir de esta tamización inicial, las poblaciones celulares se obtienen como poblaciones clonales, desde unidades individuales formadoras de colonia sobre la superficie. Éstas han sido denominadas en la literatura también como "células madre mesenquimales" aunque el término puede ser incorrecto porque las células no mesenquimales pueden estar incluidas dentro de las células aisladas. En una aproximación conocida de aislamiento, estas poblaciones de células conocidas son derivadas de células madre que presentan reacción positiva a la fosfatasa alcalina (ALP) y CD271. Sin embargo, en términos clínicos la célula es esencialmente no identificada.
Las poblaciones celulares son preparadas a partir de estas células aisladas conocidas, tales como mediante expansión clonal a partir de una célula individual aislada, y usadas para trasplante. Sin embargo, los resultados varían en que las poblaciones de células trasplantadas se comportan algunas veces de manera más bien diferente de lote a lote, y de una manera poco predecible.
En la técnica previa, las poblaciones celulares tienden a formar hueso y grasa y cartílago, pero con control limitado, haciendo frecuentemente grasa cuando se requiere hueso o cartílago. A la inversa, por ejemplo cuando se prefiere obtener células que hagan grasa, estas células que producen grasa son obtenidas sólo de manera no confiable.
Un problema significativo es que la población celular inicial es esencialmente indefinida, porque el aislamiento basado en la adherencia al plástico no es una definición suficientemente técnica para un tipo de célula. Incluso cuando son
seleccionadas, por ejemplo, por los marcadores mencionados (ALP y CD271) , la expresión de estos marcadores en las células o en la progenie desaparece rápidamente durante el cultivo, dejando una población efectivamente indefinida. Las propiedades útiles de las células también se reducen o desaparecen con el tiempo - otro problema con una población celular indefinida. Jones et al, Arthritis & Rheumatism, vol. 62, no. 7, pp1944-1954 describen el aislamiento de células estromales (MSCs) multi-potentes derivadas de la médula ósea humana que incluye la clasificación de células CD45bajaCD271+, usadas para terapia celular.
Rozemuller et al, Stem cells and Development, vol. 19, no. 12, 1 diciembre de 2010, pp 1911 -1921 describen el aislamiento de MSCs con varios anticuerpos que incluyen un anticuerpo para CD271 y posterior enriquecimiento para la actividad de CFU-F.
Kozanoglu Ilknur et al, Cytotherapy, vol. 11, no. 5, 2009, pp 5270533 describen el aislamiento de MSCs usando un anticuerpo NG2.
Cuthbert Richard et al, Cytotherapy, vol. 14, no. 4, 12 enero de 2012, pp 431-440 describen el aislamiento de células estromales brillantes CD45bajaCD271.
Objetivos de la invención Es un objetivo global de la invención suministrar métodos para el aislamiento de células madre estromales y poblaciones celulares y tejidos derivados de ellas que son por lo menos una alternativa para la técnica, y es un objeto de realizaciones particulares de la invención suministrar métodos que son mejorados, por ejemplo a través de la definición aumentada de las células obtenidas, o células y tejidos que son mejorados, por ejemplo mediante confiabilidad aumentada de sus propiedades, haciéndolos más adecuados para aplicaciones clínicas.
Resumen de la invención La presente invención se basa en el aislamiento prospectivo de células madre estromales, especialmente células madre estromales humanas, con base en la expresión de marcadores o antígenos que son expresados en una pluralidad de especies de mamíferos. En los métodos y poblaciones celulares de la invención, las células son clasificados con base en la expresión de un marcador particular de especies cruzadas, donde esto es denominado como aislamiento prospectivo, y luego cultivo de las células obtenidas, dejando para identificación de las células, es decir unidades formadores de colonia de fibroblastos (CFU-Fs) , las cuales pueden ser expandidas de manera clonal. La población celular obtenida después de la expansión clonal es entonces propuesta para usos terapéuticos, de trasplante y otros.
De acuerdo con ello, la invención suministra un método de aislamiento para una célula madre estromal, que incluye el aislamiento de una célula a partir de una población mixta de células de mamíferos, basado en la expresión de un marcador, en donde el marcador se une a un anticuerpo, y en donde dicho anticuerpo reacciona de manera cruzada con un marcador encontrado en una célula de por lo menos otra especie de mamíferos seleccionada de entre células de humano, ratón, rata, caballo, conejo y cerdo, donde el marcador es SDC2.
La invención suministra un método de aislamiento de una célula madre estromal, que incluye el aislamiento de una célula a partir de una población mixta de células de mamíferos, basado en la expresión del marcador, en donde el marcador (SDC2) es expresado por la célula de mamífero y en donde un marcador correspondiente es expresado también en una célula de por lo menos otra especie de mamíferos, seleccionada de entre células de humano, ratón, rata, 50 caballo, conejo y cerdo.
Preferiblemente el marcador es encontrado en células madre estromales humana y células madre estromales de ratón, o en células madre estromales humanas y células madre estromales de rata, o en todas las tres. En todas las realizaciones de la invención, el marcador es SDC2.
De manera más específica, la invención suministra un método para el aislamiento... [Seguir leyendo]
Reivindicaciones:
Reivindicaciones
1. Una población de células madre estromales de mamíferos, en donde 30% o más de las células son positivas para Syndecan-2.
2. Una población de células de acuerdo con la reivindicación 1, en donde las células son células de ratón, rata, equino o humano.
3. Una población de células de acuerdo con la reivindicación 2, en donde las células son células de humano.
4. Una población de células de acuerdo con cualquiera de las reivindicaciones 1 a 3, en donde 40% o más de las células son positivas para Syndecan-2.
5. Una población de células de acuerdo con cualquiera de las reivindicaciones 1 a 4, en donde 50% o más de las células 15 son positivas para Syndecan-2.
6. Una población de células de acuerdo con cualquiera de las reivindicaciones 1 a 5, en donde 75% o más de las células son positivas para Syndecan-2.
8. Un método de acuerdo con la reivindicación 7, para el aislamiento de células humanas. 10. Un método de acuerdo con cualquiera de las reivindicaciones 7 a 9, en donde la población mixta de células de mamíferos es obtenida a partir de una fuente seleccionada de médula ósea, tejido adiposo, músculo esquelético, endometrio, placenta, sangre del cordón umbilical, cordón umbilical, gel de Wharton y células derivadas de células pluripotentes. 11. Un método de acuerdo con la reivindicación 10, para el aislamiento de células osteogénicas y angiopoyéticas. 12. Un método de acuerdo con cualquiera de las reivindicaciones 7 a 11 para el aislamiento de células estromales, que 35 incluye adicionalmente el paso de derivación de una población de células a partir de aquellas células aisladas. 13. Un método para la obtención de una población clonal de células, que incluye el aislamiento de una célula individual de acuerdo con el método de cualquiera de las reivindicaciones 7 a 11; y derivación de una población clonal de células a partir de la célula individual. 14. Un método para la obtención de tejidos, que incluye la obtención de células de acuerdo con cualquiera de las reivindicaciones 7 a 13, y obtención de tejidos de ellas. 15. Un método de acuerdo con la reivindicación 14, en donde el tejido es hueso. 16. Un método de acuerdo con la reivindicación 14, en donde el tejido es cartílago. 17. Un método de acuerdo con la reivindicación 14, en donde el tejido es tendón. 50 18. Un ensayo que incluye el uso de las células de cualquiera de las reivindicaciones 1 a 6. 19. Una composición farmacéutica para el tratamiento de una enfermedad o desorden en un animal, por ejemplo un humano, que incluye células de acuerdo con cualquiera de las reivindicaciones 1-6. 20. Una composición de acuerdo con la reivindicación 19, que incluye solución salina o solución salina tamponada con fosfato, y que incluye opcionalmente también uno o más de dimetilsufóxido, albúmina de suero humano, ácido hialurónico y colágeno. 21. Células de acuerdo con cualquiera de las reivindicaciones 1-6 para el uso en el tratamiento de una enfermedad o 60 desorden de un animal, por ejemplo un humano. 7. Un método para el aislamiento de una célula madre estromal, que incluye el aislamiento de una célula a partir de una población mixta de células de mamíferos basado en la expresión de Syndecan-2.
9. Un método de acuerdo con la reivindicación 7, para el aislamiento de células de ratón, rata o equino.
Patentes similares o relacionadas:
Una terapia de combinación para un injerto estable y a largo plazo usando protocolos específicos para el agotamiento de los linfocitos T/B, del 20 de Mayo de 2020, de YEDA RESEARCH AND DEVELOPMENT CO. LTD.: Una dosis de células hematopoyéticas inmaduras de linfocitos T agotados, en donde dichas células hematopoyéticas inmaduras de linfocitos T agotados comprenden menos de 5 x 105 […]
Función promotora del crecimiento del cabello de células madre de tamaño pequeño y uso de las mismas, del 6 de Mayo de 2020, de MEDIPOST, CO., LTD.: Una composición para su uso en la terapia de pérdida de cabello para prevenir la pérdida de cabello y estimular el crecimiento del cabello, que comprende: células […]
Terapia con células madre basada en células madre procedentes de tejido adiposo, del 6 de Mayo de 2020, de RIGSHOSPITALET: Una composición que comprende una suspensión de una población sustancialmente homogénea e inmunosupresora de células madre procedentes de tejido adiposo (ASC) humanas adultas […]
Métodos y composiciones para el tratamiento de beta talasemia, del 15 de Abril de 2020, de Sangamo Therapeutics, Inc: Una célula madre hematopoyética CD34+ modificada genéticamente, que comprende: un par de nucleasas con dedos de zinc, comprendiendo el par: (i) una primera […]
Composiciones y métodos de células grasas marrones, del 1 de Abril de 2020, de Biorestorative Therapies, Inc: Un método para generar una célula grasa marrón, el método comprende: aislar una célula madre de un tejido graso marrón obtenido; y cultivar la célula […]
Péptido para inducir regeneración de tejido y uso del mismo, del 4 de Marzo de 2020, de StemRIM Inc: Un péptido que consiste en una porción de una proteína HMGB1 y tiene una actividad de estimulación de la migración de una célula, donde dicho péptido consiste en una cualquiera […]
Métodos para inducir apoptosis parcial utilizando polipéptidos de caspasa, del 4 de Marzo de 2020, de Bellicum Pharmaceuticals, Inc: Un ligando multimérico para usar en un método para el tratamiento del cáncer; comprendiendo dicho método controlar la supervivencia de las células terapéuticas en un […]
Método de proliferación celular y agente farmacéutico para reparación y regeneración de tejido, del 12 de Febrero de 2020, de Sapporo Medical University: Método para hacer crecer células madre mesenquimatosas humanas en una muestra recogida de un sujeto vivo cultivando las células en un medio, comprendiendo […]