Ensayo de células tumorales circulantes.
Un procedimiento para predecir la eficacia de una terapia con un antagonista del IGF-1R en un paciente,
quecomprende las etapas de: a) preparar una muestra en la que un espécimen biológico de un paciente se mezcla conun ligando que reacciona específicamente con células tumorales, para la exclusión sustancial de otros componentesde la muestra; b) poner en contacto la muestra con al menos un reactivo que se una específicamente a las célulasepiteliales; c) poner en contacto la muestra con un agente que tenga afinidad de unión por receptores del factor decrecimiento insulínico (IGF-1R) sobre las células; y d) analizar la muestra para determinar la presencia de célulastumorales que expresen el IGF-1R, en el que el ligando es un anticuerpo que se une específicamente a unamolécula de adhesión celular epitelial sobre la célula tumoral, en el que el reactivo es un anticuerpo marcado con FITC que reconoce citoqueratinas, en el que el agente es un anticuerpo marcado con PE, y en el que la presenciade células tumorales que expresan el IGF-1R en la muestra predice la eficacia de la terapia con un antagonista delIGF-1R en el paciente.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2007/001483.
Solicitante: PFIZER PRODUCTS INCORPORATED.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: EASTERN POINT ROAD GROTON, CT 06340 ESTADOS UNIDOS DE AMERICA.
Inventor/es: CONNELLY, MARK CARLE, GUALBERTO,ANTONIO, MRS LUISA MARIA PACCAGNELLA, MELVIN,CARRIE LYNN, REPOLLET,MADELINE I, CHIANESE,DAVID ALLEN, TERSTAPPEN,LEONARDUS WENDELINUS MATHIAS MARIE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/50 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Análisis químico de material biológico, p. ej. de sangre o de orina; Ensayos mediante métodos en los que interviene la formación de uniones bioespecíficas con grupos coordinadores; Ensayos inmunológicos (procedimientos de medida o ensayos diferentes de los procedimientos inmunológicos en los que intervienen enzimas o microorganismos, composiciones o papeles reactivos a este efecto, procedimientos para preparar estas composiciones, procedimientos de control sensibles a las condiciones del medio en los procedimientos microbiológicos o enzimáticos C12Q).
- G01N33/574 G01N 33/00 […] › para el cáncer.
PDF original: ES-2397971_T3.pdf
Fragmento de la descripción:
Ensayo de células tumorales circulantes
Antecedentes de la invención La presente invención se refiere a los campos de oncología y de pruebas diagnósticas, y más particularmente a procedimientos para la exploración del cáncer para predecir y controlar las repuestas al tratamiento con quimioterapia, la recurrencia del cáncer o similares.
El factor de crecimiento similar a insulina (IGF-1) es un polipéptido de 7, 5 kD que circula en plasma a concentraciones elevadas y puede detectarse en la mayoría de los tejidos. El IGF-1, que es estructuralmente similar a la insulina, estimula la diferenciación y proliferación celular y es necesario para la mayoría de los tipos de células de los mamíferos para una proliferación sostenida. Estos tipos de células incluyen, entre otros, fibroblastos diploides humanos, células epiteliales, células del músculo liso, linfocitos T, células neuronales, células mieloides, condrocitos, osteoblastos y células madre de la médula ósea.
La primera etapa en la ruta de la transducción que conduce a la proliferación o diferenciación celular, estimuladas por el IGF-1, es la unión del IGF-1 o del IGF-2 (o insulina a concentraciones suprafisiológicas) al receptor del IGF-1 (IGF-1R) . El IGF-1R pertenece a la familia de receptores del factor de crecimiento de la tirosina quinasa (Ullrich y col, Cell 61: 203-212, 1990) y es estructuralmente similar al receptor de insulina (Ullrich y col., EMBO J. 5: 25032512, 1986) .
Los estudios epidemiológicos sugieren que niveles normales del IGF-1 en el límite superior incrementan el riesgo de cánceres tales como el de pulmón, mama, próstata y colorrectal, al compararse con individuos con niveles normales del IGF-1 en el límite inferior. Además, existen muchas pruebas acerca del papel del IGF-1 y/o IGF-1R en el mantenimiento de las células tumorales in vitro e in vivo. Los niveles del IGF-1R son elevados en tumores de pulmón (Kaiser y col., J. Cancer Res. Clin. Oncol. 119: 665-668, 1993; Moody y col., Life Sciencies 52: 1161-1173, 1993; Macaulay y col., Cancer Res., 50: 2511-2517, 1990) , mama (Pollak y col., Cancer Lett. 38: 223-230, 1987; Foekens y col., Cancer Res. 49: 7002-7009, 1989; Arteaga y col., J. Clin. Invest. 84: 1418-1423, 1989) , próstata y colon (Remaole-Bennet y col., J. Clin. Endocrinol. Metab. 75: 609-616, 1992; Guo y col., Gastroenterol. 102: 1101-1108, 1992) . La alteración de la expresión del IGF-1 en el epitelio prostático conduce a neoplasia en ratones transgénicos (DiGiovanni y col., Proc. Nat’l. Acad. Sci. USA 97: 3455-3460, 2000) . Además el IGF-1 parece ser un estimulador autocrino de gliomas humanos (Sandberg-Nordqvist y col., Cancer Res. 53 (11) : 2475-78, 1993) , al mismo tiempo que se ha demostrado que el IGF-1 estimula el crecimiento de fibrosarcomas que sobreexpresan IGF-1R (Butler y col., Cancer Res. 58: 3021-3027, 1998) . Véase Macaulay, Br. J. Cancer, 65: 311-20, 1992 para una revisión sobre el papel que juega la interacción entre IGF-1/ IGF-1R en el crecimiento de diversos tumores humanos.
Utilizando vectores de expresión antisentido u oligonucleótidos antisentido frente al ARN del IGF-1R, se ha demostrado que la interferencia con el IGF-1R conduce a la inhibición del crecimiento celular mediado por el IGF-1 (véase, por ejemplo, Wraight y col., Nat. Biotech. 18: 521-526, 2000) . También puede inhibirse el crecimiento utilizando análogos peptídicos del IGF-1 (Pietrzkowski y col., Cell Growth y Diff. 3; 199-205, 1992; Pietrzkowski y col., Mol. Cell. Biol. 12: 3883-3889, 1992) , o un vector que exprese un ARN antisentido para el ARN del IGF-1 (Trojan y col., Science 259: 94-97, 1992) . Además, los anticuerpos contra el IGF-1R (Arteaga y col., Breast Canc. Res. Treatm. 22: 101-106, 1992; y Kalebic y col., Cancer Res. 54: 5531-34, 1994) , y los mutantes negativos dominantes del IGF-1R (Prager y col., Proc. Nat’l. Acad. Sci. USA 91: 2181-85, 1994; Li y col., J. Biol. Chem. 269: 32558-2564, 1994; Jiang y col., Oncogene 18: 6071-6077, 1999) , pueden invertir el fenotipo transformado, inhibir la tumorigénesis, e inducir la pérdida del fenotipo metastático.
El IGF-1 también es importante en la regulación de la apoptosis. La apoptosis, que es la muerte celular programada, está implicada en diversos procesos del desarrollo, incluida la maduración de los sistemas nervioso e inmunológico. Además de su papel en el desarrollo, la apoptosis también se ha implicado como un protector celular importante contra la tumorigénesis (Williams, Cell 65: 1097-1098, 1991; Lane, Nature 362: 786-787, 1993) . La supresión del programa apoptótico puede contribuir al desarrollo y progresión de neoplasias malignas.
El IGF-1 protege de la apoptosis por la retirada de citocinas en células hematopoyéticas dependientes de IL-3 (Rodríguez-Tarduchy, G. y col., J. Inmunol. 149: 535-540, 1992) , y de la retirada de suero en células Rat-1/mycER de rata (Harrington, E. y col., EMBO J. 13: 3286-3295, 1994) . La demostración de que los fibroblastos dirigidos por c-myc dependen del IGF-1 para su supervivencia sugiere que existe un papel importante del receptor de IGF-1 en el mantenimiento de células tumorales mediante la inhibición específicamente de la apoptosis, un papel distinto de los efectos proliferativos del IGF-1 o IGF-1R.
Los efectos protectores del IGF-1 sobre la apoptosis dependen de la presencia del IGF-1R en las células para interaccionar con el IGF-1 (Resnicoff y col., Cancer Res. 55: 3739-3741, 1995) . Una confirmación de una función anti-apoptótica del IGF-1R en el mantenimiento de las células tumorales la proporcionó también un estudio que utilizando oligonucleótidos antisentido para el IGF-1R identificó una relación cuantitativa entre los niveles de IGF-1R, la extensión de la apoptosis y el potencial tumorigénico de un tumor singénico de rata (Resnicoff y col., Cancer Res.
55: 3739-3741, 1995) . Se ha descubierto que la sobreexpresión del IGF-1R protege a las células tumorales in vitro de la apoptosis inducida por etopósido (Sell y col., Cancer Res. 55: 303-06, 1995) e, incluso más espectacularmente, que una disminución de los niveles del IGF-1R por debajo de los niveles del tipo silvestre causaba una apoptosis masiva de células tumorales in vivo (Resnicoff y col., Cancer Res. 55: 2463-69, 1995) .
Algunos estudios sugieren que los niveles de expresión del IGF-1R están correlacionados con resultados clínicos. En modelos tumorales, el IGF-1R modula la proliferación celular, la supervivencia y la metástasis e induce resistencia a terapias dirigidas. La inhibición del IGF-1R incrementa significativamente la actividad de agentes citotóxicos (Cohen, B. y col., Clin. Cancer Res. 11 (5) : 2063-73) . La inhibición de la señalización del IGF-1R se presenta como una estrategia prometedora para el desarrollo de nuevas terapias contra el cáncer.
Los tumores malignos de tejidos epiteliales son las formas de cáncer más comunes y son responsables de la mayoría de las muertes relacionadas con el cáncer. Debido a los avances en el tratamiento quirúrgico de estos tumores, la mortalidad se relaciona cada vez más con la metástasis precoz y la recurrencia, que a menudo están ocultas en el momento del diagnóstico primario (Racila y col., Proc. Nat’l. Acad. Sci. USA 95: 4589-94, 1998; Pantel y col., J. Nat’l. Cancer Inst. 91 (13) : 1113-24, 1999) . Por ejemplo, la localización anatómica distante hace que sea poco probable que en esos órganos se detecten tumores antes de haber invadido estructuras vecinas y crezcan hasta un tamaño mayor de 1 cm. Incluso con respecto a los cánceres de mama, el 12-37% de pequeños tumores de cáncer de mama (<1 cm) detectados por mamografía ya han sufrido metástasis en el momento del diagnóstico (Chadha M. y col., Cancer 73 (2) : 350-3, 1994) .
Las células tumorales circulantes (CTC) son células de origen epitelial que están presentes en la circulación de pacientes con diferentes neoplasias malignas sólidas. Derivan de clones del tumor primario y son malignas. (Véase Fehm y col., Clin. Cancer Res. 8: 2073-84, 2002) . En la bibliografía se han acumulado pruebas que muestran que las CTC, pueden considerarse como un diagnóstico independientemente de la progresión de carcinomas cancerosos (Beitsch y Clifford, Am. J. Surg. 180 (6) : 446-49, 2000 (mama) ; Feezor y col., Ann. Oncol. Surg. 9 (10) : 944-53, 2002 (colorrectal) ; Ghossein y col., Diagn. Mol. Pathol. 8 (4) : 165-75, 1999 (melanoma, próstata, tiroides) ; Glaves, Br. J. Cancer 48: 665-73, 1983 (pulmón) ; Matsunami y col., Ann. Surg. Oncol. 10 (2) : 171-5, 2003 (gástrico) ; Racila y col., 1998; Pantel y col., 1999) .
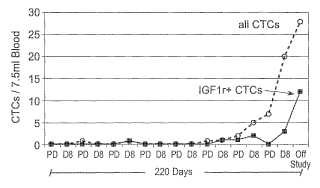
La detección y recuento de las células tumorales circulantes es importante para el cuidado de los pacientes por varias... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para predecir la eficacia de una terapia con un antagonista del IGF-1R en un paciente, que comprende las etapas de: a) preparar una muestra en la que un espécimen biológico de un paciente se mezcla con un ligando que reacciona específicamente con células tumorales, para la exclusión sustancial de otros componentes de la muestra; b) poner en contacto la muestra con al menos un reactivo que se una específicamente a las células epiteliales; c) poner en contacto la muestra con un agente que tenga afinidad de unión por receptores del factor de crecimiento insulínico (IGF-1R) sobre las células; y d) analizar la muestra para determinar la presencia de células tumorales que expresen el IGF-1R, en el que el ligando es un anticuerpo que se une específicamente a una molécula de adhesión celular epitelial sobre la célula tumoral, en el que el reactivo es un anticuerpo marcado con FITC que reconoce citoqueratinas, en el que el agente es un anticuerpo marcado con PE, y en el que la presencia de células tumorales que expresan el IGF-1R en la muestra predice la eficacia de la terapia con un antagonista del IGF-1R en el paciente.
2. El procedimiento de la reivindicación 1, que adicionalmente comprende la etapa de determinar el número de células tumorales que expresan el IGF-1R.
3. El procedimiento de la reivindicación 1, que adicionalmente comprende la etapa de añadir a la muestra un colorante celular específico que permita excluir del análisis células residuales no nucleadas y restos celulares.
4. El procedimiento de una cualquiera de las reivindicaciones 1-3, en el que las células tumorales marcadas se analizan al menos por un procedimiento seleccionado del grupo que consiste en citometría de flujo multiparamétrica, microscopía inmunofluorescente, citometría de barrido por láser, análisis de imágenes en campo claro, volumetría capilar, análisis de formación de imágenes espectrales, análisis celular manual, análisis CELLSPOTTER, y análisis celular automático.
5. El procedimiento de una cualquiera de las reclamaciones 1-3, en el que la muestra es una muestra inmunomagnética que comprende el espécimen biológico mezclado con partículas magnéticas acopladas al ligando, y adicionalmente comprende la etapa de someter la muestra inmunomagnética a un campo magnético, de tal manera que la muestra inmunomagnética se convierta en una suspensión enriquecida de células tumorales.
6. El procedimiento de la reivindicación 5, en el que las partículas magnéticas son coloidales.
7. Un procedimiento para controlar en un paciente la eficacia de una terapia con un antagonista de IGF-1R, que comprende las etapas de: a) preparar una primera muestra en la que un primer espécimen biológico de un paciente se mezcla con un ligando que reacciona específicamente con las células tumorales, para la exclusión sustancial de otros componentes de la muestra; b) poner en contacto la primera muestra con al menos un reactivo que se una específicamente a células epiteliales; c) poner en contacto la primera muestra con un agente que tenga afinidad de unión por los receptores del factor de crecimiento insulínico (IGF-1R) sobre las células; d) analizar la primera muestra para determinar la presencia y el número de células tumorales que expresan el IGF-1R; e) preparar una segunda muestra de un segundo espécimen biológico del paciente tras la administración de una terapia con un antagonista del IGF-1R, en el que el segundo espécimen biológico se mezcla con el ligando que reacciona específicamente con las células tumorales, y realizar las etapas b) - d) sobre la segunda muestra; y f) comparar el número de células tumorales que expresan el IGF-1R en la primera muestra con el número de células tumorales que expresan el IGF-1R en la segunda muestra, siendo un número inferior en la segunda muestra indicador de la eficacia de la terapia con un antagonista del IGF-1R en el paciente, en el que el ligando es un anticuerpo que se une específicamente a una molécula de adhesión celular epitelial sobre la célula tumoral, en el que el reactivo es un anticuerpo marcado con FITC que reconoce citoqueratinas, y en el que el agente es un anticuerpo marcado con PE.
8. El procedimiento de la reivindicación 7, en el que las células tumorales marcadas se analizan al menos por un proceso seleccionado del grupo que consiste en citometría de flujo multiparamétrica, microscopía inmunofluorescente, citometría de barrido por láser, análisis de imágenes en campo claro, volumetría capilar, análisis de formación de imágenes espectrales, análisis celular manual, análisis CELLSPOTTER, y análisis celular automático.
9. El procedimiento de la reivindicación 7, en el que la muestra es una muestra inmunomagnética que comprende el espécimen biológico mezclado con partículas magnéticas acopladas al ligando, y adicionalmente comprende la etapa de someter la muestra inmunomagnética a un campo magnético, de tal manera que la muestra inmunomagnética se convierta en una suspensión enriquecida de células tumorales.
10. El procedimiento de la reivindicación 9, en el que las partículas magnéticas son coloidales.
11. El procedimiento de una cualquiera de las reivindicaciones anteriores, en el que la terapia con un antagonista del IGF-1R comprende un anticuerpo anti-IGF-1R.
Patentes similares o relacionadas:
Cultivo de tejido tridimensional heterogéneamente diferenciado, del 22 de Julio de 2020, de IMBA-INSTITUT FÜR MOLEKULARE BIOTECHNOLOGIE GMBH: Un cultivo de tejido neuronal tridimensional artificial cultivado in vitro que comprende una población heterogénea de células humanas o células de primate no humanas […]
Gangliósidos para estandarizar y aumentar la sensibilidad de las células a las neurotoxinas botulínicas en los sistemas de prueba in vitro, del 15 de Julio de 2020, de MERZ PHARMA GMBH & CO. KGAA: Un método para determinar la actividad biológica de un polipéptido de neurotoxina, que comprende las etapas de: a) cultivar neuronas de diferentes […]
Procedimiento para evaluación de la función hepática y el flujo sanguíneo portal, del 15 de Julio de 2020, de The Regents of the University of Colorado, a body corporate: Procedimiento in vitro para la estimación del flujo sanguíneo portal en un individuo a partir de una única muestra de sangre o suero, comprendiendo el procedimiento: […]
ANTICUERPO MONOCLONAL O UNA PORCIÓN DE UNIÓN A ANTÍGENO DEL MISMO QUE SE UNE A LA PROTEÍNA L DEL VIRUS PARAINFLUENZA HUMANO (PIV); MÉTODO Y KIT PARA DETECTAR AL VIRUS PIV, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína L del virus parainfluenza humano (PIV), donde dichos […]
ANTICUERPOS MONOCLONALES ESPECÍFICOS PARA EL ANTÍGENO PB2 DEL VIRUS DE LA INFLUENZA HUMANA (FLU), SECUENCIAS NUCLEOTÍDICAS; MÉTODO Y KIT DE DIAGNÓSTICO DE INFECCIÓN PRODUCIDA POR FLU, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína PB2 del virus de la influenza humana (Flu), […]
Diagnóstico y terapia de cáncer que implica células madre cancerosas, del 24 de Junio de 2020, de BioNTech SE: Un anticuerpo que tiene la capacidad de unirse a Claudina 6 (CLDN6) para usar en un método de tratamiento o prevención del cáncer que comprende inhibir y/o eliminar […]
Nueva inmunoterapia contra diversos tumores como el cáncer gastrointestinal y gástrico, del 24 de Junio de 2020, de IMMATICS BIOTECHNOLOGIES GMBH: Péptido seleccionado del grupo siguiente: a) péptido consistente en la secuencia conforme a la SEQ ID N.º 86, b) el péptido conforme a a), en la […]
Reactivos SIRP-alfa de alta afinidad, del 24 de Junio de 2020, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Un polipéptido SIRPα de alta afinidad que comprende al menos una y no más de 15 modificaciones de aminoácidos dentro del dominio d1 de una secuencia SIRPα de tipo […]