Anticuerpos monoclonales que se unen a HGM-CSF y composiciones medicinales que los comprenden.
Un anticuerpo monoclonal anti-hGM-CSF aislado o su fragmento de unión a antígeno,
donde dicho anticuerpo o fragmento de unión a antígeno comprende:
(a) una cadena pesada que comprende una secuencia que contiene VH-CDR1, una secuencia que contiene VH-CDR2 y una secuencia que contiene VH-CDR3, en donde:
(i) la secuencia que contiene VH-CDR1 es SYGMH (SEQ ID NO: 4),
(ii) la secuencia que contiene VH-CDR2 es LTYHHGNRKFYADSVRG (SEQ ID NO: 5), y
(iii) la secuencia que contiene VH-CDR3 es ESMGAINDN (SEQ ID NO: 6); y
(b) una cadena liviana que comprende una secuencia que contiene VL-CDR1, una secuencia que contiene VL-CDR2 y una secuencia que contiene VL-CDR3, en donde:
(i) la secuencia que contiene VL-CDR1 es IGNNNNIGSHAVG (SEQ ID NO: 7),
(ii) la secuencia que contiene VL-CDR2 es GRSPPS (SEQ ID NO: 8), y
(iii) la secuencia que contiene VL-CDR3 es STWDSSLSAVV (SEQ ID NO: 9).
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/012680.
Solicitante: EVEC INC.
Nacionalidad solicitante: Japón.
Dirección: SHOWA BUILDING ODORI W5 CHUO-KU SAPPORO 060-0042 JAPON.
Inventor/es: PARK, JOHN, DR., TAKADA,KENZO, NAKAJIMA,KANTOU, KISTLER,BARBARA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61P11/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de trastornos del aparato respiratorio.
- A61P17/06 A61P […] › A61P 17/00 Medicamentos para el tratamiento de problemas dermatológicos. › para el tratamiento de la psoriasis.
- A61P19/02 A61P […] › A61P 19/00 Medicamentos para el tratamiento de problemas del esqueleto. › para problemas de las articulaciones, p.ej. artritis, artrosis.
- A61P35/02 A61P […] › A61P 35/00 Agentes antineoplásicos. › específicos para la leucemia.
- C07K16/24 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra citoquinas, linfoquinas o interferones.
PDF original: ES-2401536_T3.pdf
Fragmento de la descripción:
Anticuerpos monoclonales que se unen a HGM-CSF y composiciones medicinales que los comprenden.
Campo de la invención
La presente invención se refiere a anticuerpos monoclonales que se unen al factor estimulante de colonias de granulocitos-macrófagos humanos (también mencionado como “hGM-CSF”) y neutralizan la actividad de hGM-CSF, a composiciones que incluyen uno o varios de tales anticuerpos monoclonales y a métodos en los que se usan estos anticuerpos monoclonales y composiciones.
Antecedentes de la invención El factor estimulante de colonias de granulocitos-macrófagos (GM-CSF) se identificó en un factor humoral que promueve la proliferación de las células progenitoras de granulocitos y macrófagos de la médula ósea y promueve la formación de colonias de granulocitos y macrófagos in vitro.
Ahora se sabe que GM-CSF es un factor estimulante para un amplio rango de tipos celulares. Induce la diferenciación y la proliferación de glóbulos de linaje de granulocitos-macrófagos, aumenta las funciones de células que presentan antígenos, mantiene las funciones de algunos tipos de células epiteliales e induce las funciones de los macrófagos alveolares (por ejemplo, mejora el catabolismo de los tensioactivos, la función bactericida y la expresión del receptor Fc) . The Cytokine Handbook, 4th edition, Thomson, A. et al. (eds.) , Academic Press, 2003.
Se sabe que GM-CSF causa diversas enfermedades, incluyendo 1) enfermedades alérgicas tales como asma, atopía y polinosis, 2) rechazo al injerto y enfermedad de injerto versus huésped (GVHD) y 3) enfermedades autoinmunes, tal como artritis reumatoidea.
Por ejemplo, el GM-CSF humano (hGM-CSF) se sobreexpresa en los pulmones de sujetos alérgicos y en las articulaciones de pacientes con artritis reumatoidea; el mARN de hGM-CSF se sobreexpresa en la piel de sujetos alérgicos. También se informó que la supervivencia de los monocitos, que son células que inducen inflamación en dermatitis atópica, es mejorada por la producción de GM-CSF. Bratton, D.L. et al., Granulocite macrophages colonystimulating factor contributes to enhanced monocyte survival in chronic atopic dermatitis. J. Clin. Invest., 95: 211-218, 1995.
Además, se mostró que el GM-CSF estimula la proliferación de células leucémicas. Por ende, se considera que el GM-CSF es un factor que causa leucemia.
Sería de utilidad tener enfoques para tratar enfermedades y patologías causadas por el GM-CSF humano. Un enfoque para la terapia de estas enfermedades y condiciones patológicas consiste en unir el hGM-CSF e inhibir su actividad biológica. Esto se puede realizar, por ejemplo, administrando anticuerpos monoclonales anti-hGM-CSF que tienen gran afinidad y suficiente actividad neutralizante contra hGM-CSF pero no inducen una reacción inmunológica.
Sin embargo, los anticuerpos inhibidores de hGM-CSF informaron hasta ahora que no tienen suficiente actividad neutralizante contra hGM-CSF. Además, parece muy probable que los anticuerpos monoclonales de anti-hGM-CSF disponibles en la actualidad induzcan una respuesta inmune no deseada en los receptores. El anticuerpo policlonal y el anticuerpo monoclonal se derivan, en general, de animales experimentales, tales como ratones, conejos y caprinos. Sin embargo, los anticuerpos obtenidos tienen una secuencia característica del tipo de animales usados para su producción. Si se administran a seres humanos, el sistema inmune humano puede reconocer los anticuerpos como extraños y entonces, se puede causar la respuesta del anticuerpo humano antianimal (es decir, el anticuerpo produce su propio anticuerpo) .
Además, la administración a largo plazo es necesaria para el tratamiento de estas enfermedades y pueden surgir problemas como un resultado, como problemas de seguridad que pueden ser causados por pequeñas cantidades de impurezas en medicinas administradas. Los anticuerpos con mayor actividad neutralizante que los disponibles actualmente serán valiosos como agentes terapéuticos desde el punto de vista de la efectividad, la seguridad y el gasto médico.
Síntesis de la invención
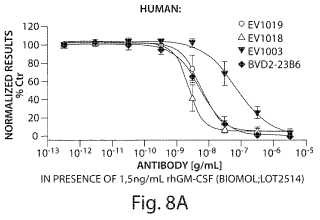
La invención se basa al menos en parte en el desarrollo de los inventores de determinados anticuerpos monoclonales antihumanos GM-CSF que se caracterizan por su actividad neutralizante extremadamente alta hacia el hGM-CSF. Sorprendentemente, la actividad neutralizante de estos anticuerpos es mayor que lo que se podría esperar en base a sus afinidades de unión por hGM-CSF. Dos de estos anticuerpos monoclonales anti-hGM-CSF se mencionan en la presente como EV1018 (de la invención) y EV1019 (como referencia) .
En un aspecto, la invención proporciona anticuerpos anti-hGM-CSF y sus fragmentos que se nen y neutralizan hGM-CSF.
En una forma de realización, se proporciona un anticuerpo monoclonal anti-hGM-CSF aislado o su fragmento de unión a antígeno, en donde el anticuerpo o su fragmento de unión a antígeno reconoce ELYK (SEQ ID NO: 2) y TMMASHYKQH (SEQ ID NO: 3) en hGM-CSF, cuya secuencia de aminoácidos es como se establece en la SEQ ID NO: 1. En una forma de realización, la invención es un anticuerpo monoclonal anti-hGM-CSF aislado o su fragmento de unión a antígeno, donde dicho anticuerpo o fragmento de unión a antígeno comprende:
(a) una cadena pesada que comprende una secuencia que contiene VH-CDR1, una secuencia que contiene VH-CDR2 y una secuencia que contiene VH-CDR3, en donde:
(i) la secuencia que contiene VH-CDR1 es SYGMH (SEQ ID NO: 4) ,
(ii) la secuencia que contiene VH-CDR2 es LTYHHGNRKFYADSVRG (SEQ ID NO: 5) , y
(iii) la secuencia que contiene VH-CDR3 es ESMGAINDN (SEQ ID NO: 6) ; y
(b) una cadena liviana que comprende una secuencia que contiene VL-CDR1, una secuencia que contiene VL-CDR2 y una secuencia que contiene VL-CDR3, en donde:
(i) la secuencia que contiene VL-CDRI es IGNNNNIGSHAVG (SEQ ID NO: 7) ,
(ii) la secuencia que contiene VL-CDR2 es GRSPPS (SEQ ID NO: 8) , y
(iii) la secuencia que contiene VL-CDR3 es STWDSSLSAVV (SEQ ID NO: 9) . En un aspecto de referencia, el anticuerpo comprende:
(a) una cadena pesada que comprende una secuencia consenso que contiene VH-CDR1, una secuencia consenso que contiene VH-CDR2 y una secuencia consenso que contiene VH-CDR3, en donde:
(i) la secuencia consenso que contiene VH-CDR1 es FTFSX1X2NM (SEQ ID NO: 314) , en donde X1 es Y o H y X2 es G o A,
(ii) la secuencia consenso que contiene VH-CDR2 es X3X4X5HXnGXnX6KX7YADSVX8G (SEQ ID NO: 315) , en donde cada Xn es, de modo independiente, cualquier aminoácido natural, X3 es L o V, X4 es T o I, X5 es Y o W, X6 es R o K, X7 es F o Y y X8 es R o K, y
(iii) la secuencia consenso que contiene VH-CDR3 es EXnX9GX10XnXnDXn (SEQ ID NO: 316) , en donde cada Xn es, de modo independiente, cualquier aminoácido natural, X9 es M o V y X10 es A o G; y
(b) una cadena liviana que comprende una secuencia consenso que contiene VL-CDR1, una secuencia consenso que contiene VL-CDR2 y una secuencia consenso que contiene VL-CDR3, en donde:
(i) la secuencia consenso que contiene VL-CDR1 es XnGNXnXnNIGSX11AVG (SEQ ID NO: 317) , en donde cada Xn es, de modo independiente, cualquier aminoácido natural y X11 es H o Y,
(ii) la secuencia consenso que contiene VL-CDR2 es GX12SPX13SG (SEQ ID NO: 318) , en donde X12 es R o K y X13 es A o P, y
(iii) la secuencia consenso que contiene VL-CDR3 es STWDSX14LSAVX15 (SEQ ID NO: 319) , en donde X14 es R
(a) una cadena pesada que comprende VH-CDR1, VH-CDR2 y VH-CDR3, en donde:
(i) VH-CDR1 tiene una secuencia de aminoácidos de SHAMH (SEQ ID NO: 333) ,
(ii) VH-CDR2 tiene una secuencia de aminoácidos de VIWHDGSKXYYADSVKG (SEQ ID NO: 334) , y
(iii) VH-CDR3 tiene una secuencia de aminoácidos de EWVGGTCDS (SEQ ID NO: 335) ; y
(b) una cadena liviana que comprende VL-CDR1, VL-CDR2 y VL-CDR3, en donde:
(i) VL-CDR1 tiene una secuencia de aminoácidos de SGNSSNIGSYAVG (SEQ ID NO: 330) ,
(ii) VL-CDR2 tiene una secuencia de aminoácidos de GKSPAS (SEQ ID NO: 331) , y
(iii) VL-CDR3 tiene una secuencia de aminoácidos de STWDSRLSAVL (SEQ ID NO: 332) y el anticuerpo o su fragmento de unión a antígeno une específicamente hGM-CSF.
Por ejemplo, el anticuerpo o su fragmento de unión a antígeno descrito con anterioridad se une con el GM-CSF humano con una KD de menos de 400 pM, con mayor preferencia, con una KD de menos de 160 pM.
El anticuerpo o su fragmento de unión a antígeno descrito en la... [Seguir leyendo]
Reivindicaciones:
1. Un anticuerpo monoclonal anti-hGM-CSF aislado o su fragmento de unión a antígeno, donde dicho anticuerpo o fragmento de unión a antígeno comprende:
(a) una cadena pesada que comprende una secuencia que contiene VH-CDR1, una secuencia que contiene VH-CDR2 y una secuencia que contiene VH-CDR3, en donde:
(i) la secuencia que contiene VH-CDR1 es SYGMH (SEQ ID NO: 4) ,
(ii) la secuencia que contiene VH-CDR2 es LTYHHGNRKFYADSVRG (SEQ ID NO: 5) , y
(iii) la secuencia que contiene VH-CDR3 es ESMGAINDN (SEQ ID NO: 6) ; y
(b) una cadena liviana que comprende una secuencia que contiene VL-CDR1, una secuencia que contiene VL-CDR2 y una secuencia que contiene VL-CDR3, en donde:
(i) la secuencia que contiene VL-CDR1 es IGNNNNIGSHAVG (SEQ ID NO: 7) ,
(ii) la secuencia que contiene VL-CDR2 es GRSPPS (SEQ ID NO: 8) , y
(iii) la secuencia que contiene VL-CDR3 es STWDSSLSAVV (SEQ ID NO: 9) .
2. El anticuerpo o su fragmento de unión a antígeno de acuerdo con la reivindicación 1, en donde el anticuerpo o su fragmento de unión a antígeno se une con GM-CSF humano con una KD de menos de 400 pM.
3. El anticuerpo o su fragmento de unión a antígeno de acuerdo con la reivindicación 2, en donde el anticuerpo o su fragmento de unión a antígeno neutraliza la actividad de hGM-CSF, de modo tal que el anticuerpo o su fragmento de unión a antígeno tenga un valor de IC50 de menos de 100 pM tal como se determina en un ensayo de proliferación de TF-1 en ED80.
4. El anticuerpo o su fragmento de unión a antígeno de acuerdo con la reivindicación 1 ó 2, en donde la cadena pesada
está seleccionada del grupo que consiste en gamma 1 (γ1) , gamma 2 (γ2) , gamma 3 (γ3) y gamma 4 (γ4) .
5. El anticuerpo o su fragmento de unión a antígeno de acuerdo con la reivindicación 4, en donde la cadena pesada es gamma 1 (γ1) .
6. El anticuerpo o su fragmento de unión a antígeno de acuerdo con la reivindicación 4 ó 5, en donde la cadena liviana es una cadena liviana lambda.
7. El anticuerpo o su fragmento de unión a antígeno de acuerdo con cualquiera de las reivindicaciones 1-6, en donde la cadena pesada tiene una secuencia de aminoácidos de SEQ ID NO:46 o de SEQ ID NO: 51.
8. El anticuerpo o fragmento de unión a antígeno de acuerdo con la reivindicación 7, en donde la cadena pesada tiene una secuencia de aminoácidos de SEQ ID NO: 51.
9. El anticuerpo o su fragmento de unión a antígeno de acuerdo con cualquiera de las reivindicaciones 1-8, en donde la cadena liviana tiene una secuencia de aminoácidos de SEQ ID NO: 36.
10. El anticuerpo o su fragmento de unión a antígeno, de acuerdo con las reivindicaciones 1 a 6, en donde la secuencia de la región de cadena pesada variable es SEQ ID NO: 348 o es SEQ ID NO: 361 y en donde la secuencia de la región de cadena liviana variable es SEQ ID NO: 365.
11. El anticuerpo o fragmento de unión a antígeno de acuerdo con la reivindicación 10, en donde la secuencia de la región de cadena pesada variable es SEQ ID NO: 361.
12. El anticuerpo o su fragmento de unión a antígeno, de acuerdo con cualquiera de las reivindicaciones 1 a 6, en donde la secuencia de cadena pesada es SEQ ID NO: 46 o es SEQ ID NO: 51 y en donde la secuencia de cadena liviana es SEQ ID NO: 36.
13. El anticuerpo o su fragmento de unión a antígeno, de acuerdo con la reivindicación 12, en donde la secuencia de cadena pesada es SEQ ID NO: 51.
14. Una composición farmacéutica que comprende el anticuerpo o su fragmento de unión a antígeno de acuerdo con cualquiera de las reivindicaciones 1 a 13 y un portador farmacéuticamente aceptable.
15. Un kit que comprende: (a) el anticuerpo o su fragmento de unión a antígeno de acuerdo con cualquiera de las reivindicaciones 1 a 13 y (b) uno o varios recipientes que contienen el anticuerpo o su fragmento de unión a antígeno.
16. Un ácido nucleico aislado que codifica el anticuerpo monoclonal anti-hGM-CSF o su fragmento de unión a antígeno de acuerdo con cualquiera de las reivindicaciones 1 a 13.
17. El ácido nucleico aislado de acuerdo con la reivindicación 16, en donde el ácido nucleico es un ADN.
18. Un vector que comprende el ADN de acuerdo con la reivindicación 17.
19. Una célula huésped que comprende el vector de acuerdo con la reivindicación 18, en donde el vector es un vector de expresión.
20. El anticuerpo o su fragmento de unión a antígeno de acuerdo con cualquiera de las reivindicaciones 1 a 13 o la composición farmacéutica de acuerdo con la reivindicación 14 para usar como un medicamento.
21. El anticuerpo o su fragmento de unión a antígeno de acuerdo con cualquiera de las reivindicaciones 1 a 13 o la composición farmacéutica de acuerdo con la reivindicación 14 para usar en el tratamiento de una enfermedad o trastorno asociados con sobreexpresión de hGM-CSF en un sujeto.
22. El anticuerpo o su fragmento de unión a antígeno de acuerdo con la reivindicación 21, en donde el anticuerpo o fragmento de unión a antígeno se administra al sujeto en una dosis que no excede 500 mg.
23. El anticuerpo o su fragmento de unión a antígeno de acuerdo con la reivindicación 21 ó 22, en donde la enfermedad
o trastorno está seleccionada del grupo que consiste en enfermedad pulmonar obstructiva crónica (EPOC) , asma, asma bronquial, asma pediátrica, asma severa, ataques agudos de asma, fibrosis quística, enfermedad pulmonar intersticial, rinitis, artritis y artropatías relacionadas, artritis reumatoidea, psoriasis, leucemia mieloide y esclerosis múltiple.
24. Un método para producir un anticuerpo monoclonal anti-hGM-CSF de acuerdo con la reivindicación 1 o su fragmento de unión a antígeno de acuerdo con la reivindicación 1 que se une con hGM-CSF, en donde el anticuerpo o su fragmento de unión a antígeno comprende al menos una secuencia que contiene VH-CDR1, una secuencia que contiene VH-CDR2, una secuencia que contiene VH-CDR3, una secuencia que contiene VL-CDR1, una secuencia que contiene VL-CDR2 y una secuencia que contiene VL-CDR3, en una célula huésped, que comprende:
(i) obtener la célula huésped que comprende al menos una secuencia de ADN que codifica al menos la secuencia que contiene VH-CDR1, la secuencia que contiene VH-CDR2, la secuencia que contiene VH-CDR3, la secuencia que contiene VL-CDR1, la secuencia que contiene VL-CDR2 y la secuencia que contiene VL-CDR3, en donde:
(a) la secuencia que contiene VH-CDR1 es SYGMH (SEQ ID NO: 4) ,
(b) la secuencia que contiene VH-CDR2 es LTYHHGNRKFYADSVRG (SEQ ID NO: 5) ,
(c) la secuencia que contiene VH-CDR3 es ESMGAINDN (SEQ ID NO: 6) ,
(d) la secuencia que contiene VL-CDR1 es IGNNNNIGSHAVG (SEQ ID NO: 7) ,
(e) la secuencia que contiene VL-CDR2 es GRSPPS (SEQ ID NO: 8) , y
(f) la secuencia que contiene VL-CDR3 es STWDSSLSAVV (SEQ ID NO: 9) ; y
(ii) cultivar la célula huésped en condiciones apropiadas para la expresión de ADN y producción del anticuerpo o su fragmento de unión a antígeno.
Patentes similares o relacionadas:
Derivados de benzoxazinona para el tratamiento de enfermedades cutáneas, del 29 de Julio de 2020, de Sixera Pharma AB: Un compuesto según la Fórmula I **(Ver fórmula)** en donde R es -S-CH3 o -Cl, o una sal farmacéuticamente aceptable del mismo.
Composiciones farmacéuticas para uso tópico basadas en ácido hialurónico sulfatado como promotor de absorción de la piel, del 1 de Julio de 2020, de FIDIA FARMACEUTICI S.P.A.: Una composición farmacéutica para uso tópico que contiene ácido hialurónico sulfatado como promotor de absorción de la piel de diclofenaco, ketoprofeno, ibuprofeno […]
Composiciones tópicas que comprenden un corticosteroide y un retinoide para tratar la psoriasis, del 1 de Julio de 2020, de Bausch Health Ireland Limited: Una composición farmacéutica tópica para usar en el tratamiento de la psoriasis, la composición que comprende: (a) propionato de halobetasol […]
Derivado de amina cíclica y uso farmacéutico del mismo, del 1 de Julio de 2020, de TORAY INDUSTRIES, INC.: Un derivado de amina cíclica representado por la siguiente fórmula general (I): **(Ver fórmula)** donde R1 representa un grupo alquiloxi que tiene de 1 a 3 átomos […]
Sales de butirato para uso en enfermedades inflamatorias, del 17 de Junio de 2020, de Birrbeheer B.V: Una preparación que comprende una sal de butirato para uso en el tratamiento de un sujeto que padece una enfermedad que está asociada con inflamación sistémica, […]
Amidas heterocíclicas como inhibidores de quinasa, del 3 de Junio de 2020, de GlaxoSmithKline Intellectual Property Development Limited: Un compuesto que es **(Ver fórmula)** o un tautómero del mismo o una sal del mismo.
Composición farmacéutica tópica a base de alcanos semifluorados, del 13 de Mayo de 2020, de NOVALIQ GMBH: Una composición farmacéutica tópica para usar en la prevención o el tratamiento de una enfermedad o afección que afecta la piel o un apéndice de la piel, que comprende […]
Purina dionas como moduladores de la ruta de Wnt, del 29 de Abril de 2020, de AGENCY FOR SCIENCE, TECHNOLOGY AND RESEARCH: Un compuesto que tiene la estructura (I) **(Ver fórmula)** o una sal del mismo; en el que: R1, R2, R3, R4 y R5 son cada uno, independientemente, […]