OLIGONUCLEÓTIDOS INMUNOESTIMULADORES DE CLASE C SEMIBLANDOS.
Un oligonucleótido que comprende: 5' TC GTC GTN1TC GGCGCN1GCCG 3' (SEC IO Nº :
27) , incluyendo el oligonucleótido al menos dos enlaces internucleotídicos estabilizados y representando enlace internucleotídico fosfodiéster o de tipo fosfodiéster y en el que
a) N1 es de 0 nucleótidos de longitud, refiriéndose N a cualquier nucleótido;
b) N1 es de 3 nucleótidos de longitud, refiriéndose N a cualquier nucleótido;
c) el oligonucleótido comprende 5' T*C G*T*C G*T*C G*T*T*C G*G*C*G*C G*C*G*C*C*G 3' (SEC IO Nº : 2) , en la que * representa un enlace internucleotídico estabilizado, 5' se refiere al extremo 5' libre del oligonucleótido y 3' se refiere al extremo 3' libre del oligonucleótido; o d) el oligonucleótido comprende 5' T*C G*T*C G*T*T*C G*G*C*G*C*G*C*C*G 3' (SEC IO Nº : 3) , en la que * representa un enlace internucleotídico estabilizado, 5' se refiere al extremo 5' libre del oligonucleótido y 3' se refiere al extremo 3' libre del oligonucleótido.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/037731.
Solicitante: COLEY PHARMACEUTICAL GROUP, INC.
COLEY PHARMACEUTICAL GMBH.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 235 EAST YORK NEW YORK 10017-5755 ESTADOS UNIDOS DE AMERICA.
Inventor/es: KRIEG, ARTHUR, M., UHLMANN, EUGEN, DR., VOLLMER,JORG, SAMULOWITZ,Ulrike.
Fecha de Publicación: .
Fecha Solicitud PCT: 20 de Octubre de 2005.
Clasificación PCT:
- C12N15/11 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Fragmentos de ADN o de ARN; sus formas modificadas (ADN o ARN no empleado en tecnología de recombinación C07H 21/00).
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2375071_T3.pdf
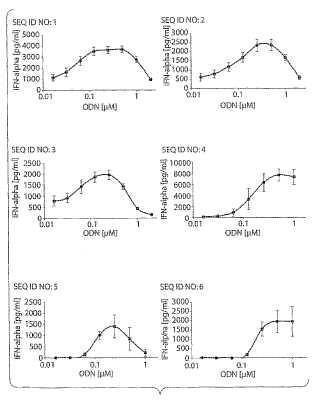
Fragmento de la descripción:
Oligonucleótidos inmunoestimuladores de clase C semiblandos
Campo de la invención
La presente invención se refiere, en general, a oligonucleótidos inmunoestimuladores con efectos inflamatorios renales reducidos, a composiciones de los mismos y a métodos de uso de los oligonucleótidos inmunoestimuladores. En particular, los oligonucleótidos inmunoestimuladores son oligonucleótidos semiblandos de clase C que son particularmente eficaces en el tratamiento de alergias y del asma, cáncer y enfermedades infecciosas.
Antecedentes de la invención
El AON bacteriano tiene efectos inmunoestimuladores para activar las células B y las células destructoras naturales, pero el AON de los vertebrados no tiene estos efectos (Tokunaga, T., et al., 1988, Jpn. J. Cancer Res. 79:682-686; Tokunaga, T., et al., 1984, JNC/ 72:955-962; Messina, J.P., et al., 1991, J. /mmunol. 147:1759-1764; y revisado en Krieg, 1998, En: Applied Oligonucleotide Technology, C.A. Stein y A.M. Krieg, (Eds.) , John Wiley and Sons, Inc., Nueva York, NY, páginas 431-448) . Ahora se entiende que estos efectos inmunoestimuladores del AON
bacteriano son el resultado de la presencia de dinucleótidos CpG no metilados, en contextos de bases particulares (motivos CpG) , que son comunes en el AON bacteriano, pero están metilados e infra-representados en el AON de los vertebrados (Krieg et al., 1995 Nature 374:546-549; Krieg, 1999 Biochim. Biophys. Acta 93321:1-10) . Los efectos inmunoestimuladores del AON bacteriano pueden imitarse con oligodesoxinucleótidos (OON) sintéticos que contienen estos motivos CpG. Tales OON CpG tienen efectos muy estimuladores sobre leucocitos humanos y murinos, induciendo la proliferación de células B; la secreción de citoquinas y de inmunoglobulinas; la actividad lítica de las células destructoras naturales (NK) y la secreción de IFN-γ; y la activación de células dendríticas (OC) y otras células presentadoras de antígenos para expresar moléculas coestimuladoras y secretar citoquinas, especialmente las citoquinas de tipo Th1 que son importantes para promover el desarrollo de respuestas de células T de tipo Th1. Estos efectos inmunoestimuladores de OON CpG de esqueleto fosfodiéster nativos son muy específicos de CpG, ya que los efectos se reducen espectacularmente si el motivo CpG está metilado, se ha cambiado a GpC o se ha eliminado o alterado de otra manera (Krieg et al, 1995 Nature 374:546-549; Hartmann et al, 1999 Proc. Natl. Acad. Sci, Estados Unidos 96:9305-10) .
En los primeros estudios, se pensaba que el motivo CpG inmunoestimulador seguía la fórmula purina-purina-CpGpirimidina-pirimidina (Krieg et al, 1995 Nature 374:546-549; Pisetsky, 1996 J. Immunol. 156:421-423; Hacker et al., 1998 EMBO J. 17:6230-6240; Lipford et al, 1998 Trends in Microbiol. 6:496-500) . Sin embargo, ahora está claro que los linfocitos de ratón responden bastante bien a los motivos CpG fosfodiéster que no siguen esta "fórmula" (Yi et al., 1998 J. Immunol. 160:5898-5906) y lo mismo ocurre en células B humanas y células dendríticas (Hartmann et al, 1999 Proc. Natl. Acad. Sci Estados Unidos 96:9305-10; Liang, 1996 J. Clin. Invest. 98:1119-1129) .
Recientemente se han descrito varias clases diferentes de oligonucleótidos CpG. Una clase es potente para activar las células B pero es relativamente débil para inducir IFN-α y la activación de células NK; esta clase se ha denominado clase B. Los oligonucleótidos CpG de clase B típicamente están totalmente estabilizados e incluyen un dinucleótido CpG no metilado dentro de ciertos contextos de bases preferidos. Véanse, por ejemplo, las Patente de Estados Unidos Nº 6.194.388; 6.207.646; 6.214.806; 6.218.371; 6.239.116; y 6.339.068. Otra clase de oligonucleótidos CpG activa las células B y las células NK e induce IFN-α. Esta clase se ha denominado la clase C. Los oligonucleótidos CpG de clase C, como se caracterizaron en primer lugar, típicamente están totalmente estabilizados, incluyen una secuencia de tipo de clase B y un palíndromo o casi un palíndromo rico en CG. Esta clase se ha descrito en la solicitud de patente de Estados Unidos en trámite junto con la presente US10/224.523 presentada el 19 de agosto de 2002, y en la Solicitud de Patente PCT relacionada PCT/US02/26468 publicada con el Número de Publicación Internacional WO 03/015711.
45 Compendio de la invención
Se ha descubierto que las propiedades inmunoestimuladoras de ciertos oligonucleótidos CpG de clase C específicos con la inclusión selectiva de uno o más enlaces no estabilizados entre ciertos nucleótidos tienen actividad significativa y son particularmente útiles en el tratamiento de alergias y del asma. Los enlaces no estabilizados preferiblemente son enlaces naturales, es decir, enlaces fosfodiéster o enlaces de tipo fosfodiéster. 50 Un enlace no estabilizado típicamente, pero no necesariamente, será relativamente susceptible a digestión por nucleasas. Los oligonucleótidos inmunoestimuladores de la presente invención incluyen al menos un enlace no estabilizado situado entre una C 5' y una G 3' adyacente, donde tanto la C 5' como la G 3' son nucleótidos internos.
Los oligonucleótidos inmunoestimuladores de la presente invención son útiles para inducir una respuesta inmune de tipo Th1. Por consiguiente, los oligonucleótidos inmunoestimuladores de la presente invención son útiles como adyuvantes para vacunación y son útiles para tratar enfermedades incluyendo cánceres, enfermedades infecciosas, alergia y asma. Se cree que tienen una utilidad particular en cualquier estado que requiera la administración prolongada o repetida de oligonucleótidos inmunoestimuladores para cualquier fin, pero son particularmente útiles en el tratamiento del asma y de enfermedades alérgicas tales como la rinitis alérgica.
La presente invención se refiere, en parte, a oligonucleótidos inmunoestimuladores que contienen CpG. En un primer aspecto, la invención se refiere a un oligonucleótido que tienen la fórmula: 5' TC GX1C G X2N1 X3C GN2CG 3' (SEC IO Nº : 26) . El oligonucleótido incluye al menos 2 enlaces internucleotídicos estabilizados. " " representa un enlace internucleotídico fosfodiéster o de tipo fosfodiéster. N1 tiene una longitud de 0-3 nucleótidos, N2 tiene una longitud de 0-9 nucleótidos, haciendo referencia N a cualquier nucleótido. X1, X2 y X3 son cualquier nucleótido. En algunas realizaciones, X1, X2 y X3 son T.
Específicamente, en un primer aspecto, la presente invención proporciona un oligonucleótido que comprende: 5' TC GTC GTN1TC GGCGCN1GCCG 3' (SEC IO Nº : 27) . En una realización, el oligonucleótido puede comprender 5' T*C G*T*C G*T*N1*T*C G*G*C*G*CN1G*C*C*G 3' (SEC IO Nº : 27) , en la que el oligonucleótido incluye al menos 2 enlaces internucleotídicos estabilizados y representa un enlace internucleotídico fosfodiéster o de tipo fosfodiéster y en la que:
a) N1 es de 0 nucleótidos de longitud, refiriéndose N a cualquier nucleótido b) N1 es de 3 nucleótidos de longitud, refiriéndose N a cualquier nucleótido c) El oligonucleótido comprende 5' T*C G*T*C G*T*C G*T*T*C G*G*C*G*C G*C*G*C*C*G 3' (SEC IO Nº : 2) , en la que * representa un enlace internucleotídico estabilizado, 5' se refiere al extremo 5' libre del oligonucleótido y 3' se refiere al extremo 3' libre del oligonucleótido; o d) El oligonucleótido comprende T*C G*T*C G*T*T*C G*G*C*G*C*G*C*C*G 3' (SEC IO Nº : 3) , en la que * representa un enlace internucleotídico estabilizado, 5' se refiere al extremo 5' libre del oligonucleótido y 3' se refiere al extremo 3' libre del oligonucleótido.
En un segundo aspecto, la invención proporciona un oligonucleótido que comprende:
25 TCGTCGTCGTTCGGCGCGCGCCG (SEC IO Nº : 2) .
En un tercer aspecto de la invención, se proporciona un oligonucleótido que comprende:
T*C G*T*C G*T*C, en la que * representa un enlace internucleotídico estabilizado y representa un enlace internucleotídico fosfodiéster o de tipo fosfodiéster, siendo el oligonucleótido 5' T*C-G*T*C-G*T*C-G*T*T*CG*G*C*G*C-G*C*G*C*C 3' (SEC IO Nº : 21) , 5' T*C-G*T*C-G*T*C-G*T*T*C-G*G*C*G*C 3' (SEC IO Nº : 22) , o
30 5' T*C-G*T*C-G*T*C-G*T*T*C-G*G*C*G*C-G*C*G*C 3' (SEC IO Nº : 23) , donde 5' se refiere al extremo 5' libre del oligonucleótido y 3' se refiere al extremo 3' libre del oligonucleótido.
En un cuarto aspecto, se proporciona un oligonucleótido que comprende: T*C G*T*T*C G*G, donde * representa un enlace internucleotídico estabilizado y representa un enlace internucleotídico fosfodiéster o de tipo fosfodiéster, siendo el oligonucleótido... [Seguir leyendo]
Reivindicaciones:
1. Un oligonucleótido que comprende: 5' TC GTC GTN1TC GGCGCN1GCCG 3' (SEC IO Nº : 27) , incluyendo el oligonucleótido al menos dos enlaces internucleotídicos estabilizados y representando enlace internucleotídico fosfodiéster o de tipo fosfodiéster y en el que a) N1 es de 0 nucleótidos de longitud, refiriéndose N a cualquier nucleótido;
b) N1 es de 3 nucleótidos de longitud, refiriéndose N a cualquier nucleótido;
c) el oligonucleótido comprende 5' T*C G*T*C G*T*C G*T*T*C G*G*C*G*C G*C*G*C*C*G 3' (SEC IO Nº : 2) , en la que * representa un enlace internucleotídico estabilizado, 5' se refiere al extremo 5' libre del oligonucleótido y 3' se refiere al extremo 3' libre del oligonucleótido; o d) el oligonucleótido comprende 5' T*C G*T*C G*T*T*C G*G*C*G*C*G*C*C*G 3' (SEC IO Nº : 3) , en la que * representa un enlace internucleotídico estabilizado, 5' se refiere al extremo 5' libre del oligonucleótido y 3' se refiere al extremo 3' libre del oligonucleótido.
2. Un oligonucleótido que comprende: TCGTCGTCGTTCGGCGCGCGCCG (SEC IO Nº : 2) .
3. Un oligonucleótido que comprende: T*C G*T*C G*T*C, en la que * representa un enlace internucleotídico estabilizado y representa enlace internucleotídico fosfodiéster o de tipo fosfodiéster y siendo el oligonucleótido: a) 5' T*C G*T*C G*T*C G*T*T*C G*G*C*G*C G*C*G*C*C 3' (SEC IO Nº : 21) ; b) 5' T*C G*T*C G*T*C G*T*T*C G*G*C*G*C 3' (SEC IO Nº : 22) ; o
c) 5' T*C G*T*C G*T*C G*T*T*C G*G*C*G*C G*C*G*C 3' (SEC IO Nº : 23) ; en la que 5' se refiere al extremo 5' libre del oligonucleótido y 3' se refiere al extremo 3' libre del oligonucleótido.
4. Un oligonucleótido que comprende: T*C G*T*T*C G*G, en la que * representa un enlace internucleotídico estabilizado y representa enlace internucleotídico fosfodiéster o de tipo fosfodiéster y siendo el oligonucleótido: a) 5' C G*T*C G*T*C G*T*T*C G*G*C*G*C G*C*G*C*C*G 3' (SEC IO Nº : 15) ; b) 5' G*T*C G*T*C G*T*T*C G*G*C*G*C G*C*G*C*C*G 3' (SEC IO Nº : 16) ; c) 5' T*C G*T*C G*T*T*C G*G*C*G*C G*C*G*C*C*G 3' (SEC IO Nº : 17) ; d) 5' C G*T*C G*T*T*C G*G*C*G*C G*C*G*C*C*G 3' (SEC IO Nº : 18) ; e) 5' G*T*C G*T*T*C G*G*C*G*C G*C*G*C*C*G 3' (SEC IO Nº : 19) ; o
f) 5' T*C G*T*T*C G*G*C*G*C G*C*G*C*C*G 3' (SEC IO Nº : 20) ; en las que 5' se refiere al extremo 5' libre del oligonucleótido y 3' se refiere al extremo 3' libre del oligonucleótido.
5. Una composición farmacéutica que comprende un oligonucleótido de acuerdo con una cualquiera de las reivindicaciones 1-4 y un vehículo farmacéuticamente aceptable.
6. Una composición farmacéutica de acuerdo con la reivindicación 5, formulada para su uso con: a) un nebulizador; o b) un inhalador.
7. Una composición farmacéutica de acuerdo con la reivindicación 6, en la que el inhalador es un inhalador de dosis medida o un inhalador de polvo.
8. Una composición farmacéutica de acuerdo con la reivindicación 5, que comprende adicionalmente: a) un agente quimioterapéutico; o b) un agente anti-viral.
9. Una composición farmacéutica de acuerdo con la reivindicación 5, en la que el vehículo farmacéuticamente aceptable se formula para:
a) administración subcutánea; b) administración oral; o c) administración intranasal.
10. Un oligonucleótido de acuerdo con una cualquiera de las reivindicaciones 1-4 para su uso en terapia.
11. Un oligonucleótido de acuerdo con una cualquiera de las reivindicaciones 1-4 para su uso en la estimulación de una respuesta inmune.
12. Un oligonucleótido de acuerdo con una cualquiera de las reivindicaciones 1-4 para su uso en el tratamiento de asma.
13. Un oligonucleótido de acuerdo con la reivindicación 12, en la que el asma se empeora por infección viral.
14. Un oligonucleótido de acuerdo con una cualquiera de las reivindicaciones 1-4 para su uso en el tratamiento de alergia.
15. Un oligonucleótido de acuerdo con una cualquiera de las reivindicaciones 1-4 para su uso en el tratamiento de cáncer.
16. Un oligonucleótido de acuerdo con la reivindicación 15, siendo el oligonucleótido para usarse con un agente quimioterapéutico.
17. Un oligonucleótido de acuerdo con una cualquiera de las reivindicaciones 1-4 para su uso en el tratamiento de una enfermedad infecciosa.
18. Un oligonucleótido de acuerdo con una cualquiera de las reivindicaciones 1-4 para su uso en el tratamiento de un trastorno viral.
19. Un oligonucleótido de acuerdo con la reivindicación 18, en el que el trastorno viral es hepatitis.
20. Un oligonucleótido de acuerdo con la reivindicación 19, en la que la hepatitis es hepatitis B o hepatitis C.
21. Un oligonucleótido de acuerdo con una cualquiera de las reivindicaciones 1-4 para su uso en el tratamiento de enfermedad autoinmune.
22. Un oligonucleótido de acuerdo con una cualquiera de las reivindicaciones 1-4 para su uso en el tratamiento de remodelación de las vías respiratorias.
23. Un oligonucleótido de acuerdo con la reivindicación 22, siendo el oligonucleótido para su uso sin un antígeno o siendo para su uso con un antígeno.
24. Un oligonucleótido de acuerdo con una cualquiera de las reivindicaciones 1-4 para su uso en un método para tratar asma que comprende administrar a un sujeto que tenga o esté en riesgo de tener asma una cantidad eficaz del oligonucleótido para tratar asma.
25. Un oligonucleótido de acuerdo con una cualquiera de las reivindicaciones 1-4 para su uso en un método para tratar alergia que comprende administrar a un sujeto que tenga o esté en riesgo de tener alergia el oligonucleótido en una cantidad eficaz para tratar alergia.
26. Un oligonucleótido de acuerdo con la reivindicación 25, en el que el sujeto tiene rinitis alérgica.
27. Un oligonucleótido de acuerdo con una cualquiera de las reivindicaciones 1-4 para su uso en un método para modular una respuesta inmune que comprende administrar a un sujeto el oligonucleótido en una cantidad eficaz para modular una respuesta inmune.
28. Un oligonucleótido de acuerdo con una cualquiera de las reivindicaciones 1-4 para su uso en un método para tratar asma empeorada por infección viral que comprende administrar a un sujeto que tiene o está en riesgo de tener asma empeorada por infección viral el oligonucleótido en una cantidad eficaz para tratar el asma.
29. Un oligonucleótido de acuerdo con la reivindicación 27, en la que el oligonucleótido: a) se suministra al sujeto para tratar alergia en el sujeto; b) se suministra al sujeto para tratar enfermedad autoinmune en el sujeto;
c) se suministra al sujeto para tratar remodelación de las vías respiratorias en el sujeto; d) se administra sin un antígeno al sujeto; e) se suministra por una vía seleccionada del grupo que consiste en inyección oral, nasal, sublingual, intravenosa, subcutánea, mucosa, respiratoria, directa y por vía dérmica; f) se suministra al sujeto en una cantidad eficaz para inducir expresión de citocinas; o g) se suministra al sujeto en una cantidad eficaz para desplazar la respuesta inmune a una respuesta sesgada de Th1 de una respuesta sesgada de Th2.
30. Un oligonucleótido de acuerdo con la reivindicación 29, en el que la citocina se selecciona del grupo que consiste en IL-6, TNFα, IFNα, IL-10, IL-12, IFNγ e IP-10.
31. Un oligonucleótido de acuerdo con una cualquiera de las reivindicaciones 1-4 para su uso en un método para tratar cáncer que comprende administrar a un sujeto que tiene cáncer el oligonucleótido en una cantidad eficaz para tratar el cáncer.
32. Un oligonucleótido de acuerdo con la reivindicación 31, en el que el método comprende adicionalmente administrar un agente quimioterapéutico al sujeto o administrar radiación al sujeto.
33. Un oligonucleótido de acuerdo con una cualquiera de las reivindicaciones 1-4 para su uso en un método para tratar enfermedad infecciosa que comprende administrar a un sujeto que tiene o está en riesgo de tener enfermedad infecciosa el oligonucleótido en una cantidad eficaz para tratar la enfermedad infecciosa.
34. Un oligonucleótido de acuerdo con la reivindicación 33, en el que el sujeto tiene una infección viral.
35. Un oligonucleótido de acuerdo con la reivindicación 34, en el que la infección viral es hepatitis B o hepatitis C.
36. Un oligonucleótido de acuerdo con la reivindicación 34, en el que el método comprende adicionalmente administrar un agente antiviral al sujeto.
37. Uso de un oligonucleótido de acuerdo con una cualquiera de las reivindicaciones 1-4 para la fabricación de un medicamento para: a) estimular una respuesta inmune; b) tratar cáncer; c) tratar asma;
d) tratar alergia; o e) tratar enfermedad infecciosa.
A SIN INFECCIÓN B INFECTAOO POR VIRUS
C INFECTAOO POR
VIRUS O INFECTAOO POR VIRUS
E INFECTAOO POR VIRUS F INFECTAOO POR VIRUS
G INFECTAOO POR VIRUS
H INFECTAOO POR VIRUS
I INFECTAOO POR VIRUS
J INFECTAOO POR VIRUS K INFECTAOO POR VIRUS SIN TRATAMIENTO
VEHíCULO OE ENSAYO SEC IO Nº : 1 0, 03
mg/kg SEC IO Nº : 1 0, 3 mg/kg
SEC IO Nº : 1 3 mg/kg
SEC IO Nº : 2 0, 03 mg/kg SEC IO Nº : 2 0, 3 mg/kg
SEC IO Nº : 2, 3 mg/kg
SEC IO Nº : 3 0, 03 mg/kg SEC IO Nº : 3, 0, 3 mg/kg SEC IO Nº : 3, 3 mg/kg
Patentes similares o relacionadas:
Proteínas del factor VIII que tienen secuencias ancestrales, vectores de expresión, y usos relacionados con ellos, del 15 de Julio de 2020, de EMORY UNIVERSITY: Una proteína FVIII recombinante o quimérica que comprende una o más mutaciones ancestrales y una eliminación del dominio B, y en donde la secuencia […]
Método para romper un ácido nucleico y añadir un adaptador por medio de transposasa y reactivo, del 1 de Julio de 2020, de MGI Tech Co., Ltd: Un metodo para romper un acido nucleico y anadir un adaptador por medio de una transposasa, que comprende las siguientes etapas: interrumpir […]
Vacuna subunitaria contra Mycoplasma spp., del 1 de Julio de 2020, de Agricultural Technology Research Institute: Una composición para prevenir una infección por Mycoplasma spp., que comprende: un principio activo, que comprende una proteína de PdhA; y un adyuvante […]
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Oligonucleótidos para tratar una enfermedad ocular, del 13 de Mayo de 2020, de ProQR Therapeutics II B.V: Un oligonucleótido antisentido (OAS) que es capaz de inducir omisión del pseudoexón 40 (PE40) de pre-ARNm de USH2A humano, donde dicho OAS comprende una secuencia […]
Composiciones promotoras, del 6 de Mayo de 2020, de UNIVERSITY OF IOWA RESEARCH FOUNDATION: Una secuencia promotora aislada que comprende un ácido nucleico de entre 500 y 1700 nucleótidos de longitud que tiene por lo menos un 98% de identidad con la SEQ […]
Transfección mediada por células apoptóticas de células de mamífero con ARN de interferencia, del 22 de Abril de 2020, de LOMA LINDA UNIVERSITY: Una célula de mamífero apoptótica o preapoptótica para su uso en la prevención del rechazo de trasplantes, en la que la célula de mamífero […]
Ácidos ribonucleicos con nucleótidos modificados con 4-tio y procedimientos relacionados, del 15 de Abril de 2020, de Translate Bio, Inc: Una molécula de ARNm que tiene una región codificante y opcionalmente, una o más regiones no codificantes, en donde al menos el 25% de los residuos de nucleótidos del […]