MÉTODOS PARA SELECCIONAR REGÍMENES DE TRATAMIENTO Y PREDECIR RESULTADOS EN PACIENTES CON CÁNCER DE MAMA.
Un método para seleccionar de dos o más regímenes de tratamiento,
un régimen de tratamiento que tiene el mayor beneficio esperado para un paciente con cáncer de mama primario o un método para predecir un beneficio esperado en una población comparable de pacientes con cáncer de mama seleccionando de dos o más regímenes de tratamiento, un régimen de tratamiento que tiene el mayor beneficio esperado, teniendo dicho paciente tejido tumoral primario, comprendiendo dicho método: (a) medir el nivel de uPA y el nivel de PAI-1 o el ARNm que codifica uPA y el ARNm que codifica PAI-1 en una muestra de dicho tejido tumoral primario de dicho paciente; (b) clasificar a dicho paciente como de bajo riesgo si el nivel de uPA es menor que un valor de corte de uPA de al menos el percentil 55 y como máximo el percentil 75 de los niveles normalizados de uPA en una población aleatorizada de pacientes con cáncer de mama y el nivel de PAI-1 es menor que un valor de corte de PAI-1 de al menos el percentil 61 y como máximo el percentil 81 de los niveles normalizados de PAI-1 en una población aleatorizada de pacientes con cáncer de mama o como de alto riesgo si el nivel de uPA es mayor que el valor de corte de uPA o el nivel de PAI-1 es mayor que el valor de corte de PAI-1; (c) si dicho paciente se clasifica como de bajo riesgo en la etapa (b), seleccionar un régimen de tratamiento de dichos dos o más regímenes de tratamiento que resulta en el mayor beneficio esperado en una población comparable de pacientes con cáncer de bajo riesgo; y (d) si dicho paciente se clasifica como de alto riesgo en la etapa (b), seleccionar un régimen de tratamiento de dichos dos o más regímenes de tratamiento que resulta en el mayor beneficio esperado en una población comparable de pacientes con cáncer de alto riesgo
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2003/004538.
Solicitante: AMERICAN DIAGNOSTICA INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 500 WEST AVENUE P.O.BOX 110215 STAMFORD, CT 06911-0215 ESTADOS UNIDOS DE AMERICA.
Inventor/es: SCHMITT, MANFRED, HARBECK,NADIA, KATES,Ronald,E, FOEKENS,John,A.
Fecha de Publicación: .
Fecha Solicitud PCT: 13 de Febrero de 2003.
Clasificación Internacional de Patentes:
- C12Q1/68M6B
- G01N33/574C4
Clasificación PCT:
- G01N33/574 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › para el cáncer.
Clasificación antigua:
- C12Q1/70 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen virus o bacteriófagos.
- G01N33/543 G01N 33/00 […] › con un soporte insoluble para la inmovilización de compuestos inmunoquímicos.
- G01N33/577 G01N 33/00 […] › en los que interviene anticuerpos monoclonados.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre.
PDF original: ES-2373547_T3.pdf
Fragmento de la descripción:
Métodos para seleccionar regímenes de tratamiento y predecir resultados en pacientes con cáncer de mama.
1. Campo de la invención
La invención se refiere de manera general al campo del pronóstico del cáncer, selección del tratamiento y predicción del resultado. Más particularmente, la presente invención se refiere a métodos para seleccionar un protocolo de tratamiento para un sujeto basado en al menos dos factores de pronóstico para cáncer, particularmente cáncer de mama, leucemia y plasmacitoma. Los factores incluyen activador del plasminógeno de tipo uroquinasa (uPA) y su inhibidor, inhibidor del activador del plasminógeno 1 (PAI-1) . La presente invención proporciona métodos que comprenden medir los niveles de uPA y PAI-1 o ARNm que codifican uPA y PAI-1 en el tejido canceroso de un paciente con cáncer y seleccionar un régimen de tratamiento para el cáncer. La selección del régimen de tratamiento se basa en los niveles de uPA/PAI-1 o los niveles de ARNm que codifican uPA y PAI-1. También se proporcionan métodos para predecir el máximo beneficio esperado, es decir, supervivencia sin enfermedad y/o supervivencia global de los pacientes con o sin un tratamiento particular.
2. Antecedentes de la invención
El cáncer se caracteriza principalmente por un incremento en el número de células anormales derivadas de un tejido normal dado, la invasión de los tejidos adyacentes por estas células anormales y la diseminación linfática o a través de la sangre de las células malignas a ganglios linfáticos regionales y a sitios distantes (metástasis) . Los datos clínicos y los estudios de biología molecular indican que el cáncer es un proceso con múltiples etapas que empieza con cambios preneoplásicos mínimos, que pueden progresar, bajo determinadas condiciones, a neoplasia.
El crecimiento de las células anormales pre-malignas se ejemplifica por hiperplasia, metaplasia o lo más particularmente displasia (para revisión de dichas condiciones anormales de crecimiento, véase Robbins y Angell, 1976, Basic Pathology, 2a Ed., W.B. Saunders Co., Philadelphia, p. 68-79) . La lesión neoplásica puede evolucionar clonalmente y desarrollar una capacidad incrementada de crecimiento, metástasis y heterogeneidad, especialmente bajo condiciones en las que las células neoplásicas se escapan de la vigilancia inmune del huésped (Roitt, I., Brostoff, J. y Kale, D., 1993, Immunology, 3a ed., Mosby, St. Louis, p. 17.1-17.12) . El sistema activador del plasminógeno juega un papel clave en la invasión y metástasis tumoral (Andreasen, et al., 1997, Int. Journal Cancer 72: 1-22; Schmitt, et al., 1997, Thrombosis Haemostasis 78: 285-296) . Un equilibrio crítico del activador del plasminógeno de tipo uroquinasa (uPA) , su receptor de la superficie celular uPA-R (CD 87) y su inhibidor, el inhibidor del activador del plasminógeno 1 (PAI-1) es el prerrequisito para una proteolisis focal, adhesión y migración eficaces y, por lo tanto, la invasión y metástasis posteriores de las células tumorales.
En la práctica clínica, el diagnóstico preciso de varios subtipos de cáncer es importante porque las opciones de tratamiento, pronóstico y la probabilidad de respuesta terapéutica todos dependen en líneas generales del diagnóstico. El pronóstico preciso, o la determinación de supervivencia sin metástasis distantes o supervivencia global, podría permitir al oncólogo y al paciente tomar decisiones en cuanto al tratamiento. Además, la predicción precisa de pronóstico peor impactaría en gran medida en los ensayos clínicos para nuevas terapias de cáncer de mama, porque los pacientes potenciales de estudio podrían estratificarse según el pronóstico. Los estudios podrían limitarse entonces a los pacientes que tienen un pronóstico peor, facilitando a su vez el discernir si una terapia experimental es eficaz.
La incidencia del cáncer de mama, una causa principal de muerte en las mujeres, se ha incrementado gradualmente en los Estados Unidos durante los últimos treinta años. Su riesgo acumulativo es relativamente alto, 1 en 8 mujeres, por ejemplo, a la edad de 85 en los Estados Unidos. De hecho, el cáncer de mama es el cáncer más común en las mujeres y la segunda causa más común de muerte por cáncer en los Estados Unidos. En 1997, se estimó que se habían indicado 181.000 nuevos casos de cáncer en los EE.UU y que 44.000 personas morirían de cáncer de mama (Parker et al., 1997, CA Cancer J. Clin. 47: 5; Chu et al., 1996, J. Nat. Cancer Inst. 88: 1571) .
El cáncer de mama surge de una malignidad de las células epiteliales en las mujeres, y ocasionalmente en los hombres, habitualmente de origen adenocarcinoma que se inicia en el epitelio ductal de la mama. El Cáncer de Mama es la malignidad no dérmica más común en las mujeres y se anticipan 192.200 casos en los EE.UU para el año que viene. A pesar de avances recientes en el diagnóstico temprano y en el tratamiento, 40.200 mujeres en los EE.UU han sucumbido a esta enfermedad en el año 2000 (Greenlee et al., 2001, Cancer Statistics 51 (1) : 15) .
Una estrategia basada en marcadores para la identificación y caracterización de los tumores promete un diagnóstico mejorado y un fiabilidad en el pronóstico. Típicamente, el diagnóstico del cáncer de mama y otros tipos de cáncer requiere una prueba histopatológica de la presencia del tumor. Además del diagnóstico, los exámenes histopatológicos también proporcionan información acerca del pronóstico y de la selección de los regímenes de tratamiento. El pronóstico también puede establecerse tomando como base parámetros clínicos tales como tamaño del tumor, grado del tumor, la edad del paciente y metástasis en ganglios linfáticos.
Con los regímenes de fármacos convencionales disponibles y potentes así como la aparición de nuevas estrategias de terapia que están dirigidas a rutas biológicas específicas, la determinación del tratamiento óptimo para cáncer de mama primario se está volviendo cada vez más compleja. El resultado de un tratamiento de un paciente con cáncer es a menudo impredecible. Sólo una parte de los pacientes responde a un determinado tipo de tratamiento. Los pacientes que reciben un tipo específico de tratamiento se someten a un sufrimiento innecesario ya que a menudo se obtienen reacciones adversas de un determinado tratamiento usado. Algunos tratamientos incitan una reacción más grave en el paciente que otros tratamientos. La mayor parte de las veces, el efecto de un tratamiento no se muestra hasta 3-6 meses después del tratamiento. Por lo tanto, sería muy importante que los pacientes con una alta probabilidad de responder pudieran ser identificados antes del inicio del tratamiento. Hasta la fecha, no se ha identificado un conjunto de factores predictivos satisfactorio para el pronóstico tomando como base sólo la información clínica.
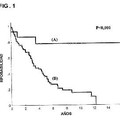
Actualmente, aproximadamente el 50% de los pacientes con cáncer de mama primario no tienen una implicación de los ganglios linfáticos auxiliares y este porcentaje está incrementándose (Hellman et al., 2000, Diseases of the breast, 2a ed., Philadelphia; p. 407-23; Clark et al., 1988, Semin Oncol 15 (2 Supl 1) : 20-5) . No es posible identificar de manera fiable a los pacientes de bajo riesgo (que pueden disponer de quimioterapia adyuvante) por características histomorfológicas y clínicas tradicionales, tales como tamaño del tumor, grado histológico, edad, estado del receptor de las hormonas esteroides o estado menopáusico. McGuire et al., 1992, N Engl J Med 326: 1756-61. Si estas características se usaran para seleccionar terapias para los pacientes, como se recomienda en las declaraciones de consenso de St. Gallen de 1998 y 2001 (Zujewski et al., 1998, J Natl Cancer Inst 90:1587-9; 7th International Consensus Conference on Adjuvant Therapy of Primar y Breast Cancer, St. Gallen, Suiza, Febrero 2001) , hasta el 90% de los pacientes con cáncer de mama ganglio linfático negativo serían candidatos para quimioterapia adyuvante, aunque sólo aproximadamente el 30% de los pacientes con cáncer de mama ganglio linfático negativo recaerían y necesitarían así quimioterapia adyuvante. Esta discrepancia ha impulsado una búsqueda para factores de pronóstico adicionales. Se han usado puntos de corte de 3 ng uPa/mg de proteína y 14 ng PAI-1/mg de proteína para distinguir entre niveles de antígeno altos y bajos en tejido de cáncer de mama. Usando uPA y PAI-1 fue posible dicotomizar a los pacientes con cáncer de mama en subpoblaciones de alto y bajo riesgo para tomar decisiones sobre qué régimen de terapia aplicar (Harbeck et al., Breast Cancer Res & Treatment vol. 54, 1999, p. 147-247 y Jänicke et al.,... [Seguir leyendo]
Reivindicaciones:
1. Un método para seleccionar de dos o más regímenes de tratamiento, un régimen de tratamiento que tiene el mayor beneficio esperado para un paciente con cáncer de mama primario o un método para predecir un beneficio esperado en una población comparable de pacientes con cáncer de mama seleccionando de dos o más regímenes de tratamiento, un régimen de tratamiento que tiene el mayor beneficio esperado, teniendo dicho paciente tejido tumoral primario, comprendiendo dicho método:
(a) medir el nivel de uPA y el nivel de PAI-1 o el ARNm que codifica uPA y el ARNm que codifica PAI-1 en una muestra de dicho tejido tumoral primario de dicho paciente;
(b) clasificar a dicho paciente como de bajo riesgo si el nivel de uPA es menor que un valor de corte de uPA de al menos el percentil 55 y como máximo el percentil 75 de los niveles normalizados de uPA en una población aleatorizada de pacientes con cáncer de mama y el nivel de PAI-1 es menor que un valor de corte de PAI-1 de al menos el percentil 61 y como máximo el percentil 81 de los niveles normalizados de PAI-1 en una población aleatorizada de pacientes con cáncer de mama o como de alto riesgo si el nivel de uPA es mayor que el valor de corte de uPA o el nivel de PAI-1 es mayor que el valor de corte de PAI-1;
(c) si dicho paciente se clasifica como de bajo riesgo en la etapa (b) , seleccionar un régimen de tratamiento de dichos dos o más regímenes de tratamiento que resulta en el mayor beneficio esperado en una población comparable de pacientes con cáncer de bajo riesgo; y
(d) si dicho paciente se clasifica como de alto riesgo en la etapa (b) , seleccionar un régimen de tratamiento de dichos dos o más regímenes de tratamiento que resulta en el mayor beneficio esperado en una población comparable de pacientes con cáncer de alto riesgo.
2. El método de la reivindicación 1 en el que si dicho paciente se clasifica como de alto riesgo, el régimen de tratamiento seleccionado se selecciona de quimioterapia, quimioterapia adyuvante, quimioterapia CMF adyuvante, quimioterapia no CMF adyuvante, quimioterapia que contiene antraciclina adyuvante, quimioterapia que contiene taxanos adyuvante, terapia endocrina adyuvante, terapia con radiación, terapia génica, inmunoterapia o terapia biológica-tumoral.
3. El método de la reivindicación 1 en el que dicho ARNm que codifica uPA y el ARNm que codifica PAI-1 se miden por amplificación con RT-PCR.
4. El método de la reivindicación 1 en el que dicha población comparable se define por el estado ganglionar, número de ganglios afectados, tamaño del tumor, grado del tumor, edad del paciente, estado de receptores hormonales y estado menopáusico.
5. El método de la reivindicación 1 en el que dicho paciente es ganglio negativo.
6. El método de la reivindicación 1 en el que dicho paciente no tiene más de 3 ganglios linfáticos afectados.
7. El método de la reivindicación 1 en el que, si dicho paciente se clasifica como de bajo riesgo, el régimen de tratamiento seleccionado se selecciona de no tratamiento, terapia con radiación o terapia endocrina adyuvante.
8. El método de la reivindicación 1 en el que dicha muestra se recoge por biopsia core o aspiración de fluido corporal.
9. El método de la reivindicación 1 en el que dicho nivel de uPA y dicho nivel de PAI-1 se miden por cuantificación in situ.
10. El método de la reivindicación 1 en el que dicho nivel de uPA y dicho nivel de PAI-1 se miden usando microscopía de inmunofluorescencia o inmunoelectrónica.
11. El método de la reivindicación 10 en el que dicho nivel de uPA y dicho nivel de PAI-1 se miden cuantitativamente contando el número de granos de marcaje en dicha muestra.
12. El método de la reivindicación 1 en el que dicha muestra es un espécimen histológico de dicho paciente.
13. El método de la reivindicación 12 en el que dicho espécimen histológico es una sección de tejido incluida en parafina.
14. El método de la reivindicación 13 en el que dicho nivel de uPA y dicho nivel de PAI-1 se miden poniendo en contacto dicha sección de tejido con anticuerpos uPA y anticuerpos PAI-1.
15. El método de la reivindicación 1 en el que dicho régimen de tratamiento para pacientes de alto riesgo es la administración de fármacos bifosfonato al paciente.
Patentes similares o relacionadas:
MARCADORES PARA LA SELECCIÓN DE TERAPIAS PERSONALIZADAS PARA EL TRATAMIENTO DEL CÁNCER, del 7 de Febrero de 2012, de FUNDACION INSTITUT DE RECERCA DE L'HOSPITAL UNIVERSITARI VALL D'HEBRON: La invención se relaciona con la identificación de los niveles de expresión de aprataxina (APTX) como marcador de respuesta a terapias basadas en inhibidores de topoisomerasa […]
 METODO Y KIT PARA EL PRONOSTICO DEL LINFOMA DE CELULAS DEL MANTO, del 23 de Enero de 2012, de HOSPITAL CLINIC DE BARCELONA UNIVERSIDAD DE BARCELONA FUNDACIO CLINIC PER A LA RECERCA BIOMEDICA INSTITUT D'INVESTIGATIONS BIOMEDIQUES AUGUST PI I SUNYER (IDIBAPS): Método y kit para el pronóstico del linfoma de células del manto.
El método y el kit son útiles como herramientas para clasificar un paciente diagnosticado con linfoma […]
METODO Y KIT PARA EL PRONOSTICO DEL LINFOMA DE CELULAS DEL MANTO, del 23 de Enero de 2012, de HOSPITAL CLINIC DE BARCELONA UNIVERSIDAD DE BARCELONA FUNDACIO CLINIC PER A LA RECERCA BIOMEDICA INSTITUT D'INVESTIGATIONS BIOMEDIQUES AUGUST PI I SUNYER (IDIBAPS): Método y kit para el pronóstico del linfoma de células del manto.
El método y el kit son útiles como herramientas para clasificar un paciente diagnosticado con linfoma […]
PROCEDIMIENTOS Y COMPOSICIONES PARA EL DIAGNÓSTICO Y TRATAMIENTO DEL CÁNCER DE PULMÓN UTILIZANDO EL GEN DE PDGFRA, KIT O KDR COMO MARCADOR GENÉTICO, del 17 de Enero de 2012, de GENENTECH, INC.: Procedimiento para diagnosticar la presencia de un cáncer de pulmón en un mamífero, comprendiendo el procedimiento la detección de si el gen de PDGFRA está […]
MÉTODOS Y SONDAS PARA LA DETECCIÓN DEL CÁNCER, del 12 de Enero de 2012, de VYSIS, INC. MAYO FOUNDATION FOR MEDICAL EDUCATION AND RESEARCH: Un conjunto de sondas cromosómicas que comprende la siguiente combinación de cuatro sondas: una sonda específica del locus 5p15, una sonda específica del locus 8q24, […]
COMPOSICIÓN Y PROCEDIMIENTO PARA LA DETECCIÓN, DIAGNÓSTICO Y TERAPÍA DE NEOPLASIAS HEMATOLÓGICAS, del 22 de Diciembre de 2011, de CORIXA CORPORATION: Uso de una cantidad eficaz de un anticuerpo monoclonal aislado que se une específicamente a un polipéptido que comprende la secuencia expuesta en SEC ID Nº: 4 […]
MÉTODO NORMALIZADO Y OPTIMIZADO DE REACCIÓN EN CADENA DE LA POLIMERASA DE TRANSCRIPTASA INVERSA CUANTITATIVA EN TIEMPO REAL PARA LA DETECCIÓN DE MRD EN LEUCEMIA, del 14 de Diciembre de 2011, de UNIVERSITE DE LA MEDITERRANEE: Conjunto de ácidos nucleicos ABL para RQ-PCR que comprende una sonda nucleotídica que tiene la secuencia SEC ID N.º 2 y cebadores directo e inverso que tienen las secuencias […]
BIOMARCADORES Y PROCEDIMIENTOS PARA DETERMINAR LA SENSIBILIDAD A MODULADORES DEL RECEPTOR DEL FACTOR DE CRECIMIENTO EPIDÉRMICO, del 12 de Diciembre de 2011, de BRISTOL-MYERS SQUIBB COMPANY: Un procedimiento in vitro para predecir la probabilidad de que un mamífero responda terapéuticamente a un procedimiento de tratamiento del […]
MÉTODO PARA LA PREDICCIÓN DE LA RESPUESTA A UN TRATAMIENTO CON UN INHIBIDOR DE LA DIMERIZACIÓN DE HER, del 4 de Abril de 2011, de F. HOFFMANN-LA ROCHE AG: Un método para predecir la respuesta a un tratamiento con un inhibidor de la dimerización de HER en un paciente, que comprende los pasos de a) valorar […]