MOLÉCULA DE ADN CIRCULAR CON ORIGEN DE REPLICACIÓN CONDICIONAL, SU PROCEDIMEINTO DE PREPARACIÓN Y SU UTILIZACIÓN EN TERAPIA GÉNICA.
Una célula procariota hospedante recombinante que comprende una proteína iniciadora de replicación,
codificada por un gen incorporado en el genoma de la célula, que activa un origen de replicación condicional portado por una molécula de ADN de forma circular, útil en terapia génica, que comprende una región promotora de la transcripción y al menos una secuencia nucleica de interés cuya traducción y opcionalmente la traducción en la célula diana generan productos que tienen un interés terapéutico, vacunal, agronómico o veterinario, caracterizada por que a. la región que permite su replicación comprende un origen de replicación condicional procedente de un plásmido o de un bacteriófago cuya funcionalidad en una célula procariota hospedante requiere la presencia de al menos una proteína iniciadora de replicación específica de dicho plásmido o bacteriófago y extraña a dicha célula procariota hospedante, b. dicha molécula de ADN no incluye dicha proteína iniciadora de replicación, c. dicha molécula de ADN incluye un marcador de selección, y d. dicha molécula de ADN no se disemina en la célula hospedante en ausencia de dicha proteína iniciadora de replicación
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06017245.
Solicitante: AVENTIS PHARMA S.A..
Nacionalidad solicitante: Francia.
Dirección: 20, AVENUE RAYMEND S.A. 92160 ANTONY FRANCIA.
Inventor/es: CROUZET, JOEL, SOUBRIER, FABIENNE.
Fecha de Publicación: .
Fecha Solicitud PCT: 13 de Septiembre de 1996.
Clasificación Internacional de Patentes:
- C07K14/50A
- C07K14/82 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Productos de traducción de oncogenes.
- C12N15/69 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Aumento del número de copias del vector.
- C12N15/70 C12N 15/00 […] › Vectores o sistemas de expresión especialmente adaptados a E. coli.
Clasificación PCT:
- A61K48/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- C12N15/69 C12N 15/00 […] › Aumento del número de copias del vector.
- C12N15/70 C12N 15/00 […] › Vectores o sistemas de expresión especialmente adaptados a E. coli.
- C12N15/74 C12N 15/00 […] › Vectores o sistemas de expresión especialmente adaptados a huéspedes procariotas distintos a E. coli, p. ej. Lactobacillus, Micromonospora.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Portugal, Irlanda, Finlandia.
PDF original: ES-2357098_T3.pdf
Fragmento de la descripción:
La presente invención se refiere a una nueva molécula de ADN con replicación condicional, utilizable en terapia génica o para la producción de proteínas recombinantes.
La terapia génica consiste en corregir una deficiencia o una anomalía introduciendo una información genética en la célula o el órgano afectado. Esta información puede introducirse bien sea in vitro en una célula extraída del órgano y a 5 continuación reinyectada en el organismo, bien sea in vivo, directamente en el tejido considerado. Como se trata de una molécula de elevado peso molecular y de carga negativa, el ADN tiene dificultades para atravesar espontáneamente las membranas celulares fosfolipídicas. Diferentes vectores se han pues utilizado a fin de permitir la transferencia del gen: vectores virales por una parte, vectores químicos y/o bioquímicos, naturales o sintéticos, por otra parte.
Los vectores virales (retrovirus, adenovirus, virus adenoasociados, son muy eficaces, especialmente para el paso de las 10 membranas, pero presentan un cierto número de riesgos tales como la patogenicidad, la recombinación, la replicación, la inmunogenicidad,…
Los vectores químicos y/o bioquímicos permiten evitar estos riesgos (como referencia, véase Behr, 1993, Cotten et Wagner, 1993). Son por ejemplo cationes (fosfato de calcio, DEAE-dextrano …) que actúan formando precipitados con el ADN, los cuales pueden ser “fagocitados” por las células. Igualmente puede tratarse de liposomas en los cuales el 15 ADN se incorpora y que se fusionan con la membrana plasmática. Los vectores sintéticos de transferencia de genes son generalmente lípidos o polímeros catiónicos que complejan el ADN y forman con él una partícula que lleva cargas positivas en superficie. Como ejemplo ilustrativo de este tipo de vectores, se pueden citar especialmente dioctadecilamidoglicilespermina (DOGS, TransfectamTM) o cloruro de N-[1-(2,3-dioleiloxi)propil]-N,N,N-trimetilamonio (DOTMA, Lipof4ectinTM). 20
Sin embargo, la utilización de vectores químicos y/o bioquímicos o de ADN desnudo implica la posibilidad de producir cantidades importantes de ADN de pureza farmacológica. En efecto, en las técnicas de terapia génica, el medicamento está constituido por el mismo ADN y es esencial poder fabricar, en cantidades adaptadas, los ADN que tengan propiedades apropiadas a un uso terapéutico en el hombre.
En el caso de la vectorología no viral, son plásmidos de origen bacteriano los que se utilizan. Los plásmidos 25 generalmente utilizados en terapia génica llevan (i) un origen de replicación, (ii) un gen marcador tal como un gen de resistencia a un antibiótico (kanamicina, ampicilina…) y (iii) uno o varios transgenes con secuencias necesarias para su expresión (activador(es), promotor(es), secuencias de poliadenilación…).
Sin embargo, la tecnología actualmente disponible no da entera satisfacción.
Por una parte, queda un riesgo de diseminación en el organismo. Así una bacteria presente en el organismo puede, con 30 una baja frecuencia, recibir este plásmido. Esto tiene tantas más probabilidades de pasar cuando se trata de un tratamiento de terapia génica in vivo en el cual el DNA puede diseminarse en el organismo del paciente y puede encontrarse en contacto con bacterias que infecten este paciente o bien bacterias de la flora comensal. Si la bacteria receptora del plásmido es una enterobacteria, tal como E. coli, este plásmido puede replicarse. Tal acontecimiento conduce entonces a la diseminación del gen terapéutico. En la medida en que los genes terapéuticos utilizados en 35 tratamientos de terapia génica pueden codificar por ejemplo una linfoquina, un factor de crecimiento, un antioncogen, o una proteína cuya función falte en el hospedante y permite pues corregir un defecto genético, la diseminación de ciertos de estos genes podría tener efectos imprevisibles y preocupantes (por ejemplo sí una bacteria patógena adquiere el gen de un factor de crecimiento humano).
Por otra parte, los plásmidos utilizados generalmente en terapia génica no viral poseen también un marcador de 40 resistencia a un antibiótico (ampicilina, kanamicina…). La bacteria que adquiera tal plásmido tiene pues una ventaja selectiva innegable ya que cualquier tratamiento antibioterápico, que utilice un antibiótico de la misma familia que el que selecciona el gen de resistencia del plásmido, va a conducir a la selección del plásmido en cuestión. A esta consideración, la ampicilina forma parte de las β-lactamas que es la familia de antibióticos más utilizada en el mundo. La utilización de marcadores de selección en las bacterias que no sean genes de resistencia a los antibióticos será pues 45 particularmente ventajosa. Evitaría la selección de bacterias que hallan podido recibir un plásmido que lleve tal marcador.
Es pues particularmente importante buscar como limitar al máximo la diseminación de genes terapéuticos y de genes de resistencia.
La presente invención tiene precisamente por objetivo proponer nuevas moléculas de ADN, utilizables en terapia génica 50 o para la producción de proteínas recombinantes in vitro, que solo se replican en células que pueden complementar ciertas funciones de estos vectores no virales.
La invención se refiere igualmente a un método particularmente eficaz para la preparación de estas moléculas de ADN.
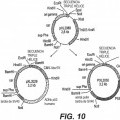
Las moléculas de ADN reivindicadas tienen como ventaja eliminar los riesgos asociados a una diseminación del plásmido, tales como (1) la replicación y la diseminación, que pueden implicar una sobreexpresión no controlada del gen terapéutico, (2) la diseminación y la expresión de genes de resistencia. La información genética contenida en las moléculas de ADN según la invención comprende en efecto el(los) gen(es) terapéutico(s) y las señales de regulación de su expresión, un origen de replicación condicional funcional que limita muy fuertemente el espectro del hospedante 5 celular de este plásmido, un marcador de selección de tamaño reducido de preferencia diferente del gen que confiere la resistencia a un antibiótico y llegado el caso, un fragmento de ADN que permite la resolución de multímeros de plásmido. La probabilidad de que estas moléculas (y por tanto la información genética que contienen) sean transferidas a un microorganismo, y mantenidas de manera estable, es muy limitada.
Por último los vectores según la invención, igualmente designados miniplásmidos en razón de su estructura circular, de 10 su tamaño reducido y de su forma superenrollada, presentan las ventajas suplementarias siguientes: En razón de su tamaño reducido con relación a los plásmidos derivados de ColE1 clásicamente utilizados, las moléculas de ADN según la invención tienen potencialmente una mejor biodisponibilidad in vivo. En particular, presentan capacidades de penetración y de distribución celulares mejoradas. Así, es reconocido que el coeficiente de difusión en los tejidos es inversamente proporcional al peso molecular (Jain, 1987). Igualmente, a nivel celular, las moléculas de elevado peso 15 molecular tienen una peor permeabilidad a través de la membrana plasmática. Además, para el paso del plásmido al núcleo, indispensable para su expresión, el peso molecular elevado es igualmente un inconveniente, los poros nucleares imponen un límite de tamaño para la difusión hacia el núcleo (Landford et al., 1986). La reducción de tamaño de las partes no terapéuticas de la molécula de ADN (origen de replicación y gen de selección especialmente) según la invención permite igualmente disminuir el tamaño de las moléculas de ADN. La parte que permite la replicación y la 20 selección de este plásmido en la bacteria (1,1 kb) está disminuido por un factor 3, contando por ejemplo 3 kb para el origen de replicación y el marcador de resistencia de la parte del vector. Esta disminución (i) de peso molecular y (ii) de carga negativa, confiere a las moléculas de la invención capacidades mejoradas de difusión y de biodisponibilidad tisulares, celulares y nucleares.
Más precisamente, la presente invención se refiere a una molécula de ADN en forma circular, útil en terapia génica, que 25 comprende al menos una secuencia nucleica de interés, caracterizada porque la región que permite su replicación comprende un origen de replicación cuya funcionalidad en una célula hospedante requiere la presencia de al menos una proteína específica y extraña a dicha célula hospedante.
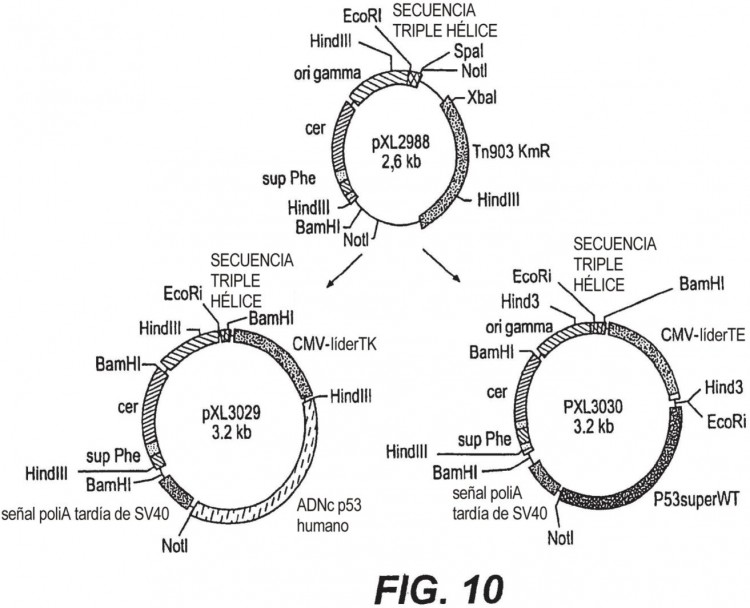
Esta molécula de ADN puede presentarse en forma... [Seguir leyendo]
Reivindicaciones:
1. Una célula procariota hospedante recombinante que comprende una proteína iniciadora de replicación, codificada por un gen incorporado en el genoma de la célula, que activa un origen de replicación condicional portado por una molécula de ADN de forma circular, útil en terapia génica, que comprende una región promotora de la transcripción y al menos una secuencia nucleica de interés cuya traducción y opcionalmente la traducción en la célula diana generan productos 5 que tienen un interés terapéutico, vacunal, agronómico o veterinario, caracterizada por que
a. la región que permite su replicación comprende un origen de replicación condicional procedente de un plásmido o de un bacteriófago cuya funcionalidad en una célula procariota hospedante requiere la presencia de al menos una proteína iniciadora de replicación específica de dicho plásmido o bacteriófago y extraña a dicha célula procariota hospedante, 10
b. dicha molécula de ADN no incluye dicha proteína iniciadora de replicación,
c. dicha molécula de ADN incluye un marcador de selección, y
d. dicha molécula de ADN no se disemina en la célula hospedante en ausencia de dicha proteína iniciadora de replicación.
2. Una célula procariota hospedante recombinante según la reivindicación 1, caracterizada por que dicho origen de 15 replicación condicional de dicha molécula de ADN circular procede de un plásmido o bacteriófago que posee un origen de replicación, representado por varios iterones, y que codifica al menos una proteína específica, que condiciona la funcionalidad de su origen de replicación.
3. Una célula procariota hospedante recombinante según la reivindicación 1 o 2, caracterizada por que el origen de replicación condicional de dicha molécula de ADN circular procede de los plásmidos o bacteriófagos siguientes RK2, 20 R6K, R1, pSC101, Rtsl, F, RSF1010, P1, P4, lambda, Phi82 y Phi 80.
4. Una célula procariota hospedante recombinante según una de las reivindicaciones precedentes, caracterizada por que dicho origen de replicación condicional de dicha molécula de ADN circular procede del plásmido bacteriano R6K.
5. Una célula procariota hospedante recombinante según una de las reivindicaciones precedentes, caracterizada por que dicho origen de replicación condicional de dicha molécula de ADN circular está constituida en todo o en parte por el 25 origen de replicación gamma del plásmido R6K.
6. Una célula procariota hospedante recombinante según una de las reivindicaciones precedentes, caracterizada por que dicho origen de replicación condicional de dicha molécula de ADN circular está representada en todo o parte por la secuencia SEQ ID N°1.
7. Una célula procariota hospedante recombinante según una de las reivindicaciones precedentes, caracterizada por 30 que comprende un gen esencial que comprende una mutación ámbar.
8. Una célula procariota hospedante recombinante según una de las reivindicaciones precedentes, caracterizada por que comprende un gen esencial que comprende un codón ámbar TAG.
9. Una célula procariota hospedante recombinante según una de las reivindicaciones precedentes, caracterizada por que la mutación ámbar está localizada en un gen de la biosíntesis de una base nucleica, tal como las purinas. 35
10. Una célula procariota hospedante recombinante según una de las reivindicaciones precedentes, caracterizada por que la mutación ámbar está localizada en un gen de la biosíntesis de un aminoácido tal como la arginina, o de la biosíntesis de la vitamina, de un gen que permite utilizar una fuente de carbono o de nitrógeno particular, o de un gen esencial.
11. Una célula procariota hospedante recombinante según una de las reivindicaciones precedentes, caracterizada por 40 que la célula se elige entre las cepas de E. coli.
12. Una célula procariota hospedante recombinante según una de las reivindicaciones precedentes, caracterizada por que la célula procede de la cepa E. coli XAC 1.
13. Una célula procariota hospedante recombinante según una de las reivindicaciones precedentes, caracterizada por que dicha proteína iniciadora de replicación está codificada por el gen pir o el gen pir que comprende al menos una 45 mutación.
14. Una célula procariota hospedante recombinante según una de las reivindicaciones precedentes, caracterizada por que dicha proteína iniciadora de replicación está codificada por el gen pir 116.
15. Una célula procariota hospedante recombinante según una de las reivindicaciones precedentes, caracterizada por que el gen pir está mutado por la sustitución de una prolina por una leucina.
16. Una célula procariota hospedante recombinante según una de las reivindicaciones precedentes, caracterizada por 5 que dicha proteína iniciadora de replicación está codificada por el gen pir y la célula hospedante procariótica recombinante se designa XAC-1pir.
17. Una célula procariota hospedante recombinante según una de las reivindicaciones precedentes, caracterizada por que dicha proteína iniciadora de replicación está codificada por el gen pir116 y la célula hospedante procariótica recombinante se designa XAC-1pir116. 10
18. Una célula procariota hospedante recombinante según una de las reivindicaciones precedentes, caracterizada por que dicha proteína iniciadora de replicación está codificada por la secuencia SEQ ID NO : 2.
19. Una célula procariota hospedante recombinante según una de las reivindicaciones precedentes, caracterizada por que dicha célula es deficiente en el gen endA.
20. Una célula procariota hospedante recombinante según una de las reivindicaciones precedentes, caracterizada por 15 que el gen endA se ha inactivado por mutación, deleción total o parcial o por disrrupción.
21. Una célula procariota hospedante recombinante que comprende un gen heterólogo pir o un gen pir, incorporado en el genoma de la célula, que comprende al menos una mutación y que codifica la proteína iniciadora de replicación pi. y deficiente en el gen endA.
22. Una célula procariota hospedante recombinante según la reivindicación 21 caracterizada por que la proteína de 20 replicación pi está codificada por el gen pir116.
23. Una célula procariota hospedante recombinante según la reivindicación 21 o 22 caracterizada por que la proteína iniciadora de replicación está codificada por la secuencia SEQ ID NO : 2.
24. Una célula procariota hospedante recombinante según una cualquiera de las reivindicaciones 21 a 23 caracterizada por que se elige entre las cepas de E. coli. 25
25. Una célula procariota hospedante recombinante según una cualquiera de las reivindicaciones 21 y 24 caracterizada por que la célula procede de la cepa E. coli XAC 1.
26. Una célula procariota hospedante recombinante según una cualquiera de las reivindicaciones 21 a 25, caracterizada por que el gen pir está mutado por la sustitución de una prolina por una leucina.
27. Una célula procariota hospedante recombinante según una de las reivindicaciones 21 a 26, caracterizada por que el 30 gen endA se ha inactivado por mutación, deleción total o parcial o por disrrupción.
Patentes similares o relacionadas:
ENZIMA CON ACTIVIDAD ALFA-AMILASA CON EXTREMA TERMOTOLERANCIA Y TERMOESTABILIDAD, PARA LA INDUSTRIA DEL PROCESAMIENTO DEL ALMIDÓN, del 9 de Julio de 2020, de UNIVERSIDAD DE ANTOFAGASTA: La presente invención se relaciona con una enzima hidrolasa modificada tipo alfa-amilasa termoestable y termorresistente, que comprende una secuencia […]
PRODUCCIÓN BIOTECNOLÓGICA DE D-DIBOA Y SUS DERIVADOS CLORADOS A PARTIR DE SUS PRECURSORES NITROFENOXIDO-ACETATO, del 7 de Julio de 2020, de UNIVERSIDAD DE CADIZ: Producción biotecnológica de D-Diboa y sus derivados clorados a partir de sus precursores nitrofenoxido-acetato. El área científica al que corresponde la invención es la […]
Vacuna subunitaria contra Mycoplasma spp., del 1 de Julio de 2020, de Agricultural Technology Research Institute: Una composición para prevenir una infección por Mycoplasma spp., que comprende: un principio activo, que comprende una proteína de PdhA; y un adyuvante […]
PRODUCCION BIOTECNOLOGIA DE D-D!BOA Y SUS DERIVADOS CLORADOS A PARTIR DE SUS PRECURSORES NITROFENOXIDO-ACETATO, del 25 de Junio de 2020, de UNIVERSIDAD DE CADIZ: La invención tiene como propósito la producción biotecnológica de D-DIBQA, un compuesto análogo al herbicida natural DIBOA, a partir del precursor 2-(2'-nitrofenoxi)- […]
UN PROCESO PARA LA OBTENCIÓN DE LA PROTEÍNA RECOMBINANTE DE ALOFICOCIANINA FUNCIONAL, del 18 de Junio de 2020, de UNIVERSIDAD DE CONCEPCION: La presente tecnología corresponde a un proceso para la obtención de la proteína recombinante de Aloficocianina funcional el cual está basado en […]
Células huéspedes modificadas y usos de las mismas, del 22 de Abril de 2020, de GLAXOSMITHKLINE BIOLOGICALS S.A.: Una célula huésped que comprende: i. un ácido nucleico que codifica una glicosiltransferasa derivada de un racimo rfb de Pseudomonas; ii. un ácido nucleico […]
Cepas bacterianas que expresan genes de metilasa y sus usos, del 22 de Abril de 2020, de LOMA LINDA UNIVERSITY: Una bacteria aislada para usar en la producción de ADN plasmídico metilado, en donde la bacteria comprende un polinucleótido exógeno que codifica una CpG metilasa […]
Microorganismo capaz de producir l-aminoácido y método para producir L-aminoácido mediante el uso del mismo, del 1 de Abril de 2020, de CJ CHEILJEDANG CORPORATION: Una cepa de E. coli que produce L-treonina o L-triptófano, en donde la cepa es una cepa recombinante que se modifica para atenuar la actividad de […]