INGENIERÍA TISULAR.
Un método de producción de un injerto vascular que comprende: i) introducir en células constituyentes obtenidas de un ser humano,
comprendiendo dichas células constituyentes células de músculo liso, una construcción que comprende una secuencia de ácido nucleico que codifica un producto proteico que prolonga el periodo de vida o inmortalizante que tiene actividad catalítica de telomerasa, en condiciones tales que dicha secuencia de ácido nucleico se exprese y, de este modo, se produzca dicho producto proteico, y ii) modificar mediante ingeniería dichas células resultantes de la etapa (i) en dicho injerto vascular
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2003/008054.
Solicitante: DUKE UNIVERSITY.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: OFFICE OF SCIENCE AND TECHNOLOGY, P.O. BOX 90083 DURHAM, NC 27708-0083 ESTADOS UNIDOS DE AMERICA.
Inventor/es: MCKEE,J.,ANDREW DUKE UNIVERSITY, NIKLASON,LAURA,E. DUKE UNIVERSITY, COUNTER,CHRISTOPHER,M. DUKE UNIVERSITY.
Fecha de Publicación: .
Fecha Solicitud PCT: 17 de Marzo de 2003.
Fecha Concesión Europea: 13 de Octubre de 2010.
Clasificación Internacional de Patentes:
- C12N5/06B28A
Clasificación PCT:
- A01N63/00 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01N CONSERVACION DE CUERPOS HUMANOS O ANIMALES O DE VEGETALES O DE PARTES DE ELLOS (conservación de alimentos o productos alimenticios A23 ); BIOCIDAS, p. ej. EN TANTO QUE SEAN DESINFECTANTES, PESTICIDAS O HERBICIDAS (preparaciones de uso médico, dental o para el aseo que eliminan o previenen el crecimiento o la proliferación de organismos no deseados A61K ); PRODUCTOS QUE ATRAEN O REPELEN A LOS ANIMALES; REGULADORES DEL CRECIMIENTO DE LOS VEGETALES. › Biocidas, productos que repelen o atraen a los animales perjudiciales, o reguladores del crecimiento de los vegetales, que contienen microorganismos, virus, hongos microscópicos, animales, o sustancias producidas por, u obtenidas a partir de microorganismos, virus, hongos microscópicos o animales, p. ej. encimas o productos de fermentación (que contienen compuestos de constitución determinada A01N 27/00 - A01N 59/00; algas unicelulares A01N 65/03).
- A61K48/00 A […] › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- C12N15/63 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
- C12N15/85 C12N 15/00 […] › para células animales.
- C12N15/87 C12N 15/00 […] › Introducción de material genético extraño utilizando procedimientos no previstos en otro lugar, p. ej. cotransformación.
- C12N5/00 C12N […] › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
- C12N5/02 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Propagación de células individuales o de células en suspensión; Su conservación; Medios de cultivo para este fin.
Clasificación antigua:
- A01N63/00 A01N […] › Biocidas, productos que repelen o atraen a los animales perjudiciales, o reguladores del crecimiento de los vegetales, que contienen microorganismos, virus, hongos microscópicos, animales, o sustancias producidas por, u obtenidas a partir de microorganismos, virus, hongos microscópicos o animales, p. ej. encimas o productos de fermentación (que contienen compuestos de constitución determinada A01N 27/00 - A01N 59/00; algas unicelulares A01N 65/03).
- A61K48/00 A61K […] › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- C12N15/63 C12N 15/00 […] › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
- C12N15/85 C12N 15/00 […] › para células animales.
- C12N15/87 C12N 15/00 […] › Introducción de material genético extraño utilizando procedimientos no previstos en otro lugar, p. ej. cotransformación.
- C12N5/00 C12N […] › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
- C12N5/02 C12N 5/00 […] › Propagación de células individuales o de células en suspensión; Su conservación; Medios de cultivo para este fin.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
CAMPO TÉCNICO
La presente invención se refiere, en general, a la ingeniería tisular y, en particular, a un método para prolongar el periodo de vida de células adecuado para su uso en ingeniería vascular. ANTECEDENTES
En los Estados Unidos, 1,4 millones de pacientes al año se someten a operaciones que requieren prótesis arteriales (Langer et al, Science 260: 920926 (1993)). Aproximadamente 100.000 pacientes al año requieren un bypass vascular en arterias de pequeño calibre, pero no tienen ninguna arteria o vena autóloga utilizable para injertos (Niklason, Science 286: 1493-1494 (1999)). Por lo tanto, existe una acuciante necesidad de vasos autólogos para tratar la enfermedad aterosclerótica (Lefkowitz et al, Journal of American Medical Association 285: 581-587 (2001)). Las arterias se han obtenido con éxito mediante ingeniería a partir de células de músculo liso (SMC) humanas neonatales (L'Heureux et al, FASEB J. 12: 47-56 (1998)), y de SMC porcinas y bovinas (Niklason et al, Science 284: 489-493 (1999), Niklason et al, Journal of Vascular Surgery 33: 628-638 (2001)). Sin embargo, estos enfoques aún no se han trasladado al desarrollo de arterias humanas adecuadas para uso clínico.
La incapacidad de las SMC no neonatales de formar arterias in vitro puede deberse a su periodo de vida finito en cultivo. Específicamente, el cultivo arterial in vitro requiere de 45 a 60 duplicaciones de la población (PD) de SMC para producir una arteria mecánicamente robusta, mientras que la formación de la monocapa endotelial requiere muchas menos duplicaciones celulares (L'Heureux et al, FASEB J. 12: 47-56 (1998), Niklason et al, Science 284: 489493 (1999), Niklason et al, Journal of Vascular Surgery 33: 628-638 (2000)). Sin embargo, las SMC humanas no neonatales proliferan in vitro durante solamente de 15 a 30 PD antes de la detención terminal del desarrollo en un estado denominado senescencia (Bierman, In Vitro 14: 951-955 (1978), Bonin et al, Arteriosclerosis, Thrombosis, and Vascular Biology 19: 575-587 (1999)). Por lo tanto, el limitado periodo de vida de las SMC humanas representa un obstáculo fundamental al cultivo de vasos sanguíneos autólogos.
Recientemente, se han desarrollado muchos enfoques genéticos para prolongar el periodo de vida de las células somáticas humanas. Por ejemplo, en varias células somáticas humanas normales, la expresión del gen hTERT (Nakamura et al, Cell 92: 587-590 (1998)) (siendo hTERT la subunidad proteica catalítica de transcriptasa inversa de la telomerasa humana) ha demostrado reactivar la telomerasa, la enzima que alarga los telómeros que recubren los extremos del cromosoma (Sedivy, Proceedings of the National Academy of Sciences EE. UU. 95: 9078-9081 (1998)). El periodo de vida celular se prolongó sin inducción de un fenotipo canceroso (Jiang et al, Nature Genetics
21: 111-114 (1999), Morales et al, Nature Genetics 21: 115-118 (1999)), Yang et al, Journal of Biological Chemistry 274: 26141-26148 (1999)).
La presente invención es el resultado de estudios que demuestran que la expresión de genes que prolongan el periodo de vida en células humanas no neonatales (es decir, SMC) prolonga la capacidad de proliferación de estas células. Los enfoques que utilizan la prolongación del periodo de vida hacen posible el cultivo de arterias robustas a partir de células humanas in vitro. SUMARIO DE LA INVENCIÓN
La presente invención se refiere en general a ingeniería tisular. Más específicamente, la invención se refiere a un método para prolongar el periodo de vida de células y al uso de dichas células en la producción de injertos vasculares.
Los objetos y ventajas de la presente invención quedarán claros a partir de la siguiente descripción. BREVE DESCRIPCIÓN DE LOS DIBUJOS
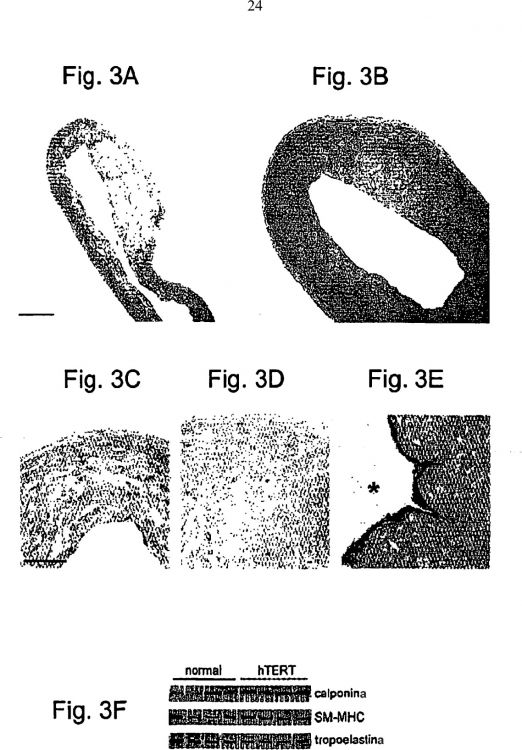
Figuras 1A-1C. La Telomerasa en SMC aumenta el periodo de vida y prolonga los telómeros. Figura 1A. Ensayo TRAP, SMC con hTERT (hT) fueron positivas para actividad telomerasa, según se indicaba mediante productos en forma de escala de 6 pb, mientras que las SMC normales (n) y las SMC vectoriales (v) fueron negativas. Las células HEK que expresaban hTERT (Armbruster et al, Molecular and Cellular Biology 21: 7775-7786 (2001)) sirvieron como control positivo (CTL). HI, controles inactivados por calor; asterisco, control interno de PCR. Figura 1B. Las SMC normales (n) y vectoriales (v) sufrían senescencia a 37 PD, mientras que las SMC con hTERT (hT) crecían hasta al menos 100 PD. Se conserva el tiempo de duplicación de la población. Figura 1C. La hibridación de Southern demuestra la erosión del telómero de SMC normales y vectoriales, mientras que los telómeros de SMC con hTERT se prolongan durante al menos 80 PD. Figuras 2A-2D. Las SMC con hTERT (hT) muestran un fenotipo normal, no transformado en comparación con SMC normales (n) y SMC vectoriales (v). Transferencias de Western para la Figura 2A, cadenas pesadas de calponina y miosina de músculo liso (marcadores de diferenciación) y tropoelastina (proteína de la matriz extracelular); Figura 2B, pRb; SC, subconfluente; C, confluente; Figura 2C, p53; +, células tratadas con irradiación; y Figura 2D, la proteína c-myc. Figuras 3A-3F. Arterias humanas de ingeniería tisular representativas, 3 mm de diámetro interno. Tinción con hematoxilina y eosina de vasos sanguíneos de SMC normales (Figura 3A) y SMC con hTERT (Figura 3B). La tinción TUNEL de los vasos de SMC normales muestra una muerte celular muy extendida (Figura 3C) en contraste con los vasos de SMC con hTERT (Figura 3D); los núcleos oscuros son positivos. Figura 3E; la inmunotinción vWF revela una monocapa confluente de HUVEC en la luz (asterisco) de una arteria de SMC con hTERT. Figura 3F; Las transferencias de Western de arterias de SMC con hTERT (n=4) muestran la expresión de marcadores de SMC normales, similar a los vasos obtenidos de SMC normal (n=4). Escala: 0,5 mm en 1A, 1B; 100 μm en 1C-1E. Figura 4. Curvas de crecimiento de SMC obtenidas de donantes de 82 años de edad. Las SMC obtenidas de la vena safena muestran un periodo de vida prolongado después de la infección con hTERT. Las poblaciones de control y vectorial dejan de replicarse ambas a las 40 PD. Figura 5. Vaso humano de SMC de 82 años de edad. Resistencia a la rotura < 25 mm de Hg. Figuras 6A-6D. Vaso obtenido mediante ingeniería tisular, células vasculares ancianas. Figura 6A. Vaso obtenido mediante ingeniería tisular usando SMC vasculares de control y EC de un donante de 47 años de edad. Figura 6B. Vaso cultivado en condiciones idénticas, usando células de un donante de 47 años de edad que expresan hTERT. Figura 6C. Vaso cultivado de un donante de 67 años de edad. Figura 6D. Vaso cultivado de células de un donante de 67 años de edad, que expresan hTERT.
DESCRIPCIÓN DETALLADA DE LA INVENCIÓN Y REALIZACIONES PREFERIDAS
La presente invención se refiere a un método de producción de injertos vasculares. El método comprende introducir en las células un vector de expresión que comprende una secuencia de ácido nucleico que codifica un producto proteico que prolonga el periodo de vida y/o inmortalizador que tiene actividad catalítica de telomerasa, en condiciones tales que la secuencia se exprese y el producto proteico se produzca. Estas células pueden emplearse a continuación en el diseño de injertos vasculares.
Las células para su uso en este método son células constituyentes que comprenden células de músculo liso. Las células adecuadas para su uso en la invención pueden comprender además células epiteliales (de las cuales las células endoteliales (EC) son un subconjunto), fibroblastos, pericitos, cardiomiocitos y células del sistema nervioso. Las células pueden ser células vasculares completamente diferenciadas aisladas de un individuo. Como alternativa, las células pueden obtenerse de células madre o células progenitoras que se cultivan en condiciones tales que se diferencian en células vasculares. Las células para su uso en un método de la invención son células humanas. Ventajosamente, las células son células humanas obtenidas del receptor del injerto. Típicamente, las células son SMC no neonatales obtenidas de un individuo de cualquier edad.
Las células pueden recogerse de un paciente de una biopsia de una rama arterial o venosa periférica. La biopsia puede realizarse en cualquier punto del cuerpo del paciente que permita acceso a la vasculatura periférica; la parte superior del brazo y la parte inferior de la pierna son dos ejemplos. La técnica quirúrgica usada puede ser la descrita para la biopsia de la arteria temporal (Albertini et al, Dermatalogic Surgery...
Reivindicaciones:
1. Un método de producción de un injerto vascular que comprende: i) introducir en células constituyentes obtenidas de un ser humano, comprendiendo dichas células constituyentes células de músculo liso, una construcción que comprende una secuencia de ácido nucleico que codifica un producto proteico que prolonga el periodo de vida o inmortalizante que tiene actividad catalítica de telomerasa, en condiciones tales que dicha secuencia de ácido nucleico se exprese y, de este modo, se produzca dicho producto proteico, y
ii) modificar mediante ingeniería dichas células resultantes de la etapa
(i) en dicho injerto vascular.
2. El método de acuerdo con la reivindicación 1, en el que dichas células constituyentes comprenden además células seleccionadas entre el grupo constituido por células endoteliales, células epiteliales, fibroblastos, pericitos, cardiomiocitos y células del sistema nervioso.
3. El método de acuerdo con la reivindicación 1, en el que dichas células constituyentes comprenden además células endoteliales no neonatales.
4. El método de acuerdo con la reivindicación 1, en el que dicha secuencia de ácido nucleico es un gen celular de origen natural que muestra transcripción
o función alterada.
5. El método de acuerdo con la reivindicación 1, en el que dicha secuencia de ácido nucleico codifica una subunidad proteica catalítica de transcriptasa inversa de la telomerasa.
6. El método de acuerdo con la reivindicación 5, en el que dicha transcriptasa inversa de la telomerasa es transcriptasa inversa de la telomerasa humana (hTERT).
7. El método de acuerdo con la reivindicación 1, en el que dicho producto proteico no induce un fenotipo tumorigénico.
8. El método de acuerdo con la reivindicación 1, en el que dicha secuencia de ácido nucleico está presente en dicha construcción en unión operativa con un promotor funcional en dichas células constituyentes.
9. El método de acuerdo con la reivindicación 8, en el que dicho promotor es un promotor con alta tasa de transcripción.
10. El método de acuerdo con la reivindicación 9, en el que dicho promotor es un promotor viral o un promotor inducible por tetraciclina.
11. El método de acuerdo con la reivindicación 1, en el que dicha construcción es escindible.
12. El método de acuerdo con la reivindicación 11, en el que dicha construcción es escindible mediante recombinación específica de sitio.
13. El método de acuerdo con la reivindicación 12, en el que dicha construcción es escindible mediante recombinasa Cre.
14. El método de acuerdo con la reivindicación 1, en el que dicha construcción se introduce en dichas células constituyentes de forma transitoria.
15. El método de acuerdo con la reivindicación 14, en el que dicha introducción transitoria se realiza usando un vector adenoviral.
16. El método de acuerdo con la reivindicación 1, en el que dicha etapa (ii) comprende sembrar células resultantes de la etapa (i) en un soporte tubular y cultivar dichas células de modo que se forme dicho injerto vascular.
17. El método de acuerdo con la reivindicación 16, en el que dicho soporte tubular es un gel de colágeno desnaturalizado, un armazón sintético degradable o no degradable, un armazón de colágeno fibrilar o un armazón de matriz extracelular.
18. El método de acuerdo con la reivindicación 1, en el que dicha etapa (ii)
comprende cultivar células resultantes de la etapa (i) de modo que se produzca una lámina celular y enrollar dicha lámina para formar dicho injerto vascular.
19. Un injerto vascular aislado que comprende células de músculo liso
5 obtenidas de un ser humano y que comprende una molécula recombinante que comprende una secuencia de ácido nucleico que codifica un producto proteico que prolonga el periodo de vida o inmortalizante que tiene actividad catalítica de telomerasa.
20. El injerto de acuerdo con la reivindicación 19, en el que dicho producto proteico es hTERT.
21. El injerto vascular de acuerdo con la reivindicación 19 ó 20, para su uso en un método de tratamiento de un paciente con enfermedad aterosclerótica que comprende sustituir una parte enferma o dañada de la vasculatura de dicho paciente con dicho injerto.
22. Uso de un injerto vascular de acuerdo con la reivindicación 19 ó 20, en la fabricación de un medicamento para tratar a un paciente con enfermedad aterosclerótica, en el que el medicamento es para sustituir una parte enferma o dañada de la vasculatura de dicho paciente.
23. El uso de acuerdo con la reivindicación 22, en el que dicha secuencia de ácido nucleico se escinde antes de dicha sustitución.
Patentes similares o relacionadas:
 MÉTODO PARA PREPARAR CONSTRUCCIONES DE TEJIDOS, del 1 de Marzo de 2011, de ORGANOGENESIS INC.: Un método para producir una construcción tubular de tejidos, que comprende (i) permitir el contacto del borde de por lo menos una población […]
MÉTODO PARA PREPARAR CONSTRUCCIONES DE TEJIDOS, del 1 de Marzo de 2011, de ORGANOGENESIS INC.: Un método para producir una construcción tubular de tejidos, que comprende (i) permitir el contacto del borde de por lo menos una población […]
PROCEDIMIENTOS DE USO DE CÉLULAS REGENERATIVAS EN EL TRATAMIENTO DE TRASTORNOS Y ENFERMEDADES RENALES, del 3 de Febrero de 2011, de CYTORI THERAPEUTICS, INC: Uso de una composición que comprende células regenerativas derivadas de tejido adiposo en la fabricación de un medicamento para el tratamiento […]
 CELULAS MADRE ENDOTELIALES, POBLACIONES, METODOS DE AISLAMIENTO Y USO DE LAS MISMAS, del 30 de Junio de 2010, de IMMUNEX CORPORATION: Uso de un antibiótico específico para P1H12 para preparar una población enriquecida de células madre por medio de selección positiva a partir de una […]
CELULAS MADRE ENDOTELIALES, POBLACIONES, METODOS DE AISLAMIENTO Y USO DE LAS MISMAS, del 30 de Junio de 2010, de IMMUNEX CORPORATION: Uso de un antibiótico específico para P1H12 para preparar una población enriquecida de células madre por medio de selección positiva a partir de una […]
Selección y uso de cepas de bacilos tolerantes al frío como fitoestimuladores biológicos, del 8 de Julio de 2020, de Abitep GmbH: Composición para estimular el crecimiento de plantas de cultivo, caracterizada por el hecho de que contiene la cepa tolerante al frío Bacillus atrophaeus ABI02A […]
Ensifer adhaerens con actividad nematicida, del 24 de Junio de 2020, de Futureco Bioscience, S.A: Microorganismo de la especie Ensifer adhaerens que tiene actividad nematicida sobre un nematodo del género Meloidogyne, en el que el microorganismo se selecciona del grupo […]
Terapia génica basada en VAA para la esclerosis múltiple, del 3 de Junio de 2020, de UNIVERSITY OF FLORIDA RESEARCH FOUNDATION, INC.: Un vector de ácido nucleico vírico adenoasociado recombinante (VAAr) con el serotipo VAA8 que comprende: un polinucleótido que incluye un segmento de ácido […]
Composición de ácaros y su uso como agente de control biológico, del 27 de Mayo de 2020, de AGROBIO, S.L: Un método para proteger un cultivo mediante el aporte de al menos una población reproductiva de una especie de ácaro depredador de la familia Phytoseiidae […]
Estimulación de la vía wnt en la reprogramación de células somáticas, del 20 de Mayo de 2020, de WHITEHEAD INSTITUTE FOR BIOMEDICAL RESEARCH: Un método de reprogramación de una célula somática de mamífero, que comprende: (a) poner en contacto la célula somática de mamífero con un activador de la vía Wnt seleccionado […]