FORMULACIÓN TERAPEÚTICA PARA ADMINISTRAR TOLTERODINA CON LIBERACIÓN CONTROLADA.
Uso de tolterodina, su metabolito 5-hidroximetilo o el racemato correspondiente a tolterodina o una sal farmacéuticamente aceptable de los mismos,
en la fabricación de un medicamento para el tratamiento de vejiga urinaria inestable o hiperactiva, en el que el medicamento está en forma de una formulación de liberación controlada oral capaz de mantener un nivel en suero sustancialmente constante del resto o los restos activos durante al menos 24 horas, de modo que la formulación de liberación controlada proporcione un índice de fluctuación medio de dicho nivel en suero del resto o los restos activos que no es mayor de 2,0, definiéndose dicho índice de fluctuación, FI, como FI = (Cmáx - Cmín)/AUCτ/τ, en la que Cmáx y Cmín son las concentraciones máxima y mínima, respectivamente, de los restos activos AUCτ es el área bajo el perfil de concentración en suero y τ es la longitud del intervalo de dosificación
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/SE1999/001463.
Solicitante: PFIZER HEALTH AB.
Nacionalidad solicitante: Suecia.
Dirección: LILLSJONASVAGEN 11 S-167 35 BROMMA SUECIA.
Inventor/es: NILVEBRANT, LISBETH, HALLEN, BENGT, OLSSON, BIRGITTA, GREN, TORKEL, RINGBERG, ANDERS, WIKBERG, MARTIN, HOECK, ULLA, KRISTENSEN, HELLE, ORUP-JACOBSEN, LENE, KREILG RD,BO, STRÖMBOM,Jan.
Fecha de Publicación: .
Fecha Solicitud PCT: 26 de Agosto de 1999.
Clasificación Internacional de Patentes:
- A61K9/50K2
- A61K9/70E
Clasificación PCT:
- A61K31/135 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen ciclos aromáticos, p. ej. metadona.
- A61K9/22 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › del tipo de liberación prolongada o discontinua.
- A61K9/52 A61K 9/00 […] › del tipo con liberación prolongada o discontinua.
- A61K9/70 A61K 9/00 […] › Bases para tiras, hojas o filamentos.
- A61P13/10 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 13/00 Medicamentos para el tratamiento del aparato urinario (diuréticos A61P 7/10). › de la vejiga.
Clasificación antigua:
- A61K31/135 A61K 31/00 […] › que tienen ciclos aromáticos, p. ej. metadona.
- A61K9/22 A61K 9/00 […] › del tipo de liberación prolongada o discontinua.
- A61K9/52 A61K 9/00 […] › del tipo con liberación prolongada o discontinua.
- A61K9/70 A61K 9/00 […] › Bases para tiras, hojas o filamentos.
- A61P13/10 A61P 13/00 […] › de la vejiga.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
La presente invención se refiere a un procedimiento mejorado para tratar la vejiga urinaria inestable o hiperactiva así como una formulación del mismo.
Una parte sustancial (5-10%) de la población adulta padece incontinencia urinaria y la prevalencia, particularmente de la denominada incontinencia de urgencia, aumenta con la edad. Los síntomas de una vejiga inestable o hiperactiva comprenden incontinencia de urgencia, tenesmo urinario y frecuencia urinaria. Se asume que una vejiga inestable o hiperactiva está causada por contracciones incontroladas de los haces de fibras musculares lisas que forman el revestimiento muscular de la vejiga urinaria (el músculo detrusor) durante la fase de llenado de la vejiga. Estas contracciones están controladas principalmente por receptores muscarínicos colinérgicos y el tratamiento farmacológico de vejiga inestable o hiperactiva se ha basado en los antagonistas del receptor muscarínico. El fármaco seleccionado durante mucho tiempo ha sido oxibutinina.
La oxibutinina, que químicamente es la forma DL-racémica de 4-dietilamino-2-butinilfenilciclohexilglicolato, se administra por vía oral, habitualmente como un comprimido o un jarabe. La oxibutinina, administrada habitualmente como la sal de cloruro, se metaboliza en un metabolito activo, N-desetil-oxibutinina. El fármaco se absorbe rápidamente desde el tracto gastrointestinal después de la administración y tiene una duración de tres a seis horas. Aunque la eficacia de la oxibutinina está bien documentada, su utilidad está limitada por los efectos secundarios clásicos de los antimuscarínicos, particularmente xerostomía, que con frecuencia conduce a la interrupción de tratamiento.
El documento WO 96/12477 desvela un sistema de suministro de liberación controlada para oxibutinina, sistema de suministro del que se dice que no sólo es conveniente para el paciente por la reducción de la administración a un régimen de una vez diaria, sino también para reducir los efectos secundarios nocivos mediante la limitación de las concentraciones máximas iniciales de oxobutinina y de metabolitos activos en la sangre del paciente.
El supuesto alivio de los efectos secundarios por la reducción o eliminación de las concentraciones máximas a través de la administración del sistema de suministro de liberación controlada se contradice, sin embargo, con un informe clínico publicado posteriormente, Nilsson, C. G., y col., Neurourology and Urodynamics 16 (1997) 533-542, que describe ensayos clínicos realizados con el sistema de suministro de liberación controlada desvelado en el documento WO 96/12477, anterior. En los ensayos clínicos indicados, se comparó un comprimido de oxibutinina de liberación controlada de 10 mg con la administración de un comprimido convencional (liberación inmediata) de 5 mg suministrado dos veces al día a pacientes con incontinencia de urgencia. Aunque los niveles altos máximos del fármaco obviamente se eliminaron con el comprimido de oxibutinina de liberación controlada, no se observó diferencia en los efectos secundarios entre el comprimido de liberación controlada y el comprimido convencional. La ventaja del comprimido de liberación controlada residía por lo tanto meramente en la mejora del seguimiento del tratamiento debida a su dosificación una vez al día más que reducir además los efectos secundarios como se indicaba en el documento WO 96/12477.
Recientemente, ha salido al mercado un antagonista del receptor muscarínico mejorado, tolterodina, (R)-N,N-diisopropil-3-(2-hidroxi-5-metilfenil)-3-fenilpropanamina para el tratamiento de la incontinencia de urgencia y otros síntomas de la vejiga urinaria inestable o hiperactiva. Tanto tolterodina como su principal metabolito activo el derivado 5-hidroximetilo de tolterodina, que contribuye significativamente al efecto terapéutico, tienen considerablemente menos efectos secundarios que la oxibutinina, especialmente en relación a la propensión a causar xerostomía. Aunque la tolterodina es equipotente con la oxibutinina en la vejiga, su afinidad por los receptores muscarínicos de la glándula salival es ocho veces menor que la de oxibutinina, véase, por ejemplo Nilvebrant, L., y col., European Journal of Pharmacology 327 (1997) 195-207. El efecto selectivo de tolterodina en seres humanos se describe en Stahi, M.
M. S., y col., Neurourology and Urodynamics 14 (1995) 647-655, y Bryne, N., International Journal of Clinical Pharmacology and Therapeutics, Vol. 35, No. 7 (1995) 287-295.
La forma de administración de tolterodina disponible actualmente es en comprimidos revestidos de película que contienen 1 mg o 2 mg de tolterodina L-tartrato para liberación inmediata en el tracto gastrointestinal, siendo la dosis recomendada habitualmente de 2 mg dos veces al día. Aunque, como se ha mencionado, los efectos secundarios, tales como la xerostomía, son mucho menores que para oxibutinina, aún existen, especialmente a dosificaciones más altas.
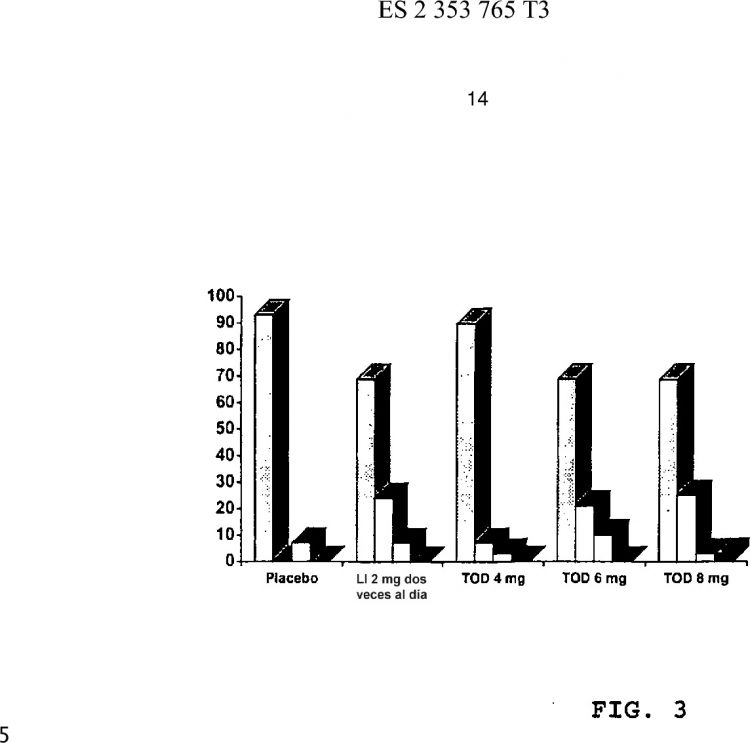
De acuerdo con la presente invención se ha descubierto ahora sorprendentemente que, al contrario que en el caso de la oxibutinina, la eliminación sustancial de los niveles máximos en suero de tolterodina y su metabolito activo a través de la liberación controlada de tolterodina durante un periodo prolongado de tiempo, tal como a través de una forma de administración de una vez diaria, manteniendo aún el efecto deseado en la vejiga, proporciona de hecho una reducción significativa de los efectos secundarios (ya bajos), particularmente xerostomía, en comparación con los obtenidos para la misma dosificación total de los comprimidos de liberación inmediata durante el mismo periodo. En otras palabras, la eliminación de los niveles máximos en suero del resto activo afecta a los efectos adversos y particularmente la xerostomía, más que el efecto deseado en la actividad del detrusor, simultáneamente a la vez que la nivelación de la concentración en suero no conduce a una pérdida de actividad o una incidencia disminuida de retención urinaria u otros problemas de seguridad. Así pues, además de la ventaja de conveniencia de la administración de liberación controlada, se puede (i) para un dosis total dada de tolterodina, reducir los efectos secundarios, tales como xerostomía o (ii) para un nivel dado de efectos secundarios aceptables, aumentar la dosificación de tolterodina para obtener un efecto aumentado en la vejiga, si se desea.
En un aspecto, la presente invención proporciona por lo tanto el uso de tolterodina, su metabolito 5-hidroximetilo o el racemato correspondiente a tolterodina o una sal farmacéuticamente aceptable de los mismos, en la fabricación de un medicamento para el tratamiento de vejiga urinaria inestable o hiperactiva, en el que el medicamento está en forma de una formulación de liberación controlada oral capaz de mantener un nivel sustancialmente constante en suero del resto o restos activos durante al menos 24 horas, de modo que la formulación de liberación controlada proporciona un índice de fluctuación media de dicho nivel en suero del resto o restos activos que no es mayor de 2,0, definiéndose dicho índice de fluctuación, FI, como FI = (Cmáx-Cmín)/AUCτ/τ, en el que Cmáx y Cmín son las concentraciones máxima y mínima, respectivamente, de restos activos, AUCτ es el área bajo el perfil de concentración en suero y τ es la longitud del intervalo de dosificación.
La vejiga urinaria hiperactiva abarca inestabilidad del detrusor, hiperreflexia del detrusor, incontinencia de urgencia, tenesmo urinario y frecuencia urinaria.
Como se ha mencionado anteriormente, el nombre químico de tolterodina es (R)-N,Ndiisopropil-3-(2-hidroxi-5-metilfenil)-3-fenilpropanamina. El principal metabolito activo de tolterodina es (R)-N,N-diisopropil-3-(2-hidroxi-5-hidroximetilfenil)-3-fenilpropanamina; el (S)enantiómero correspondiente de tolterodina es (S)-N,N-diisopropil-3-(2-hidroxi-5-metilfenil)-3fenilpropanamina; el metabolito 5-hidroximetilo del (S)-enantiómero es (S)-N,N-diisopropil-3-(2hidroxi-5-hidroximetilfenil)-3-fenilpropanamina; y el racemato correspondiente de tolterodina es (R,S)-N,N-diisopropil-3-(2-hidroxi-5-metilfenil)-3-fenilpropanamina.
Por la expresión “resto o restos activos” se entiende la suma de concentraciones libres
o no unidas (es decir no unidas a proteína) de (i) tolterodina y el metabolito activo de la misma, cuando se administra tolterodina; o (ii) tolterodina y el metabolito activo de la misma y/o (S)enantiómero de tolterodina y el metabolito activo del mismo, cuando se administra el racemato correspondiente; o (iii) el metabolito...
Reivindicaciones:
1. Uso de tolterodina, su metabolito 5-hidroximetilo o el racemato correspondiente a tolterodina o una sal farmacéuticamente aceptable de los mismos, en la fabricación de un medicamento para el tratamiento de vejiga urinaria inestable o hiperactiva, en el que el medicamento está en forma de una formulación de liberación controlada oral capaz de mantener un nivel en suero sustancialmente constante del resto o los restos activos durante al menos 24 horas, de modo que la formulación de liberación controlada proporcione un índice de fluctuación medio de dicho nivel en suero del resto o los restos activos que no es mayor de 2,0, definiéndose dicho índice de fluctuación, FI, como FI = (Cmáx – Cmín)/AUCτ/τ, en la que Cmáx y Cmín son las concentraciones máxima y mínima, respectivamente, de los restos activos AUCτ es el área bajo el perfil de concentración en suero y τ es la longitud del intervalo de dosificación.
2. El uso de acuerdo con la reivindicación 1, en el que el índice de fluctuación no es mayor que 1,0.
3. El uso de acuerdo con la reivindicación 1 o reivindicación 2, en el que el medicamento proporciona un perfil en suero de 24 horas expresado como la AUC de tolterodina no unida y metabolito 5-hidroximetilo, que es de 5 a 150 nM*h.
4. El uso de acuerdo con la reivindicación 1, 2 ó 3, en el que el medicamento proporciona un nivel en suero de tolterodina no unida y metabolito 5-hidroximetilo que esté en el intervalo de 0,2 a 6,3 nM.
5. El uso de acuerdo con una cualquiera de las reivindicaciones 1 a 4, en el que la formulación de liberación controlada es una cápsula o comprimido para administración oral una vez al día.
6. El uso de acuerdo con una cualquiera de las reivindicaciones 1 a 5, en el que el medicamento contiene tolterodina o una sal farmacéuticamente aceptable de la misma.
7. El uso de acuerdo con una cualquiera de las reivindicaciones 1 a 6, en el que el medicamento es para el tratamiento de la incontinencia urinaria.
8. Una formulación de liberación controlada oral farmacéutica que contiene tolterodina, su metabolito 5-hidroximetilo o el racemato correspondiente a tolterodina o una sal farmacéuticamente aceptable de los mismos, cuya formulación cuando se administra a un paciente proporciona liberación controlada de tolterodina, su metabolito de 5-hidroximetilo o el racemato correspondiente a tolterodina o una sal farmacéuticamente aceptable de los mismos, de modo que se mantiene un nivel en suero sustancialmente constante del resto o los restos activos durante al menos 24 horas, por lo cual proporciona un índice de fluctuación media de dicho nivel en suero del resto o los restos activos que no es mayor de 2,0, definiéndose dicho índice de fluctuación, FI, como FI = (Cmáx – Cmín)/AUCτ/τ, en la que Cmáx y Cmín son las concentraciones máxima y mínima, respectivamente, del resto o los restos activos, AUCτ es el área bajo el perfil de concentración en suero y τ es la longitud del intervalo de dosificación.
9. La formulación de acuerdo con la reivindicación 8, que proporciona un índice de fluctuación no mayor de 1,0.
10. La formulación de acuerdo con la reivindicación 8 ó 9, en la que el perfil en suero de 24 horas, expresado como la AUC de tolterodina no unida y metabolito 5-hidroximetilo, es de 5 a 150 nM*h.
11. La formulación de acuerdo con la reivindicación 8, 9 ó 10, en la que el nivel en suero de tolterodina no unida y metabolito 5-hidroximetilo está en el intervalo de 0,2 a 6,3 nM.
12. La formulación de acuerdo con una cualquiera de las reivindicaciones 8 a 11, que es una cápsula o un comprimido para administración oral una vez al día.
13. La formulación de acuerdo con una cualquiera de las reivindicaciones 8 a 12, que proporciona liberación controlada de tolterodina o una sal farmacéuticamente aceptable de la misma.
Patentes similares o relacionadas:
 FORMULACIÓN QUE COMPRENDE UNA MEZCLA EUTÉCTICA DE TETRACAÍNA Y LIDOCAÍNA, del 25 de Abril de 2011, de ZARS Pharma, Inc: SE DESCRIBE UN APARATO, UN FORMULADO DE PRODUCTO Y UN PROCEDIMIENTO PARA UNA PERMEACION DERMICA MEJORADA DE PRODUCTOS FARMACEUTICOS, INCLUYENDO EL APARATO UN DEPOSITO DE FORMULADO […]
FORMULACIÓN QUE COMPRENDE UNA MEZCLA EUTÉCTICA DE TETRACAÍNA Y LIDOCAÍNA, del 25 de Abril de 2011, de ZARS Pharma, Inc: SE DESCRIBE UN APARATO, UN FORMULADO DE PRODUCTO Y UN PROCEDIMIENTO PARA UNA PERMEACION DERMICA MEJORADA DE PRODUCTOS FARMACEUTICOS, INCLUYENDO EL APARATO UN DEPOSITO DE FORMULADO […]
 DISPOSITIVO, SISTEMA Y MÉTODO QUE COMPRENDE UN DADOR DE PROTONES MICROENCAPSULADO PARA LIBERAR ÓXIDO NÍTRICO DE UN POLÍMERO, del 15 de Febrero de 2011, de NOLABS AB: Un dispositivo médico, que comprende un polímero de elución de óxido nítrico (NO) configurado para la elución de óxido nítrico (NO) desde […]
DISPOSITIVO, SISTEMA Y MÉTODO QUE COMPRENDE UN DADOR DE PROTONES MICROENCAPSULADO PARA LIBERAR ÓXIDO NÍTRICO DE UN POLÍMERO, del 15 de Febrero de 2011, de NOLABS AB: Un dispositivo médico, que comprende un polímero de elución de óxido nítrico (NO) configurado para la elución de óxido nítrico (NO) desde […]
 ALMOHADILLA CON UNA CAPA DE GEL QUE TIENE ACTIVIDAD TERAPEUTICA O COSMETICA, del 4 de Noviembre de 2010, de BIOFARM S.R.L.: Almohadilla para aplicación a la piel humana para uso en el desarrollo de una acción descongestiva, cosmética y/o farmacéutica caracterizado porque consiste en un soporte […]
ALMOHADILLA CON UNA CAPA DE GEL QUE TIENE ACTIVIDAD TERAPEUTICA O COSMETICA, del 4 de Noviembre de 2010, de BIOFARM S.R.L.: Almohadilla para aplicación a la piel humana para uso en el desarrollo de una acción descongestiva, cosmética y/o farmacéutica caracterizado porque consiste en un soporte […]
 MATERIAL PARA LA FORMACION DE UNA PREPARACION EXTERNA DE DIOXIDO DE CARBONO, del 2 de Septiembre de 2010, de NEOCHEMIR, INC.: Un material para la formación de una preparación externa de dióxido de carbono que comprende:
- un agente de base que comprende una estructura de red tridimensional polimérica […]
MATERIAL PARA LA FORMACION DE UNA PREPARACION EXTERNA DE DIOXIDO DE CARBONO, del 2 de Septiembre de 2010, de NEOCHEMIR, INC.: Un material para la formación de una preparación externa de dióxido de carbono que comprende:
- un agente de base que comprende una estructura de red tridimensional polimérica […]
 SISTEMA DE ILUMINACION PARA FORMA DE DOSIFICACION TRANSDERMICA, del 2 de Julio de 2010, de EURO-CELTIQUE S.A.: Artículo desechable que comprende: (A) una capa exterior que tiene un lado encarado a una capa interior y un lado opuesto; (B) una capa interior que tiene […]
SISTEMA DE ILUMINACION PARA FORMA DE DOSIFICACION TRANSDERMICA, del 2 de Julio de 2010, de EURO-CELTIQUE S.A.: Artículo desechable que comprende: (A) una capa exterior que tiene un lado encarado a una capa interior y un lado opuesto; (B) una capa interior que tiene […]
![]() SISTEMA Y PROCEDIMIENTO DE ADMINISTRACION DE ANTICONCEPTIVOS TRANSDERMICA MEJORADO, del 13 de Mayo de 2010, de AGILE THERAPEUTICS, INC: Un sistema de administración de anticonceptivos transdérmico que comprende una capa de respaldo y una matriz polimérica adhesiva fija a la capa […]
SISTEMA Y PROCEDIMIENTO DE ADMINISTRACION DE ANTICONCEPTIVOS TRANSDERMICA MEJORADO, del 13 de Mayo de 2010, de AGILE THERAPEUTICS, INC: Un sistema de administración de anticonceptivos transdérmico que comprende una capa de respaldo y una matriz polimérica adhesiva fija a la capa […]
 PROCEDIMIENTO Y DISPOSITIVO PARA EL MEJORAMIENTO DE LA PERMEABILIDAD DE LA PIEL HUMANA, del 12 de Mayo de 2010, de LTS LOHMANN THERAPIE-SYSTEME AG: Parche para la aportación por vía transdérmica de sustancias activas, con por lo menos una capa de cubrimiento y por lo menos una capa autoadhesiva, que contiene […]
PROCEDIMIENTO Y DISPOSITIVO PARA EL MEJORAMIENTO DE LA PERMEABILIDAD DE LA PIEL HUMANA, del 12 de Mayo de 2010, de LTS LOHMANN THERAPIE-SYSTEME AG: Parche para la aportación por vía transdérmica de sustancias activas, con por lo menos una capa de cubrimiento y por lo menos una capa autoadhesiva, que contiene […]
PREPARACIÓN FARMACÉUTICA PARA LA ADMINISTRACIÓN ORAL CON LIBERACIÓN CONTROLADA DE PRINCIPIO ACTIVO EN EL INTESTINO DELGADO Y PROCEDIMIENTO PARA SU PREPARACIÓN, del 14 de Febrero de 2012, de DR. R. PFLEGER CHEMISCHE FABRIK GMBH: Preparación farmacéutica para la administración oral con liberación controlada de principio activo en el intestino delgado, basada en vehículos […]