FORMULACIÓN QUE COMPRENDE UNA MEZCLA EUTÉCTICA DE TETRACAÍNA Y LIDOCAÍNA.
SE DESCRIBE UN APARATO, UN FORMULADO DE PRODUCTO Y UN PROCEDIMIENTO PARA UNA PERMEACION DERMICA MEJORADA DE PRODUCTOS FARMACEUTICOS,
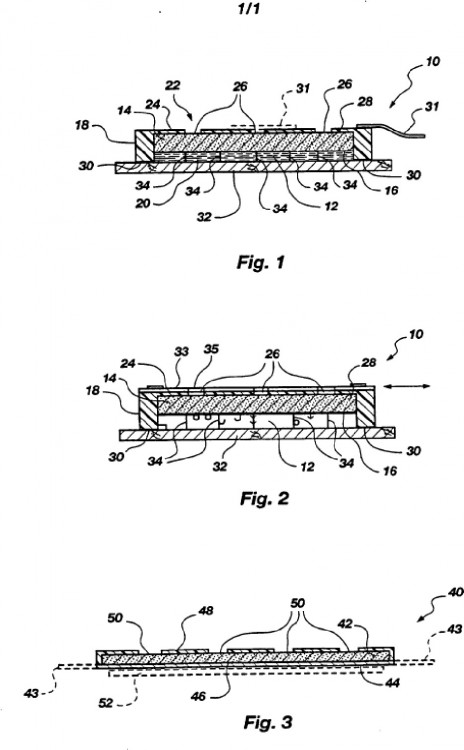
INCLUYENDO EL APARATO UN DEPOSITO DE FORMULADO DEL FARMACO DELGADO Y UNA CAMARA GENERADORA DE CALOR, SEPARADOS MEDIANTE UNA PRIMERA PARED NO PERMEABLE, ESTANDO EL DEPOSITO Y LA CAMARA FORMADOS SOBRE UNA CUBIERTA O SOPORTADOS POR ESTA. EL DEPOSITO DE FORMULADO DEL FARMACO ALBERGA O ES CAPAZ DE ALBERGAR UNA CANTIDAD PREDETERMINADA DE UN FORMULADO QUE CONTIENE UN AGENTE(S) FARMACEUTICAMENTE ACTIVO. LA CAMARA GENERADORA DE CALOR/REGULADORA DE LA TEMPERATURA INCLUYE UN MEDIO PARA GENERAR CALOR CONTROLADO, PREFERIBLEMENTE UNA COMPOSICION QUIMICA PREPARADA CON CARBONO, HIERRO, AGUA Y/O SAL, QUE SE ACTIVA POR CONTACTO CON EL AIRE (OXIGENO). LA FUNCION DEL ELEMENTO GENERADOR DE CALOR/REGULADOR DE LA TEMPERATURA ES CALENTAR LA PIEL DEL USUARIO, LLEVANDO LA TEMPERATURA DE LA PIEL RAPIDAMENTE HASTA UN INTERVALO ESTRECHO Y DESEADO, Y MANTENERLA DENTRO DE ESTE INTERVALO DURANTE UN TIEMPO SUFICIENTE PARA OBTENER UNA ABSORCION DERMICA MAS RAPIDA, MEJORADA Y MENOS VARIABLE DE LOS AGENTES FARMACEUTICAMENTE ACTIVOS SELECCIONADOS, Y PARA OBTENER UNOS EFECTOS CLINICOS MEJORADOS. TAMBIEN SE DESCRIBE UNA ESTRUCTURA PARA CONTROLAR LA GENERACION DE CALOR. EL APARATO PUEDE INCLUIR OPCIONALMENTE UNA ESTRUCTURA ESPACIADORA O DISTANCIADORA QUE EXTIENDE EL DEPOSITO DE FORMULADO DEL FARMACO ENTRE LA PARED NO PERMEABLE Y LA SUPERFICIE DE LA PIEL DEL USUARIO PARA MANTENER UN ESPESOR PREDETERMINADO DEL FORMULADO DEL FARMACO SOBRE LA SUPERFICIE DE LA PIEL DEL USUARIO. ADEMAS SE DESCRIBE UN NUEVO FORMULADO DE PRODUCTO QUE PUEDE UTILIZARSE CON EL APARATO, QUE EMPLEA UN ELEVADO PORCENTAJE DE UNA MEZCLA EUTECTICA DE ANESTESICOS LOCALES PARA REDUCIR LA VELOCIDAD DE DEGRADACION GLOBAL DEL COMPUESTO(S) ANESTESICO LOCAL EN LOS FORMULADOS QUE SUFREN HIDROLISIS
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US1996/012319.
Solicitante: ZARS Pharma, Inc.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1455 West 2200 South Salt Lake City, UT 84119.
Inventor/es: ZHANG, JIE, ZHANG, HAO.
Fecha de Publicación: .
Fecha Solicitud PCT: 26 de Julio de 1996.
Clasificación Internacional de Patentes:
- A61F7/03D2
- A61K31/167 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › teniendo el átomo de nitrogeno de un grupo carboxiamida unido directamente al ciclo aromático, p. ej. lidocaina, paracetamol.
- A61K31/216 A61K 31/00 […] › de ácidos que tienen ciclos aromáticos, p. ej. benacticina, clofibrato.
- A61K31/245 A61K 31/00 […] › del tipo ácido aminobenzoico, p. ej. procaína, novocaína (ésteres del ácido salicílico A61K 31/60).
- A61K9/70E
Clasificación PCT:
- A61K31/167 A61K 31/00 […] › teniendo el átomo de nitrogeno de un grupo carboxiamida unido directamente al ciclo aromático, p. ej. lidocaina, paracetamol.
- A61K31/216 A61K 31/00 […] › de ácidos que tienen ciclos aromáticos, p. ej. benacticina, clofibrato.
- A61K31/245 A61K 31/00 […] › del tipo ácido aminobenzoico, p. ej. procaína, novocaína (ésteres del ácido salicílico A61K 31/60).
- A61P23/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Anestésicos.
- A61P23/02 A61P […] › A61P 23/00 Anestésicos. › Anestésicos locales.
Clasificación antigua:
- A61F13/00 A61 […] › A61F FILTROS IMPLANTABLES EN LOS VASOS SANGUINEOS; PROTESIS; DISPOSITIVOS QUE MANTIENEN LA LUZ O QUE EVITAN EL COLAPSO DE ESTRUCTURAS TUBULARES, p. ej. STENTS; DISPOSITIVOS DE ORTOPEDIA, CURA O PARA LA CONTRACEPCION; FOMENTACION; TRATAMIENTO O PROTECCION DE OJOS Y OIDOS; VENDAJES, APOSITOS O COMPRESAS ABSORBENTES; BOTIQUINES DE PRIMEROS AUXILIOS (prótesis dentales A61C). › Vendas o apósitos (suspensorios A61F 5/40; apósitos radiactivos A61M 36/14 ); Compresas absorbentes (aspectos químicos de las vendas, apósitos o compresas absorbentes* A61L 15/00, A61L 26/00).
Países PCT: Austria, Bélgica, Suiza, Alemania, España, Francia, Reino Unido, Italia, Liechtensein, Países Bajos, Suecia.
PDF original: ES-2357378_T3.pdf
Fragmento de la descripción:
Campo técnico. La presente invención se refiere a formulaciones novedosas de agentes farmacéuticamente activos y más particularmente a formulaciones para obtener anestesia de la piel no invasiva rápida, intensificada y menos variable antes de procedimientos médicos dolorosos, tales como inyecciones, canulaciones, injertos de piel, biopsias, cirugías menores superficiales, y similares. 5 Técnica anterior. La administración dérmica, tópica, de fármacos se conoce desde hace tiempo en la práctica de la medicina. (Para los fines de esta solicitud, los términos “dérmico” y “piel” se refieren a mucosa y piel humana a través de o en la que se suministran los agentes farmacéuticamente activos. Estos agentes farmacéuticamente activos incluyen fármacos dirigidos de manera tópica, regional o sistémica). A principios de la década de 1970, comenzaron a expedirse patentes que se referían a sistemas de suministro de fármacos 10 transdérmicos avanzados. Estos dispositivos estaban diseñados para contener uno o más fármacos y se adherían al usuario de manera que el/los fármaco(s) entraba(n) en contacto con la piel del usuario para la absorción de dicho(s) fármacos(s). A principios de la década de 1980, se desarrollaron sistemas más avanzados, tales como la patente estadounidense n.º 4.286.592 expedida el 1 de septiembre de 1981 a Chandrasekaran. Esta patente muestra un 15 vendaje para administrar fármacos en la piel de un usuario que consiste en una capa de refuerzo impermeable, una capa de depósito de fármaco compuesta por un fármaco y un vehículo, y una capa adhesiva de contacto mediante la cual el vendaje se adhiere a la piel. Se sabe que la temperatura elevada puede aumentar la absorción de fármacos a través de la piel. Por tanto, es concebible que la temperatura variable de la piel pueda provocar una absorción variable de los fármacos en 20 los sistemas de suministro de fármacos dérmicos, fenómeno que podría provocar perfiles clínicos variables, tales como un tiempo de comienzo variable. Hasta la fecha, la minimización de la variabilidad en la absorción de fármacos en la piel se ha logrado principalmente mediante el uso de membranas limitadoras de la velocidad, y ninguna técnica anterior conocida ha intentado minimizar la variabilidad de la absorción dérmica de fármacos mediante la regulación de la temperatura de la piel. La patente estadounidense n.º 4.898.592 expedida el 6 de febrero de 1990 a Latzke et 25 al. se refiere a un dispositivo para la aplicación de principios activos calentados que pueden absorberse de manera transdérmica que incluye un vehículo impregnado con un principio activo que puede absorberse de manera transdérmica y un soporte. El soporte es un material laminado constituido por una o más capas poliméricas e incluye opcionalmente un elemento termoconductor. Este elemento termoconductor se usa para la distribución del calor corporal del paciente de manera que se intensifica la absorción del principio activo. Sin embargo, este dispositivo no 30 tiene ningún elemento o función generador de calor. Por tanto, el uso de este elemento termoconductor para distribuir el calor corporal no es un método eficaz o fiable para intensificar la absorción transdérmica mediante calentamiento dado que la cantidad de calor corporal producido por un paciente puede variar dependiendo de la temperatura del aire ambiente y las condiciones físicas del paciente. La patente estadounidense n.º 4.747.841, expedida el 31 de mayo de 1988 a Kuratomi et al., da a conocer 35 un método y aparato para la moxibustión que usa un elemento generador de calor para calentar y vaporizar “moxa” para el tratamiento de la piel de un paciente sin dejar cicatrices de quemaduras. Además, el centro de atención en esta patente es lograr la estimulación térmica del cuerpo y no aumentar la permeabilidad de la piel. Esta enseñanza de la estimulación térmica del cuerpo es contraria a la presente invención, en la que debe minimizarse la estimulación del cuerpo, particularmente con pacientes pediátricos. Finalmente, la referencia se aparta de la 40 enseñanza del calentamiento de la piel a menor temperatura puesto que no utiliza completamente los componentes de moxa. La patente estadounidense n.º 4.230.105, expedida el 28 de octubre de 1980 a Harwood, da a conocer un vendaje con un fármaco y una sustancia generadora de calor, preferiblemente entremezclados, para mejorar la velocidad de absorción del fármaco por la piel de un usuario. También se dan a conocer capas de fármaco y de 45 sustancia generadora de calor separadas. Debe aplicarse agua al vendaje para activar la sustancia de calentamiento. Además, el procedimiento de hidratación dado a conocer en esta patente produce mucha menos energía por unidad de masa que el medio generador de calor de la presente invención. También genera la mayor parte de su calor en un tiempo relativamente corto (en comparación con el medio empleado en la presente invención) y por tanto no puede proporcionar calor estable para una duración prolongada. Tampoco puede regular la 50 temperatura de la piel en un intervalo deseado para una duración prolongada. Una vez activado, no puede controlarse la temperatura de calentamiento. La patente estadounidense n.º 4.685.911, expedida el 11 de agosto de 1987 a Konno et al., da a conocer un parche dérmico que incluye un componente de fármaco, y un elemento de calentamiento opcional para fundir la formulación que contiene fármaco si la temperatura corporal es inadecuada para hacerlo. El elemento de 55 calentamiento no es sustancialmente coextensivo con el depósito de fármaco, siendo el último bastante espeso y por tanto no es susceptible de un comienzo uniforme y rápido del calentamiento.
Es deseable anestesiar de manera no invasiva la piel antes de algunos procedimientos médicos dolorosos, tales como inyecciones, canulaciones, injertos de piel, biopsias, cirugías superficiales menores, y similares. Para
estos fines se usa ampliamente EMLA™ (Eutectic Mixture of Local Anesthetics, (mezcla eutéctica de anestésicos locales)), una formulación de lidocaína-prilocaína producida por Astra. Generalmente, se aplica como crema, entonces se cubre con un vendaje de plástico (sistema crema-más-cubierta). El tiempo de comienzo de EMLA (en esta solicitud, la expresión “tiempo de comienzo” se define como el tiempo entre el inicio de la administración del sistema de suministro de fármacos y el comienzo del efecto clínico deseado) en la mayoría de los casos oscila 5 desde aproximadamente 45 minutos hasta 90 minutos, o incluso más, dependiendo del individuo y de la posición y el estado de la piel. Este tiempo de comienzo largo y bastante variable puede provocar una espera prolongada y difícil de predecir por parte de los pacientes, los médicos y las enfermeras en muchas situaciones. El tiempo de comienzo largo y altamente variable de EMLA se debe probablemente a los dos agentes anestésicos locales (lidocaína y prilocaína) usados, así como a la falta de calentamiento y control de la temperatura 10 de la piel. Se cree que la tetracaína es significativamente mejor que la lidocaína en la producción de la anestesia de la piel de profundidad total, pero está sujeta a degradación hidrolítica significativa. Se comentó una mezcla eutéctica de tetracaína/lidocaína en la patente estadounidense 4.529.601 (la “patente '601”) expedida el 16 de julio de 1985, pero no se reivindicó. McCafferty et al. en sus publicaciones y patentes [PCT/GB88/00416; GB2163956; Br. J. Anaesth. 60:64 15 (1988); 61:589 (1988), 62:17(1989), 71:370 (1993)] mencionaron varios sistemas y formulaciones para la anestesia de la piel no invasiva, y comentaron las ventajas de un sistema de parche sobre un sistema de crema-más-cubierta. Declararon que una preparación eficaz debe contener la concentración mínima de anestésico local acorde con la producción del efecto clínico deseado, y que los tiempos de comienzo no puedan reducirse más mediante el aumento de las concentraciones de anestésico local en sus formulaciones tras pasar determinada concentración. 20 Además, ninguno de los sistemas de la técnica anterior para la anestesia de la piel no invasiva tiene un elemento o mecanismo para regular y aumentar la temperatura de la piel. La temperatura de la piel baja y no controlada puede conducir a un tiempo de comienzo lento y ampliamente variable del efecto anestésico. Esto se debe a que las permeabilidades de la piel de fármacos se ven generalmente influenciadas en gran medida por la temperatura de la piel que se ve afectada por la temperatura ambiente y el estado físico del usuario, y por tanto 25 puede ser bastante variable si no se controla. Por tanto, sería ventajoso desarrollar un aparato... [Seguir leyendo]
Reivindicaciones:
1. Formulación para la velocidad de degradación total reducida de determinado(s) anestésico(s) local(es) y anestesia dérmica no invasiva mejorada que comprende: una emulsión con una fase oleosa y una fase acuosa; y
al menos un compuesto que es un agente emulsionante, agente gelificante, o agente espesante; en la que 5 dicha fase oleosa es una mezcla eutéctica de tetracaína y lidocaína, en la que el porcentaje en peso de dicha mezcla eutéctica en dicha formulación es de aproximadamente el 6% en peso o mayor.
2. Formulación según la reivindicación 1, en la que dicha emulsión se gelifica.
3. Formulación según la reivindicación 2, en la que dicha emulsión gelificada se ablanda o funde con el calentamiento. 10
4. Formulación según la reivindicación 2, en la que dicha emulsión gelificada se funde rápidamente o se ablanda significativamente cuando se calienta hasta más de aproximadamente 30ºC.
5. Formulación según la reivindicación 1, en la que dicha emulsión se espesa de manera que es sustancialmente no fluida y cohesiva a temperatura ambiente.
6. Formulación según la reivindicación 2, en la que dicha emulsión gelificada no se funde ni se ablanda 15 significativamente con dicho calentamiento.
7. Formulación según la reivindicación 1, que incluye además agente(s) regulador(es) de pH, agente(s) colorante(s), agente(s) potenciador(es) de la permeación, o una combinación de los mismos.
8. Formulación según la reivindicación 2, en la que dicha emulsión gelificada no se funde ni se ablanda significativamente cuando se calienta hasta más de aproximadamente 30ºC. 20
9. Formulación según la reivindicación 1, en la que la razón de tetracaína con respecto a lidocaína está entre 1:0,5 y 1:1,5.
10. Formulación según la reivindicación 1, en la que dicha tetracaína y lidocaína en dicha mezcla eutéctica se formula en una razón en peso sustancialmente uno a uno.
11. Formulación según la reivindicación 1, que incluye además al menos un compuesto que es un agente 25 emulsionante, un agente gelificante o un agente espesante.
12. Formulación según la reivindicación 1, en la que el porcentaje en peso de dicha mezcla eutéctica en dicha formulación es mayor que aproximadamente el 12%.
13. Formulación según la reivindicación 1, en la que el porcentaje en peso de dicha mezcla eutéctica en dicha formulación es mayor que aproximadamente el 18%. 30
Patentes similares o relacionadas:
Procedimiento de preparación de cápsula dura de hipromelosa por el uso de termogelificación, del 22 de Julio de 2020, de Suheung Co., Ltd: Un procedimiento de preparación de una cápsula dura de hipromelosa usando termogelificación con estabilidad durante almacenamiento, resistencia de película, distribución […]
Composición para el control de parásitos animales y método para el control de parásitos animales, del 15 de Julio de 2020, de MITSUI CHEMICALS AGRO, INC: Una composición para su uso en un método de tratamiento, en donde el método es para exterminar parásitos animales, comprendiendo la composición, […]
Uso de principios activos refrescantes fisiológicos y agentes que contienen tales principios activos, del 17 de Junio de 2020, de Symrise AG: Procedimiento no terapéutico para la modulación in-vitro del receptor de mentol frío TRPM8, en el que se lleva a contacto el receptor con al menos un modulador, que se selecciona […]
Gránulos de dispersión rápida, comprimidos de desintegración oral y métodos, del 3 de Junio de 2020, de Adare Pharmaceuticals, Inc: Microgránulos de dispersión rápida, farmacéuticamente aceptables, que tienen una mediana del tamaño de partícula en el rango de 100 μm a 300 […]
Composición anestésica de uso tópico en forma de nanopartículas, del 13 de Mayo de 2020, de Biolab Sanus Farmacêutica Ltda: Una composición anestésica en forma de hidrogel de aplicación tópica sobre la piel o las mucosas, que lleva: (i) una suspensión de nanocápsulas […]
Compuestos de sulfonamida inversa a base de sulfuro, alquilo y piridilo para el tratamiento del VHB, del 13 de Mayo de 2020, de Novira Therapeutics Inc: compuesto de Fórmula IIIa: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo; en la que cada R1 se selecciona independientemente de H, halo […]
Partículas de inhalación que comprenden una combinación de un anticolinérgico, un corticoesteroide y un beta-adrenérgico, del 22 de Abril de 2020, de CHIESI FARMACEUTICI S.P.A.: Micropartículas multicomponentes para uso en una formulación para inhalación, cada micropartícula comprende una combinación de dipropionato de […]
Composición farmacéutica, del 25 de Marzo de 2020, de Mexichem Fluor S.A. de C.V: Una composición farmacéutica que comprende: (i) al menos un compuesto de formoterol seleccionado entre formoterol, sales farmacéuticamente […]