ADMINISTRACIÓN DE SALES DE ANFETAMINAS POR LIBERACIÓN CONTROLADA.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2003/029757.
Solicitante: SHIRE LLC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 9200 BROOKFIELD COURT, SUITE 108 FLORENCE, KANTUCKY 41042 ESTADOS UNIDOS DE AMERICA.
Inventor/es: COUCH, RICHARD, A., CHANG,RONG-KUN, BURNSIDE,Beth.
Fecha de Publicación: .
Fecha Solicitud PCT: 24 de Septiembre de 2003.
Clasificación PCT:
- A61K31/137 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Arilalquilaminas, p. ej. Anfetamina, epinefrina, salbutamol, efedrina.
- A61K9/22 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › del tipo de liberación prolongada o discontinua.
- A61K9/54 A61K 9/00 […] › que contienen partículas distintas con revestimientos de diferentes grosores o de diferentes materiales.
Clasificación antigua:
- A61K31/137 A61K 31/00 […] › Arilalquilaminas, p. ej. Anfetamina, epinefrina, salbutamol, efedrina.
- A61K9/22 A61K 9/00 […] › del tipo de liberación prolongada o discontinua.
- A61K9/54 A61K 9/00 […] › que contienen partículas distintas con revestimientos de diferentes grosores o de diferentes materiales.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2360046_T3.pdf




Fragmento de la descripción:
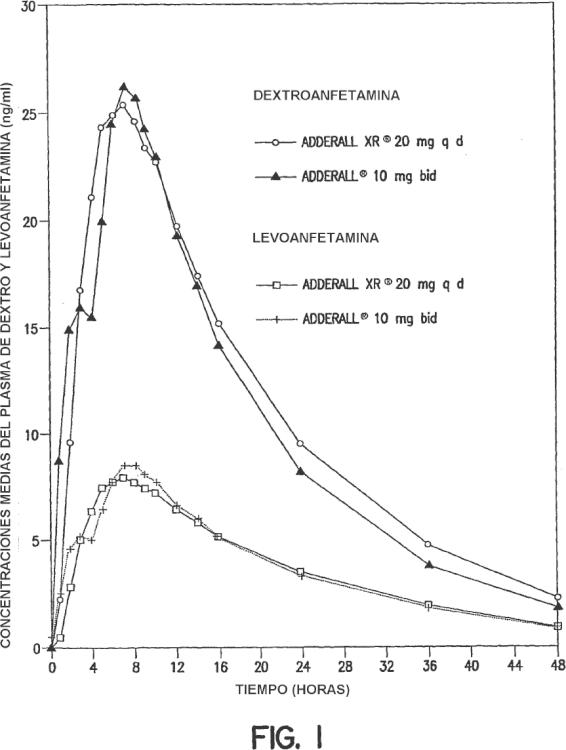
En esta solicitud se describen composiciones para proporcionar una forma de liberación controlada (SR) oralmente administrable de una o más anfetaminas y/o sales de anfetaminas. También se describen métodos para administrar las formas de liberación controlada de una o más sales de anfetamina a un paciente con necesidad de las mismas. Preferiblemente, se llevan a cabo los métodos para el tratamiento de pacientes con ADHD (trastorno de hiperactividad de déficit de atención), pero otras enfermedades también pueden tratarse. Las formas de liberación controlada de una o más anfetaminas y de sales de anfetaminas de acuerdo con la invención preferentemente están formuladas para proporcionar un perfil de concentración plasmática in vivo (o sea, medido por la concentración total de las anfetaminas y/o sales de anfetamina (a menudo con el seguimiento independiente de los isómeros d y l) en el plasma sanguíneo de los pacientes) que es sustancialmente equivalente al perfil de concentración plasmática in vivo conseguido mediante formulaciones de liberación a pulsos de las mismas anfetaminas y/o sales de anfetaminas cuando se administran a un paciente, por ejemplo, los conseguidos por ADDERALL XR®, Shire US Inc. Además preferentemente, este perfil de liberación sostenida (el perfil de concentración plasmática se distingue del perfil de liberación) exhibe normalmente características de primer orden o bifásicas o sigmoides.
Particularmente preferentemente, las formulaciones SR de acuerdo con la invención muestran un perfil de concentración plasmática in vivo después de una sola dosis sustancialmente igual al que se muestra en la figura 1. Este último muestra la media de las curvas sustancialmente suaves de concentración plasmática (de unos 20 pacientes) logradas tanto por las sales de dextroanfetamina como por las de levoanfetamina con ADDERALL XR® (la curva de concentración plasmática media total de anfetamina es simplemente la suma de las dos curvas que se muestra en la figura 1). Ya que las formulaciones de esta invención logran sustancialmente las mismas curvas medias de concentración plasmática, pueden calificarse de formulaciones de rápida liberación controlada, con respecto al aumento inicial de las pendientes de los picos involucradas.
Por sustancialmente el mismo "perfil" en esta solicitud se entiende que dos curvas tengan sustancialmente la misma AUC (área debajo de la curva) y Cmax, esto es, estos parámetros para cada curva son ± 20% el uno del otro, o incluso más cerca, por ejemplo ± 10%, ± 5%, ± 2%, etc., los parámetros están totalmente convencionalmente definidos y determinados. Véase, por ejemplo, Fundamentals of Clinical Pharmacokinetics. J.G. Wagner, Drug Intelligence Publications, Inc., Hamilton, Illinois, 1975; Guidance for Industry, Bioavailability and Bioequivalence Studies for Orally Administered Drug Products-General Considerations, A CDER, Octubre de 2000. En la Fig. 1, la AUC (tiempo cero hasta el infinito) es 556,6 ng hr/ml y Cmax es 28,0 ng/ml para la d-anfetamina y 205,1 ng hr/ml y 8,7, ng/ml, respectivamente, para la l-anfetamina. Por supuesto, las curvas plasmáticas alcanzadas con esta invención pueden seguir más estrechamente el curso de una curva diana tal como la mostrada en la figura 1, o sea, coincidiendo sustancialmente (esto es ± 20%) en el aumento inicial de la pendiente, la forma de la curva después del pico, valores de Tmax, (7,1 hr para d-anfetamina y 7,4 hr para l-anfetamina en la figura 1), etc. Mientras que la figura 1 muestra datos de comprimidos de 20 mg (es decir, dos dosis de pulsos de 10 mg), las curvas plasmáticas (y por ejemplo, las AUC y Cmax) correspondientes a otras dosis diarias como 10, 30, 40, 50, 60, 70, 80, y 90 mg serán esencialmente linealmente proporcionales a las que se muestran en la figura 1, correspondientes a la dosificación envuelta.
En otra realización independiente, las formulaciones de SR rápidas de esta invención, para la dosis de ADDERALL XR® 20 mg de la figura 1, muestran curvas de concentración plasmática que tienen pendientes iniciales (por ejemplo, de dos horas después de la administración a 4 horas después de la administración) de alrededor de 3,7 a alrededor de 11,4 ng/(ml hr) para dextroanfetaminas y alrededor de 1,4 a alrededor de 3 ng/(ml hr) para levoanfetaminas, preferentemente, alrededor de 4 a alrededor de 8 ng/(ml hr) y alrededor de 1,5 a alrededor de 2,2 ng/(ml hr), respectivamente. La pendiente precisa para un individuo determinado variará según los factores habituales, incluso según si el paciente ha comido o no. Para otras dosis, por ejemplo, las mencionadas anteriormente, las pendientes variarán directamente (linealmente) proporcionalmente a la dosis.
Las formulaciones del documento de patente internacional WO 00/23055, por ejemplo, la de ADDERALL XR®, logran una liberación doble de sales activas de anfetamina, una, una forma de dosis de liberación inmediata y la otra una forma de dosis de liberación controlada. Normalmente, el tiempo transcurrido entre la forma de liberación inmediata (liberación con la administración) y la forma de liberación controlada es de 2 a 6 horas, preferentemente alrededor de 3 a alrededor de 5 horas, más preferentemente alrededor de 3 a alrededor de 4 horas y normalmente alrededor de cuatro horas. En una realización, las formulaciones de liberación controlada rápidas de esta invención se utilizan para proporcionar un perfil de concentración plasmática media sustancialmente igual al del ejemplo 5 (combinación de los ejemplos 1 y 2) del documento de patente internacional WO 00/23055, a pesar de la divulgación en este último de que la tecnología de formulación de liberación controlada convencional no era adecuada para las anfetaminas. (Téngase en cuenta que el perfil plasmático del ejemplo 5 que se muestra en la figura 7 del documento de patente internacional WO 00/23055 no es un perfil de media, como es el de la figura 1 de esta solicitud, sino que es de un solo individuo.)
Las formulaciones de SR de esta invención serán eficaces para tratar, por ejemplo, ADHD, de la misma manera como ADDERALL® XR. Por ejemplo, serán eficaces para tratar el ADHD de la forma inesperadamente buena
45
establecida por los datos comunicados en el ejemplo 10. También serán eficaces para tratar el ADHD con baja incidencia de efectos secundarios, incluyendo abuso de sustancias, adicción, tolerancia, taquifilaxia, etc.
Sales preferidas son las del producto comercial ADDERALL XR®, es decir, sulfato de dextroanfetamina, sacarato de dextroanfetamina, monohidrato de aspartato de anfetamina y sulfato de anfetamina. Sin embargo, la invención no se limita a estas sales de anfetamina específicas. Otras anfetaminas y sales de anfetaminas y sus mezclas pueden utilizarse en un sistema de administración de liberación controlada para lograr los perfiles de concentración plasmática de la invención. Por ejemplo, pueden utilizarse anfetamina base, derivados químicos y quirales de la misma y otras sales de anfetamina.
Pueden conseguirse los perfiles de concentración plasmática preferidos in vivo de las sales de anfetaminas al proporcionarse una forma de dosificación sólida de la sal de anfetamina que es capaz de proporcionar una liberación controlada de una o más sales de anfetamina durante un periodo de, por ejemplo, 8-12 horas, o más largo, preferentemente 10-12 horas. Por ejemplo, pueden proporcionarse las sales de anfetamina en un núcleo que esté recubierto de un recubrimiento que permita la liberación de las sales de anfetamina contenidas en un periodo de tiempo, tal como una película insoluble en agua farmacéuticamente aceptable sola o con un agente regulador de la disolución. Además, combinando las cuentas de liberación inmediata con las cuentas de liberación controlada puede conseguirse un perfil de liberación bifásico. Se conocen otros métodos para proporcionar la liberación controlada de un fármaco incluyendo los que se describen en más detalle a continuación, y pueden usarse para proporcionar una administración de liberación controlada que produzca los perfiles de concentración plasmática in vivo descritos anteriormente.
Sistemas de liberación controlada adecuados incluyen recubrimientos de SR, por ejemplo, sobre cuentas, matrices de SR (o sea, no hace falta recubrimientos), sistemas osmóticos de SR, etc. por cuyo medio las sales de anfetamina consiguen un perfil de liberación de primer orden, bifásico, sigmoidal etc. a fin de conseguir el perfil plasmático equivalente a los sistemas de liberación en pulsos de los mismos fármacos como se describió anteriormente. Es ya convencional el producir... [Seguir leyendo]
Reivindicaciones:
1. Una composición farmacéutica que consiste en una formulación de liberación sostenida oral de una o más anfetaminas y/o sales de anfetaminas que exhiben características de primer orden o bifásicas o características sigmoides.
2. La composición farmacéutica de la reivindicación 1, en donde al menos una anfetamina o sal de anfetamina es una mezcla de sulfato de dextroanfetamina, sacarato de dextroanfetamina, aspartato de anfetamina monohidrato y sulfato de anfetamina.
3. Una composición como se reivindica en la reivindicación 1 o 2 para tratar el trastorno de hiperactividad con déficit de atención.
Patentes similares o relacionadas:
Compuestos y métodos para tratar un trastorno epiléptico, del 29 de Julio de 2020, de THE REGENTS OF THE UNIVERSITY OF CALIFORNIA: Un compuesto seleccionado de clemizol, o una sal farmacéuticamente aceptable del mismo, para uso en un método de tratamiento de un trastorno […]
Uso de (1R,2R)-3-(3-dimetilamino-1-etil-2-metil-propil)-fenol para tratar el dolor inflamatorio, del 22 de Julio de 2020, de GRUNENTHAL GMBH: (1R, 2R)-3-(3-Dimetilamino-1-etil-2-metil-propil)-fenol para uso en el tratamiento del dolor inflamatorio.
Régimen de dosificación para un agonista del receptor S1P, del 3 de Junio de 2020, de NOVARTIS AG: Uso de un modulador o agonista del receptor S1P en la fabricación de un medicamento para el tratamiento de una enfermedad autoinmune, mediante […]
Gránulos de dispersión rápida, comprimidos de desintegración oral y métodos, del 3 de Junio de 2020, de Adare Pharmaceuticals, Inc: Microgránulos de dispersión rápida, farmacéuticamente aceptables, que tienen una mediana del tamaño de partícula en el rango de 100 μm a 300 […]
Formulaciones de partículas inhalables que comprenden un agente antimuscarínico, del 6 de Mayo de 2020, de Crystec Ltd: Una formulación en polvo que comprende partículas de tolterodina o un compuesto relacionado con tolterodina seleccionado de (R)-N,N-diisopropil-3-(2-hidroxi-5-hidroximetilfenil)-3-fenilpropanamina, […]
Métodos para el tratamiento de la retinopatía diabética proliferativa, del 22 de Abril de 2020, de Acucela, Inc: Un compuesto para su uso en el tratamiento de la retinopatía diabética proliferativa en un paciente que lo necesita, en donde el compuesto tiene la estructura […]
Formulación farmacéutica acuosa de tapentadol para administración por vía oral, del 22 de Abril de 2020, de GRUNENTHAL GMBH: Una composición farmacéutica acuosa que contiene tapentadol o una sal fisiológicamente aceptable del mismo y que está adaptada para administración […]
Formulación pediátrica, del 8 de Abril de 2020, de AMGEN INC.: Una formulación de polvo que comprende una cantidad terapéuticamente eficaz de hidrocloruro de (R)-N-[-1-(1- naftil)etil]-3-[3-(trifluorometil)fenil]propan-1-amina […]