USO DE SECUENCIAS REGULATORIAS PARA LA EXPRESION TRANSITORIA ESPECIFICA EN CELULAS DETERMINADAS DE MANERA NEURONAL.
Uso de una secuencia reguladora seleccionada del grupo que consiste en
(a) secuencias reguladoras que comprenden la secuencia de nucleótidos mostrada en SEQ ID NO:
1, mostrada en SEQ ID NO: 2, mostrada en SEQ ID NO: 3 o mostrada en SEQ ID NO: 4;
(b) secuencias reguladoras que comprenden la secuencia de nucleótidos contenida en la inserción del clon DSM 15111 y obtenible mediante amplificación usando dos oligonucleótidos que tienen las secuencias indicadas en SEQ ID NO: 9 y SEQ ID NO: 10;
(c) secuencias reguladoras que comprenden al menos una secuencia de nucleótidos de SEQ ID NO: 1 de la posición 1166 a 1746, de la posición 1166 a 2049, de la posición 1785 a 1843 o de la posición 1953 a 2775;
(d) secuencias reguladoras que comprenden al menos una secuencia de nucleótidos de SEQ ID NO: 2 de la posición 529 a 1079, de la posición 529 a 1390, de la posición 1118 a 1175 o de la posición 1291 a 2137;
(e) secuencias reguladoras que comprenden al menos una parte funcional de una secuencia de (a) a (d) en donde dicha parte funcional produce expresión específica en células determinadas neuronales proliferativas;
(f) secuencias reguladoras que producen expresión específica en células determinadas neuronales proliferativas que comprenden una secuencia de nucleótidos que es al menos el 75% idéntica a una secuencia definida en (a) a (d) o que comprende una secuencia de nucleótidos que es al menos el 78% idéntica a la secuencia de nucleótidos mostrada en SEQ ID NO: 1 de la posición 1166 a 1746 o de la posición 1166 a 2049 o a la secuencia de nucleótidos mostrada en SEQ ID NO: 2 de la posición 529 a 1079 o de la posición 529 a 1390, que comprende una secuencia de nucleótidos que es al menos el 82% idéntica a la secuencia de nucleótidos mostrada en SEQ ID NO: 1 de la posición 1785 a 1843 o a la secuencia de nucleótidos mostrada en SEQ ID NO: 2 de la posición 1118 a 1175 o que comprende una secuencia de nucleótidos que es al menos el 75% idéntica a la secuencia de nucleótidos mostrada en SEQ ID NO: 1 de la posición 1953 a 2775 o a la secuencia de nucleótidos mostrada en SEQ ID NO: 2 de la posición 1291 a 2137; y
(g) secuencias reguladoras que comprenden una secuencia de nucleótidos que hibrida en condiciones rigurosas de hibridación con una hebra complementaria de la secuencia reguladora definida en (a) a (f) y que produce expresión específica en células determinadas neuronales proliferativas, para la expresión temprana, transitoria de un secuencia de nucleótidos heteróloga en células determinadas neuronales siempre que no se modifique la identidad genética de la línea germinal de seres humanos y en donde dichas células no son células troncales embrionarias humanas
Tipo: Resumen de patente/invención. Número de Solicitud: W04000760EP.
Solicitante: F. HOFFMANN-LA ROCHE AG.
Nacionalidad solicitante: Suiza.
Dirección: GRENZACHERSTRASSE 124,4070 BASEL.
Inventor/es: COUILLARD-DESPRES,SEBASTIEN, KARL,CLAUDIA, KUHN,HANS-GEORG, AIGNER,LUDWIG.
Fecha de Publicación: .
Fecha Concesión Europea: 21 de Octubre de 2009.
Clasificación Internacional de Patentes:
- A01K67/027M4
- C12N15/85 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › para células animales.
- C12N15/85A3
Clasificación PCT:
- A01K67/027 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01K CRÍA DE ANIMALES; AVICULTURA; APICULTURA; PISCICULTURA; PESCA; ANIMALES PARA CRIA O REPRODUCCIÓN, NO PREVISTOS EN OTRO LUGAR; NUEVAS VARIEDADES DE ANIMALES. › A01K 67/00 Cría u obtención de animales, no prevista en otro lugar; Nuevas razas de animales. › Nuevas razas de vertebrados.
- A61K48/00 A […] › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- C12N15/63 C12N 15/00 […] › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
- C12N15/85 C12N 15/00 […] › para células animales.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
Clasificación antigua:
- A01K67/027 A01K 67/00 […] › Nuevas razas de vertebrados.
- A61K48/00 A61K […] › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- C12N15/63 C12N 15/00 […] › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
- C12N15/85 C12N 15/00 […] › para células animales.
- C12N5/10 C12N 5/00 […] › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
Fragmento de la descripción:
Uso de secuencias regulatorias para la expresión transitoria específica en células determinadas de manera neuronal.
La presente invención se refiere al uso de secuencias reguladoras para mediar la expresión específica transitoria temprana en células determinadas neuronales proliferativas. Además, se divulgan los usos de moléculas recombinantes de ácido nucleico que comprenden dichas secuencias reguladoras para mediar la expresión específica transitoria temprana en células determinadas neuronales proliferativas así como para la generación de organismos transgénicos no humanos y/o células huésped. Además, la invención proporciona animales transgénicos no humanos y/o células huésped que comprenden dichas secuencias reguladoras y/o moléculas recombinantes de ácido nucleico siempre que no se modifique la identidad genética de la línea germinal de seres humanos y en donde dicha célula huésped no es una célula troncal embrionaria humana. La invención también describe métodos para la preparación de tales vectores, células huésped y animales transgénicos no humanos así como métodos para la detección y/o aislamiento de células determinadas neuronales. Además, se proporcionan métodos para el cribado de compuestos capaces de regular la actividad de células determinadas neuronales, neurogénesis, estimular la proliferación de células precursoras comprometidas neuronalmente y/o diferenciación neuronal y la invención también se refiere a métodos para la detección y análisis de procesos de diferenciación neuronal, migración neuronal y/o determinación neuronal. Por último, la invención se refiere a composiciones diagnósticas y farmacéuticas que comprenden las secuencias reguladoras, moléculas recombinantes de ácido nucleico, células huésped o células determinadas neuronales aisladas descritas aquí.
Las células troncales neurales (NSC) multipotentes del cerebro en desarrollo y adulto proliferan, se reproducen y dan lugar a neuronas, astrocitos y oligodendroglía, los tres tipos celulares principales del sistema nervioso central (SNC). La neurogénesis, la diferenciación neuronal de NSC multipotentes, requiere compromiso de destino celular, restricción de linaje neuronal y posterior diferenciación y maduración. Los cambios posteriores en la identidad celular desde NSC a neuroblastos, células precursoras restringidas/determinadas neuronales y neuronas maduras están regulados por cambios intrínsecos en la expresión génica.
Las NSC multipotentes se caracterizan por la expresión de "marcadores", como nestina, Notch1 y Musashi (véase Lendahl, Cell 60 (1990), 585-595). Sin embargo, estos marcadores no están restringidos a las NSC, y por lo tanto son insuficientes para la identificación de NSC. Por ejemplo Musashi se encuentra en células hepáticas, células de sertoli de testículo y células sanguíneas de cordón umbilical, como se muestra en Shu, Biochem. Biophys. Res. Commun. 293 (2002), 150-154; Saunders, Biol. Reprod. 66 (2002), 500-507 y Sanchez-Ramos, Exp. Neurol. 171 (2001), 109-115. Las células precursoras restringidas/determinadas neuronales se caracterizan por la expresión de PSA-NCAM (Doetsch, J. Neurosci. 17 (1997), 5046-5061). Sin embargo, la expresión de PSA-NCAM no está restringida a células precursoras determinadas neuronales, sino que también se encuentra en precursores de oligodendrocitos; véase Grinspan, J. Neurosci. Res. 41 (1995), 540-551. El isotipo ßIII de tubulina se usa como marcador neuronal temprano (entre otros, Palmer, Nature 411 (2001), 42-43). Su expresión, sin embargo, no está restringida a células precursoras determinadas neuronales, sino que se puede detectar aún en algunas neuronas maduras y también en células no neuronales del epitelio pigmentoso como muestran Moskowitz, J. Neurosci. Res. 34 (1993), 129-134 y Vinores, Exp. Eye Res. 60 (1995), 385-400.
El SNC de mamífero adulto, aunque clásicamente se ve como un tejido no regenerativo, mantiene el potencial de generar nuevas neuronas. Dos áreas de neurogénesis adulta están bien documentadas: el giro dentado de la formación del hipocampo y el eje pared del ventrículo lateral/bulbo olfatorio, como describió por primera vez Altman ((1965) J. Comp. Neurol 124, 319-335 y (1969) J. Comp. Neurol. 137, 433-457). En el hipocampo, las neuronas recién generadas surgen de células en proliferación en el límite entre el hilio y la capa de células granulares, véase (Cameron, Neuroscience 56 (1993), 337-344; Kuhn, J. Neurosci 16 (1996), 2027-2033 o Seri, J. Neurosci 21 (2001), 7153-7160). La neurogénesis de las células granulares del hipocampo continúa durante toda la vida, aunque se observa un declive constante con el envejecimiento (Kuhn (1996), loc. cit.; Kempermann, J. Neuroscience 18 (1998), 3206-3212). Las células destinadas al bulbo olfatorio (BO), se originan de una población de células troncales neurales y progenitores que se dividen en la pared del ventrículo lateral (Doetsch, J. Neurosci 17 (1997), 5046-5061). Las células precursoras restringidas/determinas neuronales recién generadas migran hacia el BO a través de una estructura denominada el canal migratorio rostral (CMR). En el BO, las células precursoras restringidas neuronales que entran se integran y completan la diferenciación como células granulares y neuronas periglomerulares (Betarbet, J. Dev. Neurosci 14 (1996), 921-930; Winner, Eur J Neurosci. 16(9 (2002)), 1681-1689).
Aunque la neurogénesis aún tiene lugar en el SNC de mamífero adulto, el cerebro dañado es en gran parte incapaz de una auto-reparación estructural funcionalmente significativa. Esto refleja la incapacidad de las NSC y los precursores restringidos neuronales presentes en las regiones neurogénicas de migrar hacia las regiones dañadas en gran cantidad y reconstruir circuitos. Para alcanzar una masa crítica de células de reemplazo en una localización específica del SNC, el injerto celular parece ser un planteamiento prometedor. Se han investigado diferentes fuentes de células, tales como tejido mesencefálico fetal disociado, células troncales derivadas de blastocistos o prosencéfalos embrionarios expandidas in vitro y células troncales neurales del cerebro adulto para su uso potencial en experimentos de trasplante, véase, entre otros, Brundin, Brain 123 (2000), 1380-1390; Freed. N. Engl. J. Med. 344 (2001), 710-719; Bjorklund; Proc. Natl. Acad. Sci. USA 99 (2002), 2344-2349; Brustle, Curr. Opin. Neurobiol. 6 (1996), 688-695; Englund, Exp. Neurol. 173 (2002), 1-21 o Gage, Science 287 (2000), 1433-1438. En seres humanos que padecen la enfermedad de Parkinson, el implante de tejido fetal ha producido algún grado de recuperación funcional (Piccini, Nat. Neurosci. 2 (1999), 1137-1140; Brundin (2000), loc. cit. o Freed (2001), loc. cit.). Sin embargo, el acceso muy limitado a tejido fetal y las preocupaciones éticas que rodean su uso en pacientes han reforzado la búsqueda de fuentes alternativas de células precursoras restringidas neuronales, en particular aquellas recogidas de tejidos adultos. Sólo recientemente, se han acometido los primeros intentos para el aislamiento directo de NSC mediante antígenos de superficie celular o mediante expresión de genes indicadores dirigidos por promotores. Las NSC multipotentes se aislaron directamente de tejido cerebral fetal humano usando selección positiva para CD133 y selección negativa para CD34 y CD45 (Uchida, Proc. Natl. Acad. Sci. USA 97 (2000), 14720-14725) o selección para el dominio extracelular de Notch1 (Johansson (1999), loc. cit.). Sin embargo, ambos planteamientos tienen sus limitaciones, ya que ni la expresión CD133, ni la de Notch1 es específica para células troncales neurales, como se muestra en Yin, Blood 90 (1997), 5002-5012 o Stier, Blood 99 (2002), 2369-2378. Se emplearon marcadores genéticos tales como el elemento potenciador específico de células troncales neurales del gen de la nestina, el promotor pan-neuronal de la tubulina a1 (Ta1) o el promotor de 2',3'-nucleótido cíclico 3'-fosfodiesterasa (CNP) de precursores de oligodendroglía para el aislamiento y enriquecimiento de poblaciones de progenitores neuronales específicos que expresan proteína fluorescente verde (GFP) bajo el control de los elementos promotor/potenciador de diferentes tipos celulares; véase Roy, J. Neurosci. Res. 59 (2000), 321-331, Wang, Dev. Neurosci. 22 (2000), 167-176; Roy, J. Neurosci. 19 (1999), 9986-9995; Sawamoto, J. Neurosci. Res. 65 (2001), 220-227; Kawaguchi, Mol. Cell Neurosci. 17 (2001), 259-273; WO 00/23571; WO 98/32879 o WO 01/53503. Con todo, los elementos genéticos empleados son solamente útiles para el aislamiento de ciertas poblaciones celulares; el elemento del promotor de nestina es útil para el aislamiento de células troncales neurales multipotentes,...
Reivindicaciones:
1. Uso de una secuencia reguladora seleccionada del grupo que consiste en
para la expresión temprana, transitoria de un secuencia de nucleótidos heteróloga en células determinadas neuronales siempre que no se modifique la identidad genética de la línea germinal de seres humanos y en donde dichas células no son células troncales embrionarias humanas.
2. El uso de la reivindicación 1, en donde dicha secuencia reguladora es de origen humano, de ratón o rata.
3. El uso de la reivindicación 1 ó 2, en donde dicha secuencia reguladora está comprendida en una molécula recombinante de ácido nucleico.
4. El uso de cualquiera de las reivindicaciones 1 a 3, en donde dicha secuencia heteróloga de nucleótidos a ser expresada es un gen seleccionado del grupo que consiste en un gen marcador, un gen receptor, un gen anti-apoptótico, un gen de determinación/diferenciación, un gen capaz de inducir y/o dirigir migración u orientación neuronal, un gen que codifica una etiqueta, un gen que codifica un factor trófico, un gen que codifica una proteína de superficie, un gen que codifica un factor de transcripción o una gen que codifica una enzima, o en donde dicha secuencia de nucleótidos a ser expresada es una secuencia antisentido o codifica una ribozima o una molécula de ARN inhibidora.
5. El uso de la reivindicación 4, en donde dicho gen marcador o receptor se selecciona del grupo que consiste en GFP, EGFP, RFP, CFP, BFP, YFP, DsRed, ß-galactosidasa, luciferasa o cloranfenicol acetiltransferasa.
6. El uso de la reivindicación 4, en donde dicho gen que codifica una etiqueta se selecciona del grupo que consiste en etiqueta His, glutatión, etiqueta Strep, etiqueta flag, CBP, TAG-100, etiqueta E2 y etiqueta Z.
7. El uso de la reivindicación 4, en donde dicho gen que codifica una proteína de superficie es CD24.
8. El uso de la reivindicación 4, en donde dicho gen que codifica un factor trófico se selecciona del grupo que consiste en NGF, BDNF, PDGF, NT-3, NT-4, NT-5, VEGF, PEDF, EGF, FGF, IGF, cardiotrofina, eritropoyetina, leptina, LIF y TGF.
9. El uso de la reivindicación 4, en donde dicho gen antiapoptótico se selecciona del grupo que consiste en bcl-2, Brn-3a, PTEN y (una) anticaspasa(s).
10. El uso de la reivindicación 4, en donde dicho gen de determinación/diferenciación es el factor de determinación dopaminérgico Nurr1.
11. El uso de la reivindicación 4, en donde dicho gen capaz de inducir y/o dirigir migración u orientación neuronal se selecciona del grupo que consiste en netrina, neuropilina, CXCR4, SDF-1, DCC, slit, robo, una semaforina, un miembro de la familia plexina y un miembro de la familia efrina.
12. El uso de la reivindicación 4, en donde dicho gen que codifica un factor de transcripción se selecciona del grupo que consiste en NeuroD, BMP4, Nurr1 o ShcC.
13. El uso de la reivindicación 4, en donde dicho gen que codifica una enzima es CRE.
14. El uso de la reivindicación 4, en donde dicha secuencia heteróloga de nucleótidos a ser expresada es una secuencia antisentido o codifica una ribozima o una molécula de ARN inhibidora.
15. El uso de la reivindicación 4 ó 14, en donde dicho ARN inhibidor se selecciona del grupo que consiste en ARNi, ARNip, ARNhc y ARNtp.
16. El uso de un vector que comprende la secuencia reguladora o la molécula recombinante de ácido nucleico definida en cualquiera de las reivindicaciones 1 a 15 para la expresión específica, temprana transitoria de una secuencia heteróloga de nucleótidos en células determinadas neuronales proliferativas siempre que no se modifique la identidad genética de la línea germinal de seres humanos y en donde dichas células no son células troncales embrionarias humanas.
17. El uso de la reivindicación 16, en donde dicho vector es un vector de expresión génica.
18. El uso de la reivindicación 16 ó 17, en donde dicho vector es un vector que expresa un gen marcador o indi- cador.
19. El uso de la reivindicación 18, en donde dicho gen marcador o receptor es GFP, EGFP, RFP, CFP, BFP, YFP, DsRed, ß-galactosidasa, luciferasa o cloranfenicol acetiltransferasa.
20. El uso de cualquiera de las reivindicaciones 16 a 19, en donde dicho vector comprende una secuencia de nucleótidos seleccionada del grupo que consiste en
21. El uso de cualquiera de las reivindicaciones 16 a 20, en donde dicho vector es un virus.
22. El uso de cualquiera de las reivindicaciones 16, 17 ó 20, en donde dicho vector es adecuado para terapia génica o vacunación con una molécula de ácido nucleico.
23. El uso de la secuencia reguladora o la molécula recombinante de ácido nucleico como se define en cualquiera de las reivindicaciones 1 a 15 o del vector como se define en cualquiera de las reivindicaciones 16 a 22 para la generación de una célula huésped genéticamente modificada, siempre que no se modifique la identidad genética de la línea germinal de seres humanos y en donde dicha célula huésped no es una célula troncal embrionaria humana.
24. El uso de la reivindicación 23, en donde dicha célula es una célula neuronal, una célula ES no humana, una célula germinal no humana, un línea celular cultivada o una célula primaria.
25. El uso de las reivindicaciones 23 ó 24, en donde dicha célula huésped es de origen mamífero.
26. Un método para preparar una célula huésped genéticamente modificada, caracterizado en que la célula huésped se transfecta con una molécula de ácido nucleico que es o que comprende la secuencia reguladora o la molécula recombinante de ácido nucleico como se define en cualquiera de las reivindicaciones 1 a 15 o el vector como se define en cualquiera de las reivindicaciones 16 a 22, siempre que no se modifique la identidad genética de la línea germinal de seres humanos y en donde dicha célula huésped no es una célula troncal embrionaria humana.
27. Un método para la generación de un animal transgénico no humano que comprende el paso de introducir una secuencia reguladora como se define en la reivindicación 1 ó 2 o una molécula recombinante de ácido nucleico como se define en cualquiera de las reivindicaciones 3 a 15 en una célula ES o una célula germinal.
28. Un animal transgénico no humano que comprende células huésped como se definen en cualquiera de las reivindicaciones 23 a 24, o que comprende en sus células al menos una copia adicional de la secuencia reguladora como se define en la reivindicación 1 ó 2 o que comprende en sus células una molécula recombinante de ácido nucleico de cualquiera de las reivindicaciones 3 a 15.
29. El animal transgénico no humano de la reivindicación 28 que comprende en sus células una molécula recombinante de ácido nucleico como se define en cualquiera de las reivindicaciones 3 a 15.
30. El animal transgénico de la reivindicación 29, en donde dicho animal transgénico es un ratón o una rata.
31. El animal transgénico no humano de cualquiera de las reivindicaciones 28 a 30 que comprende en sus células una molécula recombinante de ácido nucleico que comprende la secuencia reguladora como se define en la reivindicación 1 ó 2 y además una secuencia de nucleótidos bajo el control de dicha secuencia reguladora que codifica GFP, EGFP, RFP, BFP, YFP, ß-galactosidasa, cloranfenicol acetiltransferasa o luciferasa.
32. Una célula huésped genéticamente modificada, caracterizada en que la célula huésped se transfecta con una molécula de ácido nucleico que es o que comprende la secuencia reguladora a la molécula recombinante de ácido nucleico como se define en cualquiera de las reivindicaciones 1 a 15 o el vector como se define en cualquiera de las reivindicaciones 16 a 22, siempre que no se modifique la identidad genética de la línea germinal de seres humanos y en donde dicha célula huésped no es una célula troncal embrionaria humana.
33. Una composición que comprende la secuencia reguladora como se define en la reivindicación 1 ó 2, la molécula recombinante de ácido nucleico como se define en cualquiera de las reivindicaciones 3 a 15 o el vector como se define en cualquiera de las reivindicaciones 16 a 22 o una célula huésped genéticamente modificada como se define en cualquiera de las reivindicaciones 23 a 25 ó 32.
34. La composición de la reivindicación 33, que es una composición farmacéutica, que opcionalmente comprende un soporte o diluyente farmacéuticamente aceptable.
35. La composición de la reivindicación 33, que es una composición diagnóstica, que además comprende opcionalmente medios adecuados de detección.
36. Kit que comprende la secuencia reguladora como se define en la reivindicación 1 ó 2, la molécula recombinante de ácido nucleico como se define en cualquiera de las reivindicaciones 3 a 15 o el vector como se define en cualquiera de las reivindicaciones 16 a 22 o una célula huésped genéticamente modificada como se define en cualquiera de las reivindicaciones 23 a 25 ó 32.
37. Uso de una molécula recombinante de ácido nucleico como se define en cualquiera de las reivindicaciones 3 a 15, de un vector como se define en cualquiera de las reivindicaciones 16 a 22 o una célula huésped genéticamente modificada como se define en cualquiera de las reivindicaciones 23 a 25 ó 32 para la preparación de una composición farmacéutica para el tratamiento de un trastorno o enfermedad neurológicos o para la potenciación de las capacidades de aprendizaje y/o memoria.
38. El uso de la reivindicación 37, en donde dicho trastorno o enfermedad neurológica es una enfermedad neurodegenerativa, una lesión del SNC o SNP, hipoxia, isquemia, epilepsia, ictus, traumatismo del SNC, un trastorno neurooftalmológico, un trastorno psiquiátrico, un trastorno tumoral del sistema nervioso, un trastorno neural causado por una agresión toxicológica, una pérdida o daño neurológico relacionado con la edad, o es un trastorno neurológico causado por un malformación del desarrollo, una malformación cerebral o un trastorno de migración neuronal.
39. El uso de la reivindicación 38, en donde la enfermedad neurodegenerativa es enfermedad de Parkinson, enfermedad de Alzheimer, ELA, enfermedad de Huntington, enfermedad de Creutzfeld-Jacobs o demencia por VIH.
40. Uso de una molécula recombinante de ácido nucleico como se define en cualquiera de las reivindicaciones 3 a 15 o un vector como se define en cualquiera de las reivindicaciones 16 a 22 para la preparación de una composición de diagnóstico para la detección de (una) célula(s) determinada(s) neuronal(es).
41. Uso de una molécula recombinante de ácido nucleico como se define en cualquiera de las reivindicaciones 3 a 15 o un vector como se define en cualquiera de las reivindicaciones 16 a 22 o una célula huésped genéticamente modificada como se define en cualquiera de las reivindicaciones 23 a 25 ó 32 para la preparación de una composición de diagnóstico para la detección y/o aislamiento de (una) célula(s) determinada(s) neuronal(es) prolifera- tiva(s).
42. Un método in vitro para la detección de (una) célula(s) determinada(s) neuronal(es) proliferativa(s) que comprende los pasos de
siempre que no se modifique la identidad genética de la línea germinal de seres humanos y en donde dicha célula no sea una célula troncal embrionaria humana.
43. El método de la reivindicación 42, que comprende en el paso (b) la detección de un gen marcador o indicador heterólogo expresado.
44. El método de la reivindicación 42 ó 43 que comprende la detección de un marcador o indicador fluorescente o una enzima expresada.
45. El método de cualquiera de las reivindicaciones 42 a 44, que comprende análisis por FACS, análisis por MACS o aislamiento de afinidad.
46. Un método in vitro para la detección de (una) célula(s) determinada(s) neuronal(es) proliferativa(s) que comprende el paso de seleccionar en una pluralidad de células la(s) célula(s) que comprende(n) una secuencia reguladora activada como se define en la reivindicación 1 ó 2, siempre que no se modifique la identidad genética de la línea germinal de seres humanos y en donde dicha célula no sea una célula troncal embrionaria humana.
47. Un método para el aislamiento de (una) célula(s) determinada(s) neuronal(es) proliferativa(s) que comprende los pasos de detección según cualquiera de las reivindicaciones 42 a 46 y un paso adicional de separar la(s) células que expresa(n) una secuencia heteróloga de nucleótidos bajo el control de la secuencia reguladora como se define en la reivindicación 1 ó 2 de (una) célula(s) que no es/son capaz/capaces de expresar dicha secuencia heteróloga de nucleótidos o que comprende un paso adicional de separar (una) célula(s) que comprende(n) una secuencia reguladora activada como se define en la reivindicación 1 ó 2, siempre que no se modifique la identidad genética de la línea germinal de seres humanos y en donde dicha célula no sea una célula troncal embrionaria humana.
48. Una célula determinada neuronal proliferativa aislada o un preparación enriquecida o purificada de células determinadas neuronales proliferativas aisladas y la progenie de las mismas detectadas y/o aisladas mediante el método de cualquiera de las reivindicaciones 42 a 47, en donde dichas células o progenie de las misma expresan una secuencia heteróloga de nucleótidos bajo el control de la secuencia reguladora como se define en la reivindicación 1 ó 2.
49. Uso de (una) célula(s) determinada(s) neuronal(es) proliferativa(s) detectada(s) mediante el método de cualquiera de las reivindicaciones 42 a 45, o de (una) célula(s) determinada(s) neuronal(es) proliferativa(s) aislada(s) mediante el método de la reivindicación 47, en donde dicha célula o progenie de la misma expresa una secuencia heteróloga de nucleótidos bajo el control de la secuencia reguladora como se define en la reivindicación 1 ó 2, o de una célula determinada neuronal proliferativa aislada o una preparación enriquecida o purificada de células determinadas neuronales aisladas y progenie de las mismas de la reivindicación 48 para la preparación de una composición farmacéutica para el tratamiento de un trastorno o enfermedad neurológica.
50. Uso de (una) célula(s) determinada(s) neuronal(es) proliferativa(s) detectada(s) mediante el método de cualquiera de las reivindicaciones 42 a 45, o de (una) célula(s) determinada(s) neuronal(es) proliferativa(s) aislada(s) mediante el método de la reivindicación 47, en donde dicha célula o progenie de la misma expresa una secuencia heteróloga de nucleótidos bajo el control de la secuencia reguladora como se define en la reivindicación 1 ó 2, o de una célula determinada neuronal proliferativa aislada o una preparación enriquecida o purificada de células determinadas neuronales aisladas y progenie de las mismas de la reivindicación 48 para la preparación de una composición de cribado para ensayos in vitro empleados en probar las propiedades neurogénicas de (un) compuesto(s).
51. Uso de una molécula recombinante de ácido nucleico definida en cualquiera de las reivindicaciones 3 a 15, o de un vector definido en cualquiera de las reivindicaciones 16 a 22 para determinar el grado de maduración de una célula neuronal.
52. Uso de una molécula recombinante de ácido nucleico definida en cualquiera de las reivindicaciones 3 a 15, o de un vector definido en cualquiera de las reivindicaciones 16 a 22, o de una célula huésped genéticamente modificada definida en cualquiera de las reivindicaciones 23 a 25 ó 32, de un animal transgénico no humano de cualquiera de las reivindicaciones 28 a 31 o generado mediante el método de la reivindicación 27, o de (una) célula(s) determinada(s) neuronal(es) proliferativa(s) aislada(s) mediante el método de la reivindicación 47, en donde dicha célula o progenie de la misma expresa una secuencia heteróloga de nucleótidos bajo el control de la secuencia reguladora como se define en la reivindicación 1 ó 2, o de una célula determinada neuronal proliferativa aislada o una preparación enriquecida o purificada de células determinadas neuronales aisladas y progenie de las mismas de la reivindicación 48 para identificar y/o aislar factores y/o compuestos capaces de regular la actividad de células troncales neurales, neurogénesis y/o diferenciación neuronal.
53. Uso de una molécula recombinante de ácido nucleico definida en cualquiera de las reivindicaciones 3 a 15, o de un vector definido en cualquiera de las reivindicaciones 16 a 22, o de una células huésped genéticamente modificada definida en cualquiera de las reivindicaciones 23 a 25 ó 32, de un animal transgénico no humano de cualquiera de las reivindicaciones 28 a 31 o generado mediante el método de la reivindicación 27 o de (una) célula(s) determinada(s) neuronal(es) proliferativa(s) aislada(s) mediante el método de la reivindicación 47, en donde dicha célula o progenie de la misma expresa una secuencia heteróloga de nucleótidos bajo el control de la secuencia reguladora como se define en la reivindicación 1 ó 2, o de una célula determinada neuronal proliferativa aislada o una preparación enriquecida o purificada de células determinadas neuronales aisladas y progenie de las mismas de la reivindicación 48 para el seguimiento in vitro de neuronas recién generadas, de células determinadas neuronales trasplantadas o de células determinadas neuronales en migración.
54. Uso de una molécula recombinante de ácido nucleico definida en cualquiera de las reivindicaciones 3 a 15, de un vector definido en cualquiera de las reivindicaciones 16 a 22 o de una célula huésped genéticamente modificada definida en cualquiera de las reivindicaciones 23 a 25 ó 32 para la generación de una animal transgénico no humano.
55. Un método de cribado de compuestos capaces de regular la actividad de células troncales neurales, neurogénesis y/o diferenciación neuronal que comprende los pasos de:
Patentes similares o relacionadas:
 Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
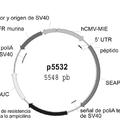 Procedimiento para la producción de polipéptidos, del 29 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Promotor que tiene la secuencia de ácido nucleico de SEQ ID NO: 02.
Procedimiento para la producción de polipéptidos, del 29 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Promotor que tiene la secuencia de ácido nucleico de SEQ ID NO: 02.
Ratones con un sistema inmunitario humanizado con células dendríticas reforzadas, del 22 de Julio de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un ratón Rag-/-, γc-/-, Flk2-/- deficiente para el gen activador de recombinación 2 (Rag2) y/o el gen activador de recombinación 1 (Rag1), cadena gamma […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Procedimientos y composiciones para el tratamiento de una afección genética, del 24 de Junio de 2020, de Sangamo Therapeutics, Inc: Una célula precursora de glóbulos rojos genomanipulada caracterizada por una modificación genómica dentro del exón 2 o el exón 4 de BCL11A o dentro de BCL11A-XL […]
Estructuras artificiales de poliepítopos para uso en inmunoterapia, del 17 de Junio de 2020, de Invectys: Un vector de expresión de ADN o una mezcla de vectores de expresión de ADN que codifica al menos dos epítopos de CD4 de la transcriptasa inversa de la telomerasa […]
Expresión de proteína biotecnológica mejorada que usa un activador CHEF1 híbrido, del 17 de Junio de 2020, de AGC Biologics, Inc: Un vector de expresión que comprende ADN regulador de la transcripción del factor 1α de elongación de hámster chino (CHEF1) 5' y un activador de citomegalovirus (CMV) que […]
Roedores con alelos mutantes de Acvr1 condicionales, del 10 de Junio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una construcción de ácido nucleico que comprende: (i) un exón 5 de Acvr1 que codifica una secuencia de tipo silvestre a nivel de proteína, […]