PROCEDIMIENTO DE TRATAMIENTO DEL DOLOR DE CANCER DE HUESO MEDIANTE LA ADMINISTRACION DE UN ANTAGONISTA DEL FACTOR DE CRECIMIENTO NEURONAL.
Uso de un antagonista del factor de crecimiento neuronal (NGF) en la fabricación de un medicamento para tratar dolor de cáncer de hueso en un individuo,
en el que el antagonista de NGF es un anticuerpo antagonista anti-NGF
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/011786.
Solicitante: RINAT NEUROSCIENCE CORPORATION
REGENTS OF THE UNIVERSITY OF MINNESOTA.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 230 EAST GRAND AVENUE,SOUTH SAN FRANCISCO, CA 94080.
Inventor/es: SHELTON,DAVID,L, MANTYH,PATRICK,WILLIAM.
Fecha de Publicación: .
Fecha Concesión Europea: 27 de Enero de 2010.
Clasificación Internacional de Patentes:
- C07K16/22 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra factores de crecimiento.
Clasificación PCT:
- C07K16/22 C07K 16/00 […] › contra factores de crecimiento.
Clasificación antigua:
- C07K16/22 C07K 16/00 […] › contra factores de crecimiento.
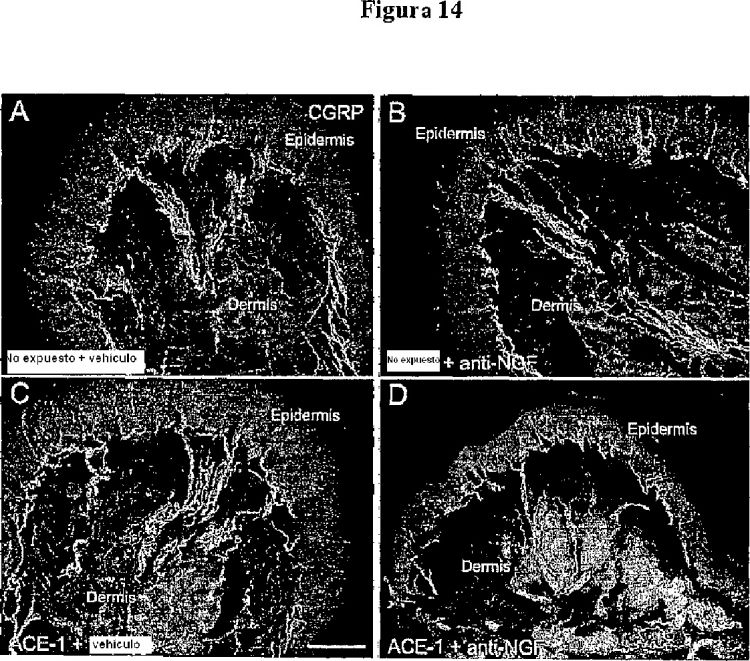
Fragmento de la descripción:
Procedimiento de tratamiento del dolor de cáncer de hueso mediante la administración de un antagonista del factor de crecimiento neuronal.
Campo de la invención
La presente invención se refiere a un anticuerpo antagonista del factor de crecimiento neuronal (NGF) para la prevención, mejora, o tratamiento de dolor de cáncer de hueso.
Antecedentes de la invención
El factor de crecimiento neuronal (NGF) fue la primera neurotrofina que se identificó, y su papel en el desarrollo y la supervivencia de tanto las neuronas periféricas como centrales se han caracterizado bien. NGF se ha mostrado que es un factor crítico de supervivencia de y mantenimiento en el desarrollo de las neuronas simpáticas y embrionarias periféricas y de las neuronas colinérgicas del prosencéfalo basales (Smeyne, et al, Nature 368: 246-249 (1994); Crowley, et al, Cell 76: 1001-1011 (1994)). NGF regula hacia arriba la expresión de los neuropéptidos en las neuronas sensoriales (Lindsay, et al, Nature 337: 362-364 (1989)), y su actividad está mediada por a través de dos receptores de unión a membrana diferentes, el receptor de la tirosina quinasa TrkA y el receptor p75 que está estructuralmente relacionado con los otros miembros de la familia del receptor del factor de necrosis tumoral (Chao, et al., Science232: 518-521 (1986)).
Además de sus efectos en el sistema nervioso, NGF ha estado en gran medida implicado en los procesos del exterior del sistema nervioso. Por ejemplo, NGF se ha mostrado que potencia la permeabilidad vascular en la rata (Otten, et al, Eur J Farmacol. 106: 199-201 (1984)), potencian las respuestas inmunes de las células T- y B- (Otten, et al, Proc. Natl. Acad Sci. Estados Unidos 86: 10059-10063 (1989)), inducen la diferenciación de linfocitos y proliferación de células de mastocitos y provocan la liberación de las señales biológicas solubles a partir de las células de mastocitos (Matsuda, et al, Proc. Natl. Acad. Sci. Estados Unidos 85: 6508-6512 (1988); Pearce, et al, J. Physiol. 372: 379-393 (1986); Bischoff, et al, Blood 79: 2662-2669 (1992); Horigome, et al, J. Biol. Chem. 268: 14881-14887 (1993)). Aunque el NGF añadido exógenamente se ha mostrado que es capaz de tener todos estos efectos, es importante indicar que solamente se ha mostrado raramente que el NGF endógeno es importante en cualquiera de estos procesos in vivo (Torcia, et al, Cell. 85 (3): 345-56 (1996)). Por lo tanto, no está claro que el efecto pueda ser, si lo hay, de inhibición de la bioactividad del NGF endógeno.
El NGF se produce mediante un número de tipos de células que incluyen células de mastocitos (Leon, et al, Proc. Natl. Acad. Sci. Estados Unidos 91: 3739-3743 (1994)), linfocitos B (Torcia, et al, CelI85: 345-356 (1996), queratinocitos (Di Marco, et al, J. Biol. Chem. 268: 22838-22846)), células del músculo liso (Ueyama, et al, J. Hypertens. 11: 1061-1065 (1993)), fibroblastos (Lindholm, et al, Eur. J. Neurosci. 2:795-801 (1990)), células epiteliales bronquiales (Kassel, et al, Clin, Exp. Allergy 31: 1432-40 (2001)), células mesangiales renales (Steiner, et al, Am. J. Physiol. 261:F792-798 (1991)) y miotubos del músculo esquelético (Schwartz, et al, J Photochem, Photobiol. B 66: 195-200 (2002)). Se ha encontrado receptores de NGF sobre una diversidad de tipos de células en el exterior del sistema nervioso. Por ejemplo, TrkA se ha encontrado sobre monocitos humanos, linfocitos T- y B2 y células de mastocitos.
Una asociación entre los niveles elevados de NGF y una diversidad de afecciones inflamatorias se ha observado en pacientes humanos así como en varios modelos de animales. Éstos incluyen lupus sistémico eritematoso (Bracci-Laudiero, et al, Neuroreport 4: 563-565 (1993)), esclerosis múltiple (Bracci-Laudiero, et al, Neurosci. Lett. 147: 9-12 (1992)), psoriasis (Raychaudhuri, et al, Acta Derm. l'enereol 78: 84-86 (1998)), artritis (Falcimi, et al, Ann. Rheum. Dis. 55: 745-748 (1996)), cistitis intersticial (Okragli, et al, J. Urology 161: 438-441 (1991)), asma (Braun, et al, Eur. J Immunol 28: 3240-3251 (1998)), pancreatits, y prostatitis.
De manera consistente, un elevado nivel de NGF en los tejidos periféricos está asociado a la inflamación y se observa en numerosas formas de artritis. La sinovia de los pacientes afectados por artritis reumatoide expresa niveles altos de NGF mientras que en la sinovia no inflamada se ha reseñado NGF que es no detectable (Aloe, et al, Arch. Rheum. 35: 351-355 (1992)). Similares resultados se observaron en ratas con artritis reumatoide inducida experimentalmente (Aloe, et al, Clin. Exp. Rheumatol. 10: 203-204 (1992); Halliday et al, Neurochem. Res. 23: 919-22 (1998)). Se han reseñado niveles elevados de NGF en ratones artríticos transgénicos junto con, un incremento en el número de células de mastocitos (Aloe, et al, lnt. J. Tissue Reactions-Exp. Clin. Aspects 15: 139-143 (1993)).
El tratamiento con NGF exógeno conduce a un incremento de dolor y sensibilidad al dolor. Esto se ilustra por el hecho de que la inyección de NGF conduce a un incremento significativo de dolor y sensibilidad al dolor en ambos modelos animales (Lewin et al, J. Neurosci. 13: 2136-2148 (1993); Amann, et al, Pain 64, 323-329 (1996); Andreev, et al, Pain 63, 109-115 (1995)) y seres humanos (Dyck, et al, Neurology 48, 501-505 (1997); Petty, et al, Annals Neurol. 36, 244-246 (1994)). NGF parece actuar mediante múltiples mecanismos que incluyen la inducción de la neurotrofina BDNF (Apfel, et al, Mol. Cell. Neurosci. 7(2), 134-142 (1996); Michael, et al, J. Neurosci 17, 8476-8490 (1997)) que a su vez cambia el procesamiento de la señal de dolor en la médula espinal (Hains, et al, Neurosci Lett. 320 (3), 125-8 (2002); Miletic, et al, Neurosci Lett. 319 (3), 137-40 (2002); Thompson, et al, Proc Natl Acad Sci Estados Unidos 96 (14), 7714-8 (1999)), induciendo cambios en las conexiones periféricas y centrales de las neuronas sensoriales y otras neuronas que transmiten dolor en la médula espinal (Lewin, et al, European Journal of Neuroscience 6, 1903-1912 (1994); Thompson, et al, Pain 62, 219-231 (1995)), induciendo cambios en el crecimiento axonal (Lindsay, RM, J Neurosci. 8(7), 2394-405 (1988)) induciendo la expresión del receptor de bradiquinina (Peterson et al, Neuroscience 83: 161-168 (1998)), induciendo cambios en la expresión de genes responsables de la activación y conducción neuronal tales como canales de iones (Boettger, et al., Brain 125 (Pt 2), 252-63 (2002); Kerr, et al., Neuroreport 12 (14), 3077-8 (2001); Gould, et al., Brain Res 854 (1-2), 19-29 (2000); Fjell et al., J. Neurophysiol. 81: 803-810 (1999)), potenciando el receptor relacionado con el dolor TRPV (Chuang, et al., Nature 411 (6840), 957-62 (2001); Shu y Mendell, Neurosci. Lett. 274: 159-162 (1999)) y provocando cambios patológicos en los músculos (Foster, et al., J Pathol 197(2), 245-55 (2002)). Muchos de estos cambios tienen lugar directamente sobre las neuronas sensoriales que transmiten dolor y aparentemente no dependen de la inflamación concomitante. Además, existen al menos otros dos tipos de células conocidos que responden a NGF y que pueden estar implicados en cambios en la sensación o sensibilidad de dolor. El primero de éstos, la célula de mastocitos, se ha reseñado que responde a NGF con desgranulación (Yan, et al., Clin. Sci. (Lond) 80: 565-569 (1991)) o, en otros estudios, provoca o incrementa la producción o liberación del mediador en colaboración con otros agentes (Pearce y Thompson, J. Physiol. 372: 379-393 (1986), Kawamoto. et al., J. Immunol. 168: 6412-6419 (2002)). Se ha mostrado claramente en la rata que las respuestas de dolor mediadas por NGF están al menos algo mediadas por células de mastocitos (Lewin, et al., Eur. J. Neurosci. 6: 1903-1912 (1994), Woolf, et al., J. Neurosci. 16: 2716-2723 (1996) aunque la relevancia potencial de esto se continúa mostrando en seres humanos. Las neuronas simpáticas primarias también se sabe que responden a NGF y que también están implicadas en la señalización del dolor (Aley, et al., Neuroscience 71: 1083-1090 (1996)). Es evidente que la eliminación de la inervación simpática modifica la hiperalgesia normalmente observada en respuesta al tratamiento con NGF (Woolf, et al, J. Neurosci. 16: 2716-2723 (1996)).
Se ha descrito el uso de antagonistas de NGF, tal como anticuerpo anti-NGF, para tratar diversos tipos...
Reivindicaciones:
1. Uso de un antagonista del factor de crecimiento neuronal (NGF) en la fabricación de un medicamento para tratar dolor de cáncer de hueso en un individuo, en el que el antagonista de NGF es un anticuerpo antagonista anti-NGF.
2. El uso de la reivindicación 1, en el que el dolor de cáncer de hueso es de cáncer originado en el hueso.
3. El uso de la reivindicación 2, en el que el dolor de cáncer de hueso es de osteosarcoma.
4. El uso de la reivindicación 1, en el que el dolor de cáncer de hueso es de cáncer con metástasis al hueso.
5. El uso de la reivindicación 4, en el que el cáncer con metástasis al hueso se selecciona entre cáncer de próstata, cáncer de mama, cáncer de pulmón, sarcoma, y cáncer renal.
6. El uso de una cualquiera de las reivindicaciones precedentes, en el que el anticuerpo antagonista anti-NGF es un anticuerpo monoclonal.
7. El uso de cualquiera de las reivindicaciones 1 a 5, en el que el anticuerpo antagonista anti-NGF es un anticuerpo humanizado.
8. El uso de una cualquiera de las reivindicaciones 1 a 5, en el que el anticuerpo antagonista anti-NGF es un anticuerpo humano.
9. El uso de una cualquiera de las reivindicaciones precedentes, en el que el anticuerpo antagonista anti-NGF se une a NGF humano.
10. El uso de la reivindicación 9, en el que el anticuerpo antagonista anti-NGF además se une a NGF de roedor.
11. El uso de la reivindicación 9, en el que el anticuerpo antagonista anti-NGF se une a NGF humano con un valor de KD de aproximadamente 0,1 nM o menos de aproximadamente 0,1 nM.
12. El uso de una cualquiera de las reivindicaciones 1 a 5 ó 7, o de una cualquiera de las reivindicaciones 9 a 11 cuando se depende de una cualquiera de las reivindicaciones 1 a 5 ó 7, en el que la región variable de la cadena pesada del anticuerpo antagonista comprende la secuencia de aminoácidos mostrada en la SEQ ID NO: 1.
13. El uso de una cualquiera de las reivindicaciones 1 a 5, 7 ó 12, o de una cualquiera de las reivindicaciones 9 a 11 cuando se depende de una cualquiera de las reivindicaciones 1 a 5 ó 7, en el que la región ligera del anticuerpo antagonista anti-NGF comprende la secuencia de aminoácidos mostrada en la SEQ ID NO:2.
14. El uso de una cualquiera de las reivindicaciones precedentes, en el que el antagonista de NGF no es para la co-administración con un analgésico opioide.
15. Un anticuerpo antagonista anti-NGF para uso en el tratamiento de dolor de cáncer de hueso en un individuo.
Patentes similares o relacionadas:
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Método para el tratamiento de la osteoporosis, del 22 de Julio de 2020, de AMGEN INC.: Un anticuerpo antiesclerostina que comprende una CDR-H1 de la SEQ ID NO: 245, una CDR-H2 de la SEQ ID NO: 246, una CDR-H3 de la SEQ ID NO: 247, […]
Anticuerpo anti-FGF23 y composición farmacéutica que comprende el mismo, del 15 de Julio de 2020, de Kyowa Kirin Co., Ltd: Anticuerpo o fragmento funcional del mismo que se une a la totalidad o a una parte del epítopo de FGF23 humano, al que se une un anticuerpo producido […]
Anticuerpos scFv que pasan las capas epitelial y/o endotelial, del 1 de Julio de 2020, de ESBATech, an Alcon Biomedical Research Unit LLC: Un anticuerpo monocatenario (scFv) que comprende: (a) un dominio variable de la cadena ligera (VL) que tiene tres regiones CDR de VL no […]
 Tratamiento del cáncer usando inhibidores de TGF-beta y PD-1, del 24 de Junio de 2020, de XOMA TECHNOLOGY LTD.: Un inhibidor del factor de crecimiento transformante beta (TGFβ) y un inhibidor de la proteina de muerte celular programada 1 (PD-1) para usar en un metodo […]
Tratamiento del cáncer usando inhibidores de TGF-beta y PD-1, del 24 de Junio de 2020, de XOMA TECHNOLOGY LTD.: Un inhibidor del factor de crecimiento transformante beta (TGFβ) y un inhibidor de la proteina de muerte celular programada 1 (PD-1) para usar en un metodo […]
Métodos para el tratamiento de la enfermedad ocular en sujetos humanos, del 10 de Junio de 2020, de Clearside Biomedical, Inc: Una formulación farmacéutica que comprende un fármaco para su uso en un método de tratamiento de un trastorno ocular posterior en un sujeto humano que […]
Método para tratar la pérdida de hueso alveolar mediante el uso de anticuerpos antiesclerostina, del 3 de Junio de 2020, de AMGEN INC.: Un anticuerpo antiesclerostina para su uso en un método para aumentar la altura del hueso alveolar en un sujeto que padece pérdida de hueso alveolar, donde […]
Proteínas de captura de la superficie celular recombinantes, del 13 de Mayo de 2020, de REGENERON PHARMACEUTICALS, INC.: Un método para detectar y aislar células que producen altos niveles de una proteína heterodimérica que tiene una primera subunidad y una segunda subunidad, […]