TRANSFORMACION DE ALTA EFICIENCIA DEL ALGODON MEDIADA POR AGROBACTERIUM USANDO EXPLANTES DE PECIOLO.
Un procedimiento para producir una planta de algodón transgénica que comprende las etapas de:
(a) obtener explantes de pecíolo de algodón,
(b) exponer los explantes de pecíolo a un cultivo de Agrobacterium tumefaciens que alberga un vector que comprende un gen exógeno y un gen marcador seleccionable, siendo el Agrobacterium capaz de efectuar la transferencia estable del gen exógeno y el gen marcador seleccionable al genoma de las células del explante de pecíolo,
(c) cultivar los explantes de pecíolo en un medio que contiene ácido 2,4-diclorofenoxiacético a una concentración que varía de más de 0 a 0,5 mg/l y quinetina a una concentración que varía de más de 0 a 1 mg/l para inducir la formación de callos,
(d) seleccionar el callo transformado que expresa el gen exógeno,
(e) cultivar el callo seleccionado en cultivo de suspensión en medio de diferenciación que no contiene hormona vegetal durante menos de 20 días para inducir la formación de embrioides,
(f) germinar los embrioides en un medio que tiene una fuente de nitrógeno seleccionada del grupo que consiste en asparagina, glutamina o tanto asparagina como glutamina y que no contiene hormona vegetal, para producir plantas de algodón transgénicas jóvenes, y
(g) cultivar las plantas de algodón transgénicas jóvenes en un medio que tiene 10 g/l de glucosa y 10 g/l sacarosa como fuente de carbono y que no contiene hormona vegetal, para producir plantas de algodón transgénicas,
en el que los medios de cultivo usados en las etapas (b)-(f) tienen glucosa como única fuente de carbono y en el que la etapa (e) se realiza a un pH entre 5,8 y 7,5
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/SG99/00058.
Solicitante: INSTITUTE OF MOLECULAR AGROBIOLOGY.
Nacionalidad solicitante: Singapur.
Dirección: 1 RESEARCH LINK, THE NATIONAL UNIVERSITY OF SINGAPORE,SINGAPORE 117604.
Inventor/es: CHEN,ZHI,XIAN, ZHANG,LIANHUI.
Fecha de Publicación: .
Fecha Concesión Europea: 25 de Noviembre de 2009.
Clasificación Internacional de Patentes:
- C12N15/82A4B
- C12N15/82A8
Clasificación PCT:
- C12N15/82 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › para células vegetales.
Clasificación antigua:
- C12N15/82 C12N 15/00 […] › para células vegetales.
Fragmento de la descripción:
Transformación de alta eficiencia del algodón mediada por Agrobacterium usando explantes de pecíolo.
Campo técnico
La presente invención se refiere al campo general de la ingeniería genética de plantas, en particular a la introducción de material genético exógeno en el algodón por transformación con Agrobacterium de explantes de pecíolo de algodón seguido de regeneración de embriones somáticos.
Antecedentes
El algodón es uno de los cultivos industriales más valiosos y ampliamente cultivados internacionalmente. Su producción anual mundial es superior a 100 millones de fardos valuados en US
Cultivo de tejido de algodón: En 1935, Skovsted informó el primer cultivo de embriones de algodón. Beasley (1971) informó la formación de callos en el algodón como un crecimiento a partir del extremo micropilar de los óvulos fertilizados en el medio de Murashige & Skoog (MS). Se obtuvo la embriogénesis somática a partir de un cultivo en suspensión de G. klotzschianum (Price & Smith, 1979). En 1983, Davidonis & Hamilton fueron los primeros en tener éxito en la regeneración eficiente y repetible de plantas de algodón (G. hirsutum L.) a partir de callos después de dos años de cultivo. Desde entonces las plantas de algodón se regeneraron a través de la embriogénesis somática de diferentes explantes (Zhang & Feng, 1992; Zhang, 1994) que incluyen el cotiledón (Davidonis et al., 1987; Davidonis & Hamilton, 1983; Finer, 1988; Firoozabady et al., 1987), hipocótilo (Cousins et al., 1991; Rangan & Zavala, 1984; Rangan & Rajasekaran, 1996; Trolinder & Goodin, 1988; Umbeck et al., 1987, 1989), tallo (Altman et al., 1990; Bajaj et al., 1989; Chen, et al. 1987; Finer & Smith, 1984), brote apical (Bajaj et al., 1985; Gould et al., 1991; Turaev & Shamina, 1986), embrión inmaduro (Beasley, 1971; Stewart & Hsu, 1977, 1978), pecíolo (Finer & Smith, 1984; Gawel et al., 1986; Gawel & Robacker, 1990), hoja (Finer & Smith, 1984; Gawel & Robacker, 1986), raíz (Chen & Xia, 1991; Kuo et al., 1989), callo (Finer & McMullen, 1990; Trolinder et al., 1991) y protoplasto (Chen et al., 1989).
Transformación del algodón: La transformación del algodón mediada por Agrobacterium se informó por primera vez hace una década con hipocótilo y cotiledón como explantes (Firoozababy et al., 1987; Umbeck et al., 1987). Se han introducido varios genes útiles en el algodón por medio de la transformación mediada por Agrobacterium, incluyendo genes con resistencia a insectos y herbicidas (Perlak et al., 1990; Trolinder et al., 1991; Chen et al., 1994). Se han usado explantes (tales como hipocótilo, cotiledón, callo generado del hipocótilo y cotiledón, así como embriones inmaduros) para la transformación mediada por Agrobacterium y bombardeo de partículas (de Framond et al., 1983; Finer & McMullen, 1990; Firoozabady et al., 1987; Perlak et al., 1990; Rangan & Rajasekaran, 1996; Rajasekaran et al., 1996; Trolinder et al., 1991; Umbeck et al., 1987, 1989, 1992). Además, también se ha usado tejido meristemático de ejes embrionarios escindidos para la transformación del algodón por bombardeo de partículas (Chlan et al., 1995; John, 1996; John & Keller, 1996; McCabe & Martinell, 1993). Zhou et al. (1983) transformaron algodón inyectando ADN en la placenta axil un día después de la autopolinización.
Sin embargo, las tasas de transformación en general fueron bajas, variando de 20 a 30% cuando se usó el hipocótilo como explante (Firoozababy et al., 1987; Cousins et al., 1991; Rajasekaran et al., 1996). Se informó una eficiencia de transformación significativamente superior, de hasta 80%, cuando se usó el cotiledón como explante y el gen ocs que codifica la octopina sintetasa como gen indicador (Firoozababy et al., 1987). Sin embargo, la validez de la octopina como marcador de la transformación es cuestionable ya que se ha hallado octopina en varias especies de plantas ciertamente no transformadas por la infección con A. tumefaciens (Wendt-Gallitelli y Dobrigkeit, 1973). Un informe más reciente indicó que la eficiencia de transformación del cotiledón fue aproximadamente de 20 a 30% (Cousins et al., 1991). La eficiencia de transformación fue incluso menor cuando se usó el procedimiento de bombardeo de partículas (Keller et al., 1997). Una diferencia en el tipo de explantes usados para la transformación pudo haber tenido un efecto significativo sobre la eficiencia de transformación y regeneración. Se ha informado, por ejemplo, que para reducir los transformantes falsos positivos, el cotiledón fue un mejor explante que el hipocotiledón (Firoozabady et al., 1987).
La transformación del algodón es muy dependiente del genotipo (Trolinder, 1985a, 1986; Trolinder & Goodin, 1987, 1988a, 1988b; Trolinder & Chen, 1989). Además de unos pocos cultivares que son regenerables y transformables, tales como Gossypium hirsutum cv. Coker 312 y G. hirsutum Jin 7, la mayor parte de los otros cultivares comerciales de elite importantes, tales como G. hirsutum cv. D&P 5415 y G. hirsutum cv. Zhongmian 12, no son regenerables y transformables por esos procedimientos. La ausencia de un procedimiento de regeneración de plantas de alta eficiencia se ha considerado como el mayor obstáculo para la aplicación de la transformación mediada por Agrobacterium al algodón (Gawel et al., 1986; Firoozabady et al., 1987).
El documento WO97/12512 desvela un procedimiento para regenerar plantas de algodón a partir de tejido de explante, que permite la generación del callo embriogénico a partir de un explante de tejido de algodón que no se cultiva en el medio de iniciación del callo, que tiene hormonas vegetales exógenas. El procedimiento se puede utilizar en la transformación de plantas de algodón, cortando tejido de algodón para formar un explante, co-cultivando el tejido del explante de algodón con Agrobacterium que comprende una secuencia de ADN de interés, y cultivando el explante co-cultivado en medio de iniciación de algodón que comprende un agente selectivo pero que no tiene hormonas vegetales exógenas. De esta manera las células transformadas son inducidas para producir el callo embriogénico en el medio selectivo libre de hormonas.
Sumario de la invención
Para superar los problemas asociados con los procedimientos informados previamente, se ha desarrollado un eficiente procedimiento de transformación utilizando pecíolo como explante, junto con un conjunto de medios mejorados en forma correspondiente. Este procedimiento provee varias ventajas en comparación con los procedimientos del hipocótilo y cotiledón:
(1) los explantes son fáciles de obtener;
(2) la eficiencia de transformación es superior;
(3) la contaminación del Agrobacterium es muy rara;
(4) la eficiencia de la regeneración es mayor; y
(5) se reduce el tiempo desde la transformación a la regeneración de las plántulas.
Dos variedades de algodón, es decir, Coker 312 y Si-Mian 3, se han transformado con éxito con este procedimiento, y se han obtenido más de 30 líneas transgénicas independientes de Coker 312 que muestran fuerte actividad del transgén marcador. Este procedimiento es aplicable a otras variedades de algodón tales como Jin 7 y Ji 713 de China, Siokra 1-3 de Australia, T25, Coker 201 y Coker 310 de Estados Unidos.
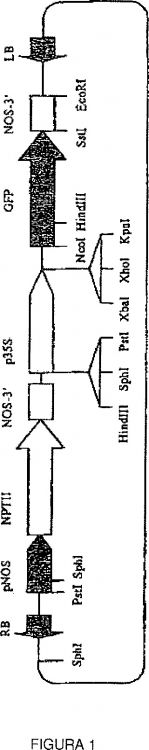
Breve descripción de la figura
La Figura 1 muestra el plásmido pBI121GFP, que contiene GFP como gen indicador y el gen de NPT II (neomicina fosfotransferasa) como marcador seleccionable, usado para la transformación mediada por Agrobacterium...
Reivindicaciones:
1. Un procedimiento para producir una planta de algodón transgénica que comprende las etapas de:
(a) obtener explantes de pecíolo de algodón,
(b) exponer los explantes de pecíolo a un cultivo de Agrobacterium tumefaciens que alberga un vector que comprende un gen exógeno y un gen marcador seleccionable, siendo el Agrobacterium capaz de efectuar la transferencia estable del gen exógeno y el gen marcador seleccionable al genoma de las células del explante de pecíolo,
(c) cultivar los explantes de pecíolo en un medio que contiene ácido 2,4-diclorofenoxiacético a una concentración que varía de más de 0 a 0,5 mg/l y quinetina a una concentración que varía de más de 0 a 1 mg/l para inducir la formación de callos,
(d) seleccionar el callo transformado que expresa el gen exógeno,
(e) cultivar el callo seleccionado en cultivo de suspensión en medio de diferenciación que no contiene hormona vegetal durante menos de 20 días para inducir la formación de embrioides,
(f) germinar los embrioides en un medio que tiene una fuente de nitrógeno seleccionada del grupo que consiste en asparagina, glutamina o tanto asparagina como glutamina y que no contiene hormona vegetal, para producir plantas de algodón transgénicas jóvenes, y
(g) cultivar las plantas de algodón transgénicas jóvenes en un medio que tiene 10 g/l de glucosa y 10 g/l sacarosa como fuente de carbono y que no contiene hormona vegetal, para producir plantas de algodón transgénicas,
en el que los medios de cultivo usados en las etapas (b)-(f) tienen glucosa como única fuente de carbono y en el que la etapa (e) se realiza a un pH entre 5,8 y 7,5.
2. El procedimiento de acuerdo con la reivindicación 1, en el que los explantes de pecíolo se pre-cultivan durante un período de tiempo anterior a la exposición al cultivo de Agrobacterium tumefaciens.
3. El procedimiento de acuerdo con la reivindicación 1, en el que la glucosa del medio de cultivo usado en las etapas (b)-(f) está en una cantidad de aproximadamente 10 g/l a aproximadamente 50 g/l.
4. El procedimiento de acuerdo con la reivindicación 3, en el que la glucosa está en una cantidad de aproximadamente 30 g/l.
5. El procedimiento de acuerdo con la reivindicación 1, en el que la fuente de nitrógeno de la etapa (f) está en una cantidad de aproximadamente 700 mg/l a aproximadamente 5 g/l.
6. El procedimiento de acuerdo con la reivindicación 5, en el que la fuente de nitrógeno está en una cantidad de aproximadamente 3,8 g/l.
7. El procedimiento de acuerdo con la reivindicación 5, en el que la fuente de nitrógeno es asparagina y glutamina, y la asparagina está en una cantidad de aproximadamente 200 mg/l a aproximadamente 1 g/l y la glutamina está en una cantidad de aproximadamente 500 mg/l a aproximadamente 2 g/l.
8. El procedimiento de acuerdo con la reivindicación 7, en el que la asparagina está en una cantidad de aproximadamente 500 mg/l y la glutamina está en una cantidad de aproximadamente 1 g/l.
9. El procedimiento de acuerdo con la reivindicación 1 o 2, en el que el cultivo en suspensión de la etapa (e) tiene una duración de aproximadamente 10 días a menos de 20 días.
10. El procedimiento de acuerdo con la reivindicación 9, en el que el cultivo en suspensión de la etapa (e) tiene una duración de aproximadamente 14 días.
11. El procedimiento de acuerdo con la reivindicación 1, en el que el ácido 2,4-diclorofenoxiacético está en una concentración de aproximadamente 0,05 mg/l y la quinetina está en una concentración de aproximadamente 0,1 mg/l.
12. El procedimiento de acuerdo con la reivindicación 1, en el que la etapa (e) se realiza a un pH entre 6,2 y 7,0.
13. El procedimiento de acuerdo con la reivindicación 12, en el que la etapa (e) se realiza a un pH de 6,5.
14. El procedimiento de acuerdo con la reivindicación 12, en el que la etapa (e) se realiza a un pH entre 6,5 y 7,0.
Patentes similares o relacionadas:
ACIDOS NUCLEICOS REGULADORES TRANSCRIPCIONALES, POLIPEPTIDOS Y METODOS DE USO DE LOS MISMOS, del 28 de Enero de 2010, de PIONEER HI-BRED INTERNATIONAL, INC. E.I. DU PONT DE NEMOURS AND CO: Un ácido nucleico aislado que codifica una proteína que tiene actividad CHD (modificadora de la organización de la cromatina-helicasa-de unión […]
METODO PARA INTENSIFICACION DE LA EXPRESION DE GENES EN LAS PLANTAS, del 2 de Noviembre de 2009, de BIOGEMMA: Un constructo genético para la expresión de un polipéptido en una célula de planta, que comprende: (a) un promotor operativo dentro de dicha célula de […]
TRANSFORMACIÓN Y REGENERACIÓN DE PLANTAS DE LA FAMILIA ALLIUM, del 6 de Septiembre de 2011, de THE NEW ZEALAND INSTITUTE FOR PLANT AND FOOD RESEARCH LIMITED: Un método para transformar Allium usando embriones inmaduros como fuente de explantes, que comprende las siguientes etapas: (a) aislar embriones […]
 TRANSFORMACIÓN VEGETAL SIN MARCADOR, del 22 de Marzo de 2011, de J.R. SIMPLOT COMPANY: Un método para transformar una planta dicotiledónea, que comprende (a) cortar la plántula dicotiledónea en la intersección del tallo en la que se encuentran […]
TRANSFORMACIÓN VEGETAL SIN MARCADOR, del 22 de Marzo de 2011, de J.R. SIMPLOT COMPANY: Un método para transformar una planta dicotiledónea, que comprende (a) cortar la plántula dicotiledónea en la intersección del tallo en la que se encuentran […]
PROCEDIMIENTO PARA LA PRODUCCION DE PLANTAS TRANSGENICAS QUE PRESENTAN ALTO CONTENIDO EN COMPUESTOS ANTIOXIDANTES, ALTA CAPACIDAD ANTIOXIDANTE Y RESISTENCIA AL EMPARDECIMIENTO, del 18 de Marzo de 2011, de IDEN CARBOHYDRATE BIOTECHNOLOGY, S.L: Procedimiento para la producción de plantas transgénicas que presentan alto contenido en compuestos antioxidantes, alta capacidad antioxidante y resistencia al empardecimiento. […]
METODO PARA LA OBTENCION DE CULTIVARES DE TOMATE CON FRUTOS PARTENOCARPICOS (SIN SEMILLAS) Y MAYOR CALIDAD ORGANOLEPTICA, del 8 de Julio de 2010, de UNIVERSIDAD POLITECNICA DE VALENCIA INSTITUTO NACIONAL DE INVESTIGACION Y TECNOLOGIA AGRARIA Y ALIMENTARIA CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC) UNIVERSIDAD DE ALMERIA: El método se basa en la transferencia y expresión del gen LFY de Arabidopsis thaliana en plantas transgénicas de tomate. Los frutos de las plantas transgénicas […]
RESISTENCIA DE LA VID AL NEPOVIRUS, del 20 de Mayo de 2010, de CORNELL RESEARCH FOUNDATION, INC.: Procedimiento para seleccionar y producir una vid o componente de la vid transgénicos con aumento de resistencia a la enfermedad de arrepollado […]
 MOVILIZACION DE GENOMAS VIRICOS A PARTIR DE T-ADN UTILIZANDO SISTEMAS DE RECOMBINACION ESPECIFICOS DE SITIO, del 5 de Mayo de 2010, de PIONEER HI-BRED INTERNATIONAL, INC.: Un método para movilizar un replicón vírico de un T-ADN, que comprende:
a) proporcionar un replicón Agrobacterium que comprende un T-ADN, que contiene un replicón vírico flanqueado […]
MOVILIZACION DE GENOMAS VIRICOS A PARTIR DE T-ADN UTILIZANDO SISTEMAS DE RECOMBINACION ESPECIFICOS DE SITIO, del 5 de Mayo de 2010, de PIONEER HI-BRED INTERNATIONAL, INC.: Un método para movilizar un replicón vírico de un T-ADN, que comprende:
a) proporcionar un replicón Agrobacterium que comprende un T-ADN, que contiene un replicón vírico flanqueado […]