POLVOS PARA INHALACION QUE CONTIENEN FENILALANINA.
Polvo que contiene una proteína y fenilalanina, caracterizado porque,
el polvo contiene por lo menos un 30% (p/p) de fenilalanina, de preferencia por lo menos un 40% (p/p) de fenilalanina
Tipo: Resumen de patente/invención. Número de Solicitud: W07056451EP.
Solicitante: BOEHRINGER INGELHEIM PHARMA GMBH & CO.KG.
Nacionalidad solicitante: Alemania.
Dirección: BINGER STRASSE 173,55216 INGELHEIM AM RHEIN.
Inventor/es: BECHTOLD-PETERS, KAROLINE, GARIDEL,PATRICK, SCHULTZ-FADEMRECHT,TORSTEN, FISCHER,BEATE.
Fecha de Publicación: .
Fecha Concesión Europea: 6 de Enero de 2010.
Clasificación Internacional de Patentes:
- A61K31/155 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Amidinas ( ), p. ej. Guanidina (H 2 N—C(=NH)—NH 2 ), isourea (HN=C(OH)NH 2 ), isotiourea (HN=C(SH)—NH 2 ).
Clasificación PCT:
- A61K31/155 A61K 31/00 […] › Amidinas ( ), p. ej. Guanidina (H 2 N—C(=NH)—NH 2 ), isourea (HN=C(OH)NH 2 ), isotiourea (HN=C(SH)—NH 2 ).
- A61K47/42 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Proteínas; Polipéptidos; Sus productos de degradación; Sus derivados, p. ej. albúmina, gelatina or zeína (oligopéptidos que contienen hasta cinco aminoácidos A61K 47/18; poliaminoácidos A61K 47/34).
- A61K9/14 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61K9/16 A61K 9/00 […] › Aglomerados; Granulados; Microbolitas.
- B01D1/18 TECNICAS INDUSTRIALES DIVERSAS; TRANSPORTES. › B01 PROCEDIMIENTOS O APARATOS FISICOS O QUIMICOS EN GENERAL. › B01D SEPARACION (separación de sólidos por vía húmeda B03B, B03D, mesas o cribas neumáticas B03B, por vía seca B07; separación magnética o electrostática de materiales sólidos a partir de materiales sólidos o de fluidos, separación mediante campos eléctricos de alta tensión B03C; aparatos centrifugadores B04B; aparato de vórtice B04C; prensas en sí para exprimir los líquidos de las sustancias que los contienen B30B 9/02). › B01D 1/00 Evaporación (secado de materiales sólidos y objetos por evaporación de líquidos retenidos F26B). › para obtener sólidos secos (B01D 1/24 tiene prioridad).
- B01J2/04 B01 […] › B01J PROCEDIMIENTOS QUÍMICOS O FÍSICOS, p. ej. CATÁLISIS O QUÍMICA DE LOS COLOIDES; APARATOS ADECUADOS. › B01J 2/00 Procedimientos o dispositivos para la granulación de sustancias, en general; Tratamiento de materiales particulados para hacer que fluyan libremente, en general, p. ej. haciéndolos hidrófobos. › en un medio gaseoso.
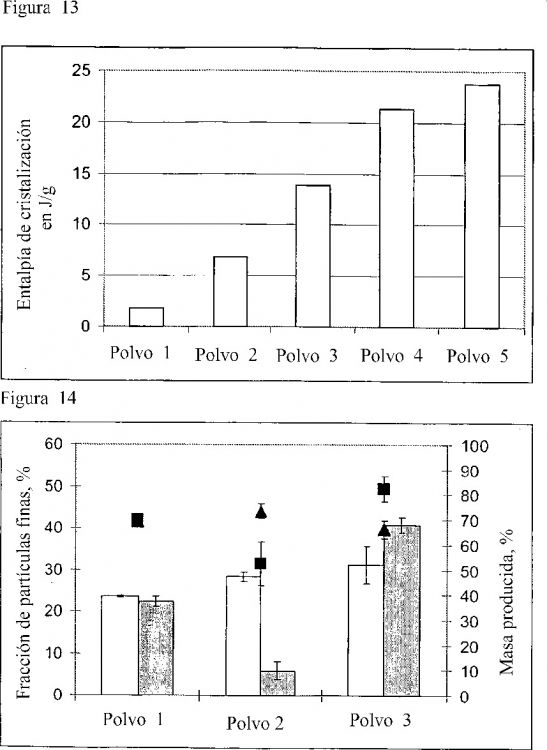
Fragmento de la descripción:
Polvos para inhalación que contienen fenilalanina.
Antecedentes de la invención
La invención se refiere a polvos que contienen fenilalanina, en particular, polvos secados por pulverización, los cuales contienen fenilalanina y una proteína, en donde la proteína es de preferencia una substancia activa, y en particular una substancia activa farmacéutica. Los polvos de la invención contienen una proporción de fenilalanina de por lo menos el 30% (p/p), de preferencia el 40% (p/p) y opcionalmente por lo menos una segunda substancia farmacéutica auxiliar compatible, a saber, un azúcar, el cual aumenta la estabilidad de la proteína.
La invención se refiere además, a un procedimiento para la obtención de estos polvos que contienen fenilalanina, así como a su empleo en particular como medicamento para inhalación. Proteínas preferidas son las substancias activas farmacéuticas como los anticuerpos, fragmentos de anticuerpos, proteínas de fusión con anticuerpos o fragmentos de anticuerpos, hormonas, factores de crecimiento, enzimas, citocinas, interferones o similares, para el tratamiento local de las vías respiratorias o para tratamiento sistémico.
Las preparaciones de proteínas o respectivamente substancias activas/preparaciones de substancias activas, formuladas en soluciones acuosas, están sujetas a parciales inestabilidades, las cuales pueden conducir a una disminución de la actividad o respectivamente bioactividad, y a un aumento de la toxicidad o respectivamente incompatibilidad. Esto vale tanto para los productos farmacéuticos clásicos como también para las proteínas y en particular, para substancias activas que contienen péptidos o respectivamente proteínas. La estabilidad de las proteínas o respectivamente de las substancias activas farmacéuticas puede verse influida positivamente por las variaciones en la estructura (interna) o por adición de substancias auxiliares adecuadas (externas).
Un procedimiento habitual para la estabilización externa de proteínas o substancias activas farmacéuticas, es el empleo de substancias auxiliares apropiadas. Las substancias auxiliares pueden clasificarse groseramente en las siguientes clases: azúcares y polioles, aminoácidos, aminas, sales, polímeros y tensioactivos.
Los azúcares y polioles se emplean a menudo como estabilizadores no específicos. Su efecto estabilizante se atribuye principalmente en las proteínas o substancias activas biológicas, a la exclusión preferencial
(Xie y Timasheff, 1997, Biophysical Chemistry, 64(1-3), 25-43; Xie y Timasheff, 1997, Protein Science (Ciencia de las proteínas
), 6(1), 211-221; Timasheff, 1998, Advances in protein chemistry (Progresos en la química de las proteínas
), 51, 355-432). En la selección de los azúcares, las proteínas o substancias activas biológicas, deben evitarse al máximo los azúcares reductores. De preferencia, se emplean la sacarosa y la trehalosa como azúcares no reductores. Otros ejemplos de substancias auxiliares apropiadas son la glucosa, sorbitol, glicerina (Boctor y Mehta, 1992, Journal of Pharmacy and Pharmacology (Revista de Farmacia y Farmacología
), 44 (7), 600-3; Timashefff, 1993, Annual review of biophysics and biomolecular structure (Revisión anual de la estructura biofísica y biomolecular
), 22, 67-97; Chang et al., 1993, Pharmaceutical Research (Investigación Farmacéutica
), 10(10), 1478-83) y Mannitol (Hermann et al.,1996, Pharmaceutical Biotechnology (Biotecnología Farmacéutica
), 9 (Formulation, Characterization and Stability of Protein Drugs
(Formulación, caracterización y estabilidad de los fármacos de proteína
), 303-328; Chan et al., 1996, Pharmaceutical Research (Investigación Farmacéutica
), 13(5), 756-761). Además es conocido, que los más diferentes polímeros, que son estabilizadores de las proteínas o substancias activas farmacéuticas, actúan como por ejemplo, los anticuerpos. La albúmina de suero humano (HSA) empleada a menudo en el pasado dispone de muy buenas propiedades estabilizadoras, aunque sin embargo, debido a su potencial contaminación con agentes patógenos blood-bourne
(de transmisión sanguínea
) es hoy en día, inadecuada. Entre los polímeros conocidos hasta el momento destaca la hidroxi-propil-ß-ciclodextrina (HP-ß-CD) como particularmente adecuada, dado que se aplica por vía parenteral sin peligro alguno. Otros ejemplos son los dextranos de alto peso molecular (18 a 82 kD), la polivinilpirrolidona (PVP), la heparina, la gelatina tipo A y B así como el hidroxietilalmidón (HES), la heparina, el sulfato de dextrano, el ácido polifosfórico, el ácido poli-L-glutamínico, y la poli-L-lisina.
Con los azúcares y polioles pueden emplearse también aminoácidos estabilizantes, solos o en combinación con otras substancias auxiliares. De preferencia, se emplean los aminoácidos para la estabilización de las proteínas. Por ejemplo, la adición de histidina, glicina, aspartato de sodio (Na-Asp), glutamato e hidrocloruro de lisina (Lys-HCl), inhibe la agregación del rhKGF en 10 mM de tampón de fosfato de sodio (pH 7,0) juntamente con 5% de manitol (Zhang et al., 1995, Biochemistry, 34 (27), 8631-41). La combinación de aminoácidos y propilenglicol mejora por ejemplo, la estabilidad estructural del rhCNTF (Dix et al., 1995, Pharmaceutical Research (Supplement) (Investigación Farmacéutica (Suplemento)
), 12, pág. 97). La lisina y la arginina aumenta la termoestabilidad de la IL-1R (aumento de Tm), mientras que por el contrario, la glicina y la alanina actúan como desestabilizantes (Remmele et al., 1998, Pharmaceutical Research (Investigación Farmacéutica
), 15(2), 200-208).
Además, puede aumentarse la estabilidad de los polvos con un contenido de proteína o substancias activas farmacéuticas mediante diferentes procedimientos de secado. El secado tiene lugar asimismo la mayoría de las veces en presencia de substancias auxiliares, las cuales dan estabilidad a las proteínas o substancias activas, y deben mejorar las propiedades de los polvos secos. Un factor decisivo en la estabilización por secado es la inmovilización de la proteína o de la substancia activa en una matriz amorfa. El estado amorfo posee una alta viscosidad con escasa movilidad molecular y pequeña reactividad. Las substancias auxiliares ventajosas deben pues, estar en situación de formar una matriz amorfa a la temperatura de transición vítrea lo más alta posible, en la cual la proteína o la substancia activa está incrustada. La selección de las substancias auxiliares depende por lo tanto en particular, de su capacidad de estabilización. Además, juegan también un papel decisivo, factores como la inocuidad farmacéutica de las substancias auxiliares así como su influencia sobre la formación de partículas, la dispersibilidad y la propiedad de fluidez, en particular cuando se trata de un procedimiento de secado por pulverización.
El secado por pulverización representa un procedimiento particularmente adecuado para aumentar la estabilidad química y física de las proteínas o substancias activas farmacéuticas del tipo péptido/proteína (Maa et al., 1998, Pharmaceutical Research (Investigación Farmacéutica
), 15 (5), 768-775). Particularmente, en el campo de la terapia pulmonar se emplea de forma creciente el secado por pulverización (US 5.626.874; US 5.972.388; Broadhead et al., 1994, J. Pharm. Pharmacol., 46(6), 458-467), dado que la aplicación por inhalación representa también actualmente una alternativa al tratamiento de las enfermedades sistémicas (WO 99/07340). Es premisa indispensable que el tamaño medio de partícula aerodinámico (MMDA = diámetro aerodinámico de la masa media), de la partícula de polvo esté en el margen de 1-10 µm, de preferencia 1-7,5 µm, de manera que las partículas puedan llegar a las partes más profundos del pulmón y con ello al torrente circulatorio sanguíneo. La patente DE-A-179 22 07 describe como ejemplo, la obtención de las correspondientes partículas de secado por pulverización. Entre tanto se han descrito un gran número de procedimientos para la obtención de los polvos correspondientes (WO 93/31479; WO 96/09814; WO 96/32096; WO 96/32149; WO 97/41833; WO 97/44013; WO 98/16205; WO 98/31346; WO 99/66903; WO 00/10541; WO 01/13893; Maa et al., 1998, supra; Vidgrén et al., 1987, Int. J. Pharmaceutics, 35, 139-144; Niven et al., 1994, Pharmaceutical Research (Investigación Farmacéutica
) 11, (8), 1101-1109).
Como substancias auxiliares en el secado por...
Reivindicaciones:
1. Polvo que contiene una proteína y fenilalanina, caracterizado porque, el polvo contiene por lo menos un 30% (p/p) de fenilalanina, de preferencia por lo menos un 40% (p/p) de fenilalanina.
2. Polvo según la reivindicación 1, caracterizado porque, el polvo contiene por lo menos otra substancia auxiliar como un azúcar o un poliol.
3. Polvo según la reivindicación 1 ó 2, caracterizado porque, el polvo se ha secado por pulverización.
4. Polvo según una de las reivindicaciones 2 a 3, caracterizado porque, el azúcar es un azúcar no reductor, seleccionado del grupo formado por un disacárido y un oligosacárido.
5. Polvo según una de las reivindicaciones 1 a 3, caracterizado porque, la proteína es una substancia activa, de preferencia una substancia activa farmacéutica como un anticuerpo, un fragmento de anticuerpo, una proteína de fusión con partes de anticuerpos o un anticuerpo conjugado, un factor de crecimiento, una hormona o una enzima.
6. Polvo según una de las reivindicaciones 1 a 5, caracterizado porque, el tamaño medio de partícula aerodinámica (MMAD = Mass median aerodynamic diameter (diámetro aerodinámico medio de la masa)), de la partícula de polvo es menor de 10 µm, de preferencia menor de 7,5 µm, con mayor preferencia en el margen entre 1-6 µm ó respectivamente 3-6 µm ó 5-7 µm.
7. Composición farmacéutica que contiene un polvo según una de las reivindicaciones 1 a 6.
8. Procedimiento para la preparación de un polvo según una de las reivindicaciones 1 a 6, caracterizado porque,
a) se prepara una solución de fenilalanina,
b) se añade por lo menos una proteína y opcionalmente por lo menos otra substancia auxiliar como un azúcar o un poliol,
c) la solución o suspensión así obtenida se pulveriza a una temperatura de entrada preferentemente de 90-200ºC, y una temperatura de salida preferentemente de 40-150ºC, y
d) las partículas obtenidas se separan del gas de secado.
9. Procedimiento según la reivindicación 8, caracterizado porque, en el caso de la proteína se trata de una substancia activa farmacéutica.
10. Procedimiento según la reivindicación 8 ó 9, caracterizado porque, entre el paso a) y el b) se efectúan los siguientes otros pasos:
- un calentamiento de la solución de fenilalanina, de preferencia a 80ºC,
- un enfriamiento de la solución de fenilalanina hasta por debajo de la temperatura de desnaturalización de la correspondiente proteína que hay que añadir, en donde el enfriamiento tiene lugar de preferencia hasta la temperatura ambiente.
11. Procedimiento según la reivindicación 8 a 10, caracterizado porque, la solución o suspensión se pulveriza en el paso c) mediante por lo menos una tobera de presión o por lo menos un pulverizador rotativo o por lo menos una tobera venturi o por lo menos un nebulizador de ultrasonidos o por lo menos una tobera para dos substancias.
12. Procedimiento según la reivindicación 8 a 11, caracterizado porque, la separación de las partículas en el paso d) tiene lugar mediante por lo menos un separador de partículas, de preferencia mediante por lo menos un ciclón.
13. Polvo según la reivindicación 1 a 6, ó composición farmacéutica según la reivindicación 7, para emplear como medicamento.
14. Polvo según una de las reivindicaciones 1 a 6, ó una composición farmacéutica según la reivindicación 7, para el tratamiento de enfermedades de las vías respiratorias o enfermedades sistémicas.
15. Polvo según una de las reivindicaciones 1 a 6, ó una composición farmacéutica según la reivindicación 7, para el tratamiento de enfermedades de las vías respiratorias o enfermedades sistémicas según la reivindicación 14, en donde la enfermedad se selecciona del grupo formado por, cáncer de pulmón, inflamación de los pulmones, fibrosis quística, COPD (enfermedad pulmonar obstructiva crónica), asma, enfermedades antiinflamatorias, enfermedades víricas como por ejemplo, la causada por el virus sincicitial respiratorio (RSV).
16. Empleo de un polvo según la reivindicaciones 1 al 6, ó una composición farmacéutica según la reivindicación 7, para la preparación de un medicamento para el tratamiento de enfermedades de las vías respiratorias.
17. Empleo según la reivindicación 16, en donde la enfermedad se selecciona del grupo formado por: cáncer de pulmón, inflamación de los pulmones, fibrosis quística, COPD (enfermedad pulmonar obstructiva crónica), asma, enfermedades antiinflamatorias, enfermedades víricas como por ejemplo la causada por el virus sincicitial respiratorio (RSV).
Patentes similares o relacionadas:
Composiciones biocidas y métodos para usarlas, del 1 de Julio de 2020, de Rochal Industries, LLC: Una composición antimicrobiana, que comprende: un poli(hexametileno biguanida) (PHMB) en una cantidad que varía de 0,05 a 1,5% en peso, un agente quelante […]
Nuevos usos terapéuticos de derivados de la bencilidenguanidina para el tratamiento de proteopatías, del 20 de Mayo de 2020, de InFlectis BioScience: Compuesto de la fórmula (I), o una sal farmacéuticamente aceptable del mismo, **(Ver fórmula)** o un tautómero de los mismos donde: […]
Formulaciones farmacéuticas que incluyen un compuesto de amina, del 13 de Mayo de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un comprimido revestido que comprende: (a) un núcleo de comprimido en donde el núcleo de comprimido comprende (i) opcionalmente al menos un agente antidiabético […]
Terapia para la diabetes, del 13 de Mayo de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Un inhibidor de DPP-4, que es linagliptina, para uso terapéutico por administración subcutánea.
Derivados de biguanida N1-cíclica amina-N5-sustituida, métodos de preparación de la misma y composición farmacéutica que comprende la misma, del 29 de Abril de 2020, de Immunomet Therapeutics Inc: Un compuesto de la siguiente fórmula 1 o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en la que R1 y R2 se toman junto con el nitrógeno al que están […]
Composición farmacéutica para tratar enfermedades asociadas con la resistencia a la insulina y la disfunción de células beta, del 8 de Abril de 2020, de MERCK PATENT GMBH: 2-Metil-4,5-di-(metilsulfonil)-benzoil-guanidina, y/o una sal y/o solvato fisiologicamente aceptable del mismo, para su uso en el tratamiento profilactico o terapeutico […]
Composición farmacéutica que comprende un inhibidor de SGLT2, un inhibidor de DPP-IV y opcionalmente un agente antidiabético adicional y sus usos, del 8 de Abril de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Una composición farmacéutica que comprende: (a) el inhibidor de SGLT2 que es 1-cloro-4-(b-D-glucopiranos-1-il)-2-[4-((S)-tetrahidrofurano-3-iloxi)-bencil]- […]
Composición para el tratamiento de la cavidad de la garganta/orofaringe, del 25 de Marzo de 2020, de MARIA CLEMENTINE MARTIN KLOSTERFRAU VERTRIEBSGESELLSCHAFT MBH: Composición en forma de una dosificación líquida para su utilización en el tratamiento profiláctico o terapéutico de enfermedades inflamatorias de la cavidad oral y/o […]