NUEVAS SALES DE ATORVASTATINA Y COMPOSICIONES FARMACEUTICAS QUE LAS CONTIENEN.
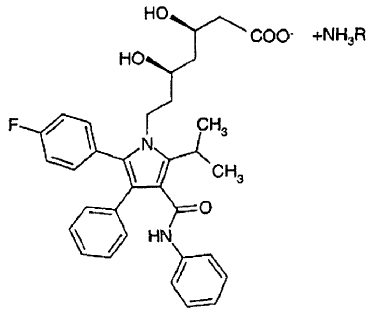
Compuestos de fórmula general (I) en la que R representa un grupo de fórmula (II),
(III) o (IV), y las modificaciones amorfas o polimorfas de las mismas
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/HU03/00024.
Solicitante: RICHTER GEDEON NYRT.
Nacionalidad solicitante: Hungría.
Dirección: GYOMROI UT 19-21,1103 BUDAPEST.
Inventor/es: VUKICS, KRISZTINA, FISCHER, JANOS, LEVAI, SANDOR, TIHANYI, KAROLY, HEGEDUS, BELA, DR., ERDELYI,PETER, VASTAG,MONIKA, BALINT,SANDORNE, LANCZOS,KRISZTINA.
Fecha de Publicación: .
Fecha Concesión Europea: 20 de Enero de 2010.
Clasificación Internacional de Patentes:
- C07D207/34 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 207/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros no condensados con otros ciclos, con solamente un átomo de nitrógeno como heteroátomo. › con heteroátomos o con átomos de carbono que tienen tres enlaces a heteroátomos con a lo sumo un enlace a halógeno, p. ej. radicales éster o nitrilo, unidos directamente a los átomos de carbono del ciclo.
Clasificación PCT:
- A61K31/40 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen ciclos con cinco eslabones con un nitrógeno como único heteroátomo de un ciclo, p. ej. sulpirida, succinimida, tolmetina, buflomedil.
- A61P3/06 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 3/00 Medicamentos para el tratamiento de trastornos del metabolismo (de la sangre o de fluido extracelular A61P 7/00). › Antihiperlipidémicos.
- C07D207/34 C07D 207/00 […] › con heteroátomos o con átomos de carbono que tienen tres enlaces a heteroátomos con a lo sumo un enlace a halógeno, p. ej. radicales éster o nitrilo, unidos directamente a los átomos de carbono del ciclo.
Clasificación antigua:
- A61K31/40 A61K 31/00 […] › que tienen ciclos con cinco eslabones con un nitrógeno como único heteroátomo de un ciclo, p. ej. sulpirida, succinimida, tolmetina, buflomedil.
- A61P3/06 A61P 3/00 […] › Antihiperlipidémicos.
- C07D207/34 C07D 207/00 […] › con heteroátomos o con átomos de carbono que tienen tres enlaces a heteroátomos con a lo sumo un enlace a halógeno, p. ej. radicales éster o nitrilo, unidos directamente a los átomos de carbono del ciclo.
Fragmento de la descripción:
Nuevas sales de atorvastatina y composiciones farmacéuticas que las contienen.
La invención se refiere a sales de atorvastatina formadas con lisina, arginina y ornitina. La invención también se refiere a modificaciones amorfas y también polimorfas de estas sales y a composiciones farmacéuticas con actividad reductora del nivel de colesterol que contienen los compuestos arriba indicados como principios activos.
La atorvastatina (nombre químico: ácido (3R,5R)-7-[3-fenil-4-[(fenilamino)carbonil]-2-(4-fluorofenil)-5-(1-metiletil)pirrol-1-il]-3,5-dihidroxi-heptanoico) es conocida como compuesto reductor del nivel de colesterol. En la Patente Europea número EP 409 281 se describen algunas sales de atorvastatina farmacéuticamente aceptables. En las reivindicaciones de dicha patente se incluyen las siguientes sales: sal monosódica, sal monopotásica, hemisal de calcio, sal de N-metil-glucamina, hemisal de magnesio, hemisal de zinc, sal de 1-desoxi-1-metilamino-D-glucitol. Las siguientes bases están enumeradas en la descripción como componentes formadores de sal: hidróxido de sodio, hidróxido de potasio, hidróxido de litio, hidróxido de calcio, 1-desoxi-2-metilamino-D-glucitol, hidróxido de magnesio, hidróxido de zinc, hidróxido de aluminio, hidróxido de hierro (II) y de hierro (III), hidróxido de amonio y bases orgánicas, por ejemplo N-metilglucamina, colina, arginina y similares.
El principio activo de un fármaco que contiene atorvastatina, que está en el mercado desde 1997, es la hemisal de calcio de atorvastatina, evidentemente la más adecuada para la administración farmacéutica entre las sales descritas en la patente arriba indicada. Dicha patente no contiene ninguna observación con respecto a un posible polimorfismo del compuesto.
En la patente número WO 97/03959 ya se han descrito tres modificaciones cristalinas diferentes de la hemisal de calcio de atorvastatina, denominadas formas cristalinas I, II y IV. Al mismo tiempo, el producto de la patente arriba indicada está caracterizado como un material amorfo cuyas propiedades de filtración y producibilidad industrial no son satisfactorias.
En la descripción se hace hincapié en la forma I de las hemisales de calcio de atorvastatina cristalinas, que se presenta en forma de trihidrato. De acuerdo con la descripción, la síntesis de esta modificación se lleva a cabo mediante cristalización a partir de una solución acuoso-alcohólica utilizando cristales de siembra o añadiendo terc-butilmetil éter a la solución.
La ventaja de la hemisal de calcio de atorvastatina cristalina consiste en que el producto se filtra más fácilmente que el producto amorfo: mientras que la filtración de la forma amorfa tarda más de una hora, la filtración de la misma cantidad del producto cristalino sólo tarda unos segundos.
La patente número WO 97/03958 describe la forma cristalina III de la hemisal de calcio de atorvastatina, que se puede obtener a partir de la forma cristalina II mediante un método bastante complicado. Por último, de acuerdo con la patente número WO 01/36384 también se conoce la forma cristalina V de la hemisal de calcio de atorvastatina, que se obtiene bajo condiciones similares a las de la forma cristalina I.
Las distintas publicaciones de la literatura representan, sorprendentemente, una opinión muy diferente con respecto a la modificación amorfa de la hemisal de calcio de atorvastatina. Una de las razones de la contradicción consiste en que la modificación amorfa se filtra mal y esto conduce a problemas tecnológicos. La otra razón de la contradicción consiste en la observación biológica de acuerdo con la cual la absorción de la modificación amorfa de la hemisal de calcio de atorvastatina es peor que la de la forma cristalina. Oishi y colaboradores [Yakuri a Vhiryo, 26 (8), 1241-1252 (1998)] descubrieron que, en el humano, la forma cristalina de la hemisal de calcio de atorvastatina se absorbe a una velocidad considerablemente mayor y en mayor medida que la forma amorfa de la hemisal de calcio de atorvastatina. La forma amorfa de la hemisal de calcio de atorvastatina se describe en las siguientes patentes: WO 97/03960, WO 00/71116, WO 01/28999 y WO 01/42209.
Es sabido que la hemisal de calcio de atorvastatina es un agente reductor del nivel de colesterol, cuya actividad se basa en la inhibición de la enzima HMG-CoA reductasa. Sin embargo, su absorción no es perfecta: sólo se absorbe aproximadamente un 30% de la dosis administrada. Véase Corsini D. M. y col.: Pharm. Res. 14 (11) Suppl. S253 (1997). La biodisponibilidad sistémica es sólo del 12%.
La concentración adecuada de fármacos en organismos vivos, es decir la biodisponibilidad adecuada, es esencial para su efecto terapéutico. La biodisponibilidad está determinada básicamente por dos factores: la absorción y la estabilidad metabólica. La velocidad y la medida de la absorción de un principio activo de un fármaco pueden depender considerablemente de sus diferentes formas: sales, modificaciones polimorfas o solvatos.
La selección de la sal y forma cristalina más apropiadas es particularmente importante cuando la biodisponibilidad de un fármaco está limitada por la absorción. El uso de una sal o forma cristalina y/o solvato determinado proporciona unas características intrínsecas a las formas farmacéuticas que no se pueden lograr mediante simples soluciones tecnológicas, como molienda u otros medios de formulación de fármacos (adición de sustancias auxiliares, desintegradores y similares).
La absorción in vivo se puede examinar mediante el ensayo de Caco-2, con el que se mide la penetración del fármaco a través de la capa celular epitelial intestinal humana (literatura: Pade V. y col.: J. Pharm. Sci. 87, 1604-7 (1998) y Artursson P. y col.: Biochem. Biophys. Res. Comm. 175, 880-885 (1991)). La esencia del método consiste en que se comprimen microtabletas con las sustancias del fármaco a examinar sin añadir sustancias auxiliares. Las microtabletas se producen bajo las mismas condiciones y con la misma fuerza de compresión. Por consiguiente, la velocidad de penetración a través de la capa celular viene determinada por las características intrínsecas de las sustancias examinadas.
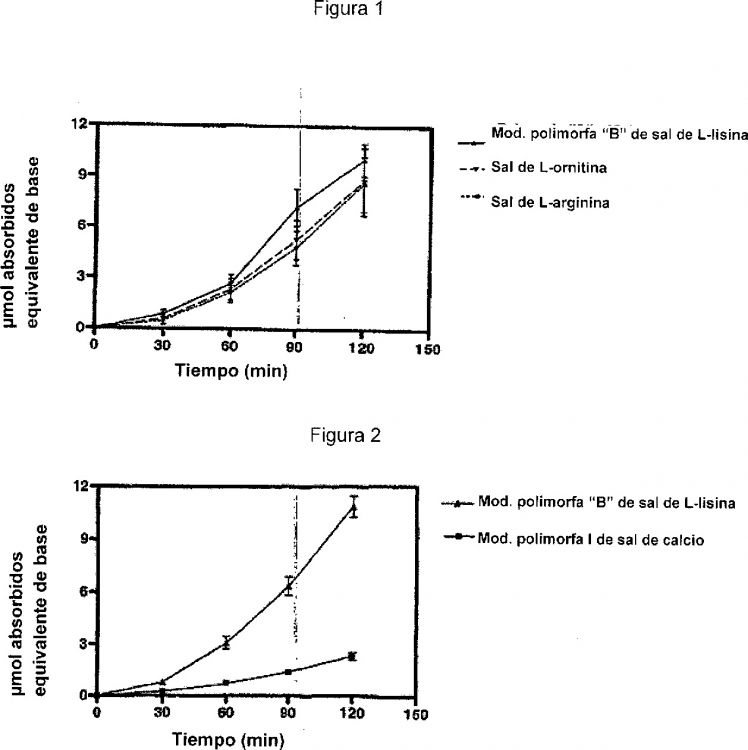
De acuerdo con nuestros experimentos, las sales de atorvastatina formadas con aminoácidos básicos de acuerdo con nuestra invención presentan una penetración considerablemente mejor que la de la forma cristalina I de la hemisal de calcio de atorvastatina.
Por consiguiente, nuestra invención se basa en la observación de que las sales de atorvastatina formadas con lisina, arginina u ornitina, que se pueden obtener bajo condiciones apropiadamente seleccionadas, muestra propiedades más ventajosas que las sales conocidas.
De acuerdo con los hechos arriba mencionados, la invención se refiere a las sales de atorvastatina formadas con un aminoácido básico de fórmula general (I), en la que R representa un grupo formado a partir de lisina, arginina u ornitina, y las modificaciones amorfas o polimorfas de las mismas, por consiguiente las sales de atorvastatina formadas con L-, D- y DL-lisina, L-arginina y L-ornitina.
La invención también se refiere a la modificación polimorfa "A" de la sal de atorvastatina formada con L-lisina, en la que las distancias entre las capas de difracción de polvo de rayos X de la molécula son las siguientes: 9,351; 5,126; 4,693; 4,558; 4,239; 4,055; 3,828; 3,617; 3,441; 3,343; 3,203; 3,107; 2,918; 2,709; 2,595 (Å), las bandas infrarrojas características son: 3643, 3322, 1646, 1583, 1423, 1084, 775, 699 cm-1, y las bandas Raman son: 2981, 1647, 1480, 734, 677, 635, 513, 200 cm-1; y a la modificación polimorfa "B" de la sal de atorvastatina formada con L-lisina, en la que las distancias entre las capas de difracción de polvo de rayos X de la molécula son las siguientes: 20,971; 13,143; 8,606; 7,512; 6,687; 5,168; 4,778; 4,559; 4,131; 3,941; 3,839; 3,734; 3,639; 3,236; 3,025; 2,793 (Å), las bandas infrarrojas características son: 3370, 1652, 1412, 1317, 1214, 922, 692, 550 cm-1, y las bandas Raman son: 3066, 2950, 1650, 1528, 924, 475, 232, 215 cm-1.
La invención se refiere a la modificación polimorfa "C" de la sal de atorvastatina formada con L-lisina, en la que las distancias entre las capas de difracción de polvo de rayos X de la molécula son las siguientes: 18,686; 13,075; 9,177; 7,762; 6,753; 5,250; 4,873; 4,725;...
Reivindicaciones:
1. Compuestos de fórmula general (I) en la que R representa un grupo de fórmula (II), (III) o (IV), y las modificaciones amorfas o polimorfas de las mismas
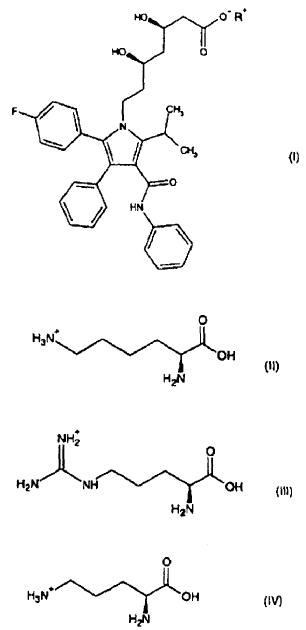
2. Compuesto según la reivindicación 1, que consiste en sales de L-lisina, D-lisina y DL-lisina de atorvastatina.
3. Compuesto según la reivindicación 1, que consiste en sal de L-lisina de atorvastatina.
4. Compuesto según la reivindicación 1, que consiste en sal de L-arginina de atorvastatina.
5. Compuesto según la reivindicación 1, que consiste en sal de L-ornitina de atorvastatina.
6. Modificación polimorfa "A" de sal de L-lisina de atorvastatina de la reivindicación 3, caracterizada por las siguientes distancias entre las capas de difracción de polvo de rayos X de la molécula: 9,351; 5,126; 4,693; 4,558; 4,239; 4,055; 3,828; 3,617; 3,441; 3,343; 3,203; 3,107; 2,918; 2,709; 2,595 (Å); las bandas infrarrojas características son: 3643, 3322, 1646, 1583, 1423, 1084, 775, 699 cm-1, y las bandas Raman son: 2981, 1647, 1480, 734, 677, 635, 513, 200 cm-1.
7. Modificación polimorfa "B" de la sal de L-lisina de atorvastatina de la reivindicación 3, caracterizada por las siguientes distancias entre las capas de difracción de polvo de rayos X de la molécula: 20,971; 13,143; 8,606; 7,512; 6,687; 5,168; 4,778; 4,559; 4,131; 3,941; 3,839; 3,734; 3,639; 3,236; 3,025; 2,793 (Å); las bandas infrarrojas características son: 3370, 1652, 1412, 1317, 1214, 922, 692, 550 cm-1, y las bandas Raman son: 3066, 2950, 1650, 1528, 924, 475, 232, 215 cm-1.
8. Modificación polimorfa "C" de la sal de L-lisina de atorvastatina de la reivindicación 3, caracterizada por las siguientes distancias entre las capas de difracción de polvo de rayos X de la molécula: 18,686; 13,075; 9,177; 7,762; 6,753; 5,250; 4,873; 4,725; 4,528; 4,211; 3,923; 3,706; 3,455; 3,135 y 3,038 (Å); las bandas infrarrojas características son: 3365, 1649, 1596, 1527, 1217, 1031, 851, 877, 810, 747, 582, 505 cm-1, y las bandas Raman son: 3067, 2914, 1646, 1605, 1529, 1371, 1160, 1001, 826 cm-1.
9. Modificación amorfa de la sal de L-lisina de atorvastatina de la reivindicación 3, caracterizada por las siguientes bandas infrarrojas características: 1648, 1596, 1559, 1530, 1220, 916, 886, 808, 749, 732, 690, 616, 507 cm-1; y las bandas Raman son: 3062, 2922, 1648, 1604, 1530, 1481, 1244, 1159, 999, 820 cm-1.
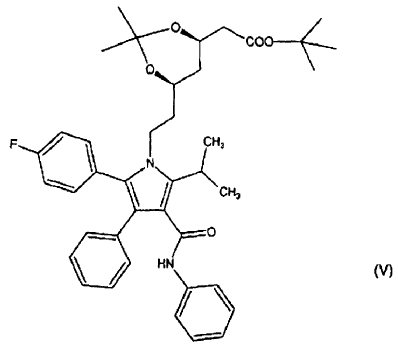
10. Procedimiento para la síntesis de las sales de atorvastatina formadas con un aminoácido básico de fórmula general (I), en la que R tiene el significado definido en la reivindicación 1, y de las modificaciones polimorfas de las mismas, caracterizado por la disociación de los grupos protectores de un derivado de atorvastatina protegido, preferentemente un compuesto de fórmula (V), en un disolvente; reacción del ácido de atorvastatina así obtenido con un aminoácido apropiado o la sal del mismo en un disolvente; y cristalización de la modificación polimorfa deseada en caso necesario con el cambio de disolventes
11. Composición farmacéutica reductora del nivel de colesterol, caracterizada porque incluye un compuesto según la reivindicación 1-9 como principio activo en una cantidad del 0,10-99,90% p/p y excipientes y sustancias auxiliares conocidos en una cantidad del 0,10-99,90% p/p.
Patentes similares o relacionadas:
Proceso para la preparación de antagonistas de receptor androgénico e intermedios de los mismos, del 26 de Febrero de 2020, de ORION CORPORATION: Un proceso para la preparación de 2-cloro-4-(1H-pirazol-3-il)benzonitrilo de fórmula (V) **(Ver fórmula)** que comprende las etapas de […]
Derivados de pirrolamida sustituidos con glioxamida y su uso como medicamentos para el tratamiento de la hepatitis B, del 4 de Diciembre de 2019, de Janssen Sciences Ireland Unlimited Company: Un compuesto seleccionado entre los siguientes compuestos 1-102: Compuesto 1: (R)-4-(2-(sec-butilamino)-2-oxoacetil)-N-(4-fluoro-3-metilfenil)-1-metil-1H-pirrol-2-carboxamida; […]
Fenilpirrolcarboxamidas sustituidas con actividad terapéutica en VIH, del 6 de Noviembre de 2019, de NEW YORK BLOOD CENTER, INC.: Un compuesto representado por una fórmula A: **(Ver fórmula)** en donde Ph es fenilo opcionalmente sustituido; **(Ver fórmula)** […]
Compuestos de heteroarilo con una unidad acíclica como puente, del 31 de Julio de 2019, de INTERVET INTERNATIONAL B.V: Un compuesto de fórmula (I) y solvatos, N-óxidos y sales farmacéuticamente aceptables del mismo,**Fórmula** en la que R1 es halógeno, alquilo, […]
Formas de sal de de atorvastatina con benetamina, del 3 de Julio de 2019, de PFIZER PRODUCTS INC.: Una Forma A de atorvastatina con benetamina que tiene un patrón de difracción de rayos x en polvo que contiene los siguientes máximos 2θ medidos usando […]
Cristal de (S)-1-(2-Hidroxietil)-4-metil-N-[4-(metilsulfonil)fenil]-5-[2-(trifluorometil)fenil]-1H-pirrol-3-carboxamida, del 20 de Febrero de 2019, de DAIICHI SANKYO COMPANY, LIMITED: Un cristal de (S)-1-(2-hidroxietil)-4-metil-N-[4-(metilsulfonil)fenil]-5-[2-(trifluorometil)fenil]-1H-pirrol-3- carboxamida representado por el […]
Derivados de pirrol bicíclicos útiles como agonistas de GPR120, del 9 de Enero de 2019, de JANSSEN PHARMACEUTICA NV: Un compuesto de fórmula (I)**Fórmula** en el que R1 se selecciona del grupo que consiste de 3-fluorofenilo, 4-fluorofenilo, 2,4-difluorofenilo, […]
Derivados de pirrolamida sustituidos con glioxamida y su uso como medicamentos para el tratamiento de la hepatitis B, del 21 de Febrero de 2018, de Janssen Sciences Ireland UC: Un compuesto de Fórmula (IA)**Fórmula** o un estereoisómero o una forma tautomérica de este, donde: cada X representa independientemente CR7; R1, R2 […]