NUEVA FORMA CRISTALINA DE HIDROCLORURO DE LERCANIDIPINO Y PROCEDIMIENTO PARA SU PREPARACION.
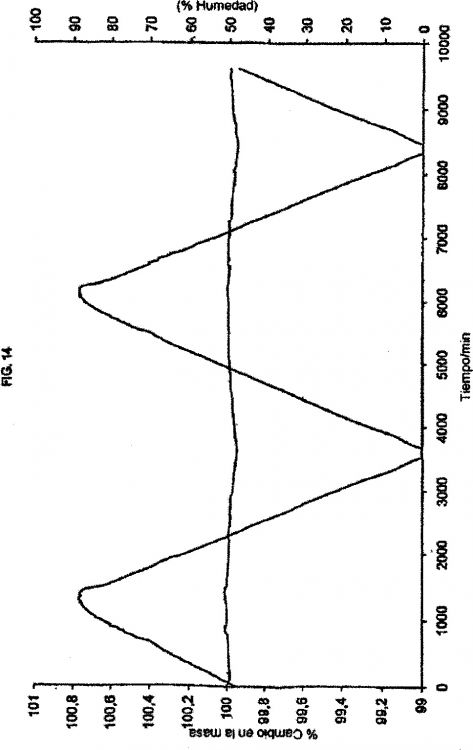
Forma cristalina (I) de hidrocloruro de lercanidipino que presenta un espectro de difracción de rayos X tal como se representa en la Figura 11,
para utilizar en un método de tratamiento antihipertensor
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E05106264.
Solicitante: RECORDATI IRELAND LIMITED.
Nacionalidad solicitante: Irlanda.
Dirección: RAHEENS EAST,RINGASKIDDY COUNTY CORK.
Inventor/es: LEONARDI, AMEDEO, BONIFACIO, FAUSTO, CAMPANA, FRANCESCO, DE IASI, GIANLUCA.
Fecha de Publicación: .
Fecha Solicitud PCT: 5 de Agosto de 2002.
Fecha Concesión Europea: 30 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- C07D211/90 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 211/00 Compuestos heterocíclicos que contienen ciclos hidrogenados de piridina, no condensados con otros ciclos. › Atomos de carbono que tienen tres enlaces a heteroátomos con a lo sumo un enlace a halógeno.
Clasificación PCT:
- A61K31/44 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Piridinas no condensadas; Sus derivados hidrogenados.
- A61P9/12 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 9/00 Medicamentos para el tratamiento de trastornos en el aparato cardiovascular. › Antihipertensivos.
- C07D211/90 C07D 211/00 […] › Atomos de carbono que tienen tres enlaces a heteroátomos con a lo sumo un enlace a halógeno.
Clasificación antigua:
- A61K31/44 A61K 31/00 […] › Piridinas no condensadas; Sus derivados hidrogenados.
- A61P9/12 A61P 9/00 […] › Antihipertensivos.
- C07D211/90 C07D 211/00 […] › Atomos de carbono que tienen tres enlaces a heteroátomos con a lo sumo un enlace a halógeno.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Nueva forma cristalina de hidrocloruro de lercanidipino y procedimientos para su preparación.
Campo de la invención
La presente invención se refiere a la nueva forma cristalina (I) del hidrocloruro de lercanidipino para utilizar en un método de tratamiento con antihipertensores, y a los procedimientos de preparación de dicha forma.
Antecedentes de la invención
El lercanidipino (metil 1,1,N-trimetil-N-(3,3-difenilpropil)-2-aminoetil 1,4-dihidro-2,6-dimetil-4-(3-nitrofenil)-piridina-3,5-dicarboxilato) es un antagonista cálcico de la dihidropiridina muy lipófilo que presenta una larga duración de acción y una elevada selectividad vascular. Su mecanismo de actividad antihipertensora se atribuye al efecto relajante directo sobre el músculo liso vascular, lo que disminuye la resistencia periférica total. La dosis inicial recomendada de lercanidipino como monoterapia es de 10 mg diarios mediante administración oral, con un ajuste de la dosis cuando sea necesario hasta 20 mg diarios. El lercanidipino se absorbe rápidamente tras la administración oral y los valores máximos en plasma se alcanzan al cabo de 2 a 3 horas tras la administración. La eliminación se realiza básicamente por la vía hepática.
Debido a su elevada lipofilia y a su elevado coeficiente de membrana, el lercanidipino combina una corta vida media en plasma con una larga duración de acción. De hecho, la distribución preferente del fármaco en las membranas de las células musculares lisas tiene como resultado una farmacocinética controlada por la membrana que se caracteriza por un efecto farmacológico prolongado. En comparación con otros antagonistas del calcio, el lercanidipino se caracteriza por una aparición gradual y una duración perdurable de acción a pesar de los niveles decrecientes en plasma. Los estudios in vitro demuestran que la respuesta de la aorta de rata a concentraciones elevadas de K+ se puede atenuar con lercanidipino durante 6 horas, incluso después de que el fármaco se ha eliminado del entorno del tejido aórtico.
El lercanidipino se encuentra comercialmente disponible en Recordati S. p. A. (Milán, Italia) y se ha descrito junto con los métodos para sintetizarlo y para descomponerlo en enantiómeros individuales en las patentes US n.º 4.705.797, US n.º 5.767.136, US n.º 4.968.832, US n.º 5.912.351, y n.º US 5.696.139.
Se describe un procedimiento de preparación de lercanidipino en la patente US n.º 4.705.797 e implica el siguiente esquema:
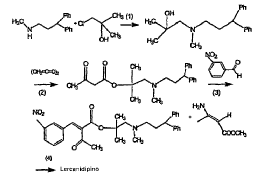
(1): xileno a reflujo; (2) tolueno a 85ºC; (3) HCl + CHCl3 a 0ºC; (4) HO-CH(CH3)2) a reflujo
El lercanidipino bruto es un residuo aceitoso que se ha de purificar mediante cromatografía flash utilizando cloroformo, conteniendo unas cantidades cada vez superiores de acetona, como eluyente. A continuación se evapora el disolvente hasta secarlo y el residuo restante se disuelve en metanol añadiendo un pequeño suplemento de ácido clorhídrico en etanol. Después de la evaporación del disolvente se prepara la sal semihidratada de hidrocloruro diluyendo el ácido clorhídrico en presencia de cloruro sódico, presentando dicho producto una forma amorfa.
Un inconveniente importante del procedimiento de preparación del lercanidipino, tal como se describe en la patente US n.º 4.705.797, es el hecho de que la reacción ciclización que se ha dado a conocer origina varios productos derivados, lo que supone un rendimiento inferior para el producto pretendido. Además, la purificación y el aislamiento del lercanidipino a partir de la mezcla de la reacción resultan bastante complejos, ya que se requieren numerosos tratamientos con distintos disolventes. Por último, las etapas de purificación y aislamiento resultan difíciles de realizar a escala industrial debido a la necesidad de purificar el producto mediante cromatografía en columna. Implica la reacción del ácido 1,4-dihidro-2,6-dimetil-5-metoxicarbonil-4-(3-nitrofenil)-piridina-3-carboxílico con el cloruro de tionilo en diclorometano y dimetilformamida a una temperatura comprendida entre -4 y +1ºC y la posterior esterificación del cloruro ácido obtenido con alcohol 2,N-dimetil-N-(3,3-difenilpropil)-1-amino-2-propílico a una temperatura comprendida entre -10 y 0ºC. El procedimiento origina hidrocloruro de lercanidipino en una forma cristalina no higroscópica anhidra, y evita la formación de productos secundarios no pretendidos y la posterior purificación en las columnas de cromatografía.
Sin embargo, el aislamiento del hidrocloruro de lercanidipino en forma cristalina es de nuevo bastante complejo. Después de evaporar el disolvente de la mezcla de la reacción y disolver el residuo obtenido de este modo en acetato de etilo, la disolución se lava en primer lugar con agua salada, a continuación se lava de nuevo cinco veces con una disolu- ción de carbonato sódico al 10%, cinco veces con ácido clorhídrico 1N, y por último una vez más con agua salada.
Por lo tanto, se necesita en la técnica un procedimiento de preparación de hidrocloruro de lercanidipino en forma cristalina que evite uno más de los inconvenientes de los procedimientos actualmente utilizados.
Además, se observó que el lercanidipino, tal como se produce mediante el segundo procedimiento descrito anteriormente, presentó variabilidad de lote a lote a pesar del control meticuloso del procedimiento e incluso de la observación el punto de fusión que se consideraba característico del producto sólido obtenido mediante el procedimiento del Ejemplo 3 de la patente US n.º 5.767.136 de 186 a 188ºC. Dicha variabilidad se manifestó en diferencias que aparecían (y desaparecían) de forma aparentemente impredecible en el aspecto del producto (por ejemplo, el color), el punto de fusión y solubilidad. Esto originó dudas sobre la pureza y/o reproductibilidad y si se podía asegurar (por ejemplo, ante las autoridades de registro sanitario) que el producto es siempre el mismo.
El documento WO 96/35668 da a conocer un procedimiento para la preparación del hidrocloruro de lercanidipino que implica la reacción de un haluro ácido del ácido 2,6-dimetil-S-metoxicarbonil-4-(3-nitrofenil)-1,4-dihidropiridina-3-carboxílico con 2,N-dimetil-N-(3,3-difenilpropil)-1-amino-2-propanol en un disolvente aprótico. El producto se obtiene mediante unas técnicas de cristalización que se pueden aplicar en la industria.
Las investigaciones posteriores realizadas por los presentes inventores dieron a conocer diferencias lote a lote de biodisponibilidad en animales, y diferencias en el tamaño de los cristales. A lo largo de la investigación de las causas del problema de la variabilidad, los presentes inventores descubrieron sorprendentemente nuevos polimorfos del hidrocloruro de lercanidipino. También descubrieron unos procedimientos más aptos para la preparación y el aislamiento de los productos cristalinos de hidrocloruro de lercanidipino a partir de la mezcla de la reacción. Se determinó sorprendentemente que el hidrocloruro de lercanidipino presenta unas características polimórficas y que cristaliza en distintas formas cristalinas dependiendo del procedimiento que se ha seguido y de los disolventes que se han utilizado. Además, se ha hecho posible el aislamiento de cada uno de los polimorfos cristalinos determinados, disminuyendo de este modo la posibilidad de variabilidad lote a lote del lercanidipino, que los presentes inventores determinaron que se debía a las mezclas de distintas formas sólidas presentes en el mismo lote y a que tales mezclas de distinta composición presentaban puntos de fusión dentro del mismo estrecho intervalo de las formas individuales. Como resultado de ello, se necesitaron unos lotes reproducibles de lercanidipino más aptos para la fabricación a gran escala y control de calidad.
Sumario de la invención
La presente invención se refiere a una forma cristalina de hidrocloruro de lercanidipino (I) que presenta un espectro de difracción de rayos X tal como se representa en la figura 11, para utilizar en un procedimiento de tratamiento antihipertensor.
Las distancias D(X), las razones de intensidad relativa (I/I0) y los ángulos 2? de los máximos significativos son:
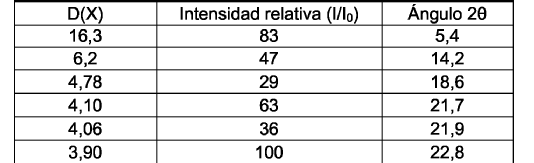
El hidrocloruro cristalino de lercanidipino de la Forma (I) se caracteriza por un espectro Raman con los picos tal como...
Reivindicaciones:
1. Forma cristalina (I) de hidrocloruro de lercanidipino que presenta un espectro de difracción de rayos X tal como se representa en la Figura 11, para utilizar en un método de tratamiento antihipertensor.
2. Método para producir la Forma cristalina (I) de hidrocloruro de lercanidipino según la reivindicación 1, que comprende:
a) la adición de isopropanol conteniendo un máximo de un 5% de agua (p/p) a la Forma bruta de hidrocloruro de lercanidipino y el calentamiento bajo reflujo con agitación para producir una disolución clara;
b) el enfriamiento de la disolución de la etapa a) y la agitación hasta la concentración del hidrocloruro de lercanidipino disuelto en el disolvente de cristalización es = 2%; y
c) la recuperación del sólido obtenido en la etapa b), y el secado de dicho sólido para producir la Forma cristalina (I) de hidrocloruro de lercanidipino.
3. Método según la reivindicación 2, en el que la etapa c) comprende la filtración del sólido obtenido en la etapa b), lavando del sólido con isopropanol.
4. Método según cualquiera de las reivindicaciones 2 ó 3, en el que dicha etapa a) comprende además la filtración de la disolución calentada.
5. Método según cualquiera de las reivindicaciones 2 a 4 en el que dicha etapa b) comprende el enfriamiento de la disolución hasta una temperatura comprendida entre 30 y 40ºC.
6. Método según cualquiera de las reivindicaciones 2 a 5, en el que dicha etapa b) comprende además la agitación durante un período de tiempo comprendido entre 12 y 48 horas.
7. Método según cualquiera de las reivindicaciones 2 a 6, en el que dicha etapa c) se realiza en un horno.
Patentes similares o relacionadas:
DERIVADOS DE 4-FENILDIHIDROPIRIDINA PARA EL TRATAMIENTO Y/O PREVENCIÓN DE UNA INFECCIÓN O ENFERMEDAD CAUSADA POR HELICOBACTER, del 23 de Abril de 2020, de FUNDACION INSTITUTO DE INVESTIGACION SANITARIA ARAGON: Derivados de 4-fenildihidropiridina de fórmula I y composiciones farmacéuticas de los mismos, donde el significado para R1, R2, […]
Derivados de 4-fenildihidropiridina para el tratamiento y/o prevención de una infección o enfermedad causada por Helicobacter, del 20 de Abril de 2020, de FUNDACION INSTITUTO DE INVESTIGACION SANITARIA ARAGON: Derivados de 4-fenildihidropiridina para el tratamiento y/o prevención de una infección o enfermedad causada por Helicobacter. Derivados de 4-fenildihidropiridina de fórmula […]
Clorhidrato de lercanidipino amorfo, del 13 de Noviembre de 2019, de RECORDATI IRELAND LIMITED: Hidrocloruro de lercanidipino amorfo que presenta una pureza de por lo menos el 95%.
Aril dihidropiridinonas y piperidinonas como inhibidores de MGAT2, del 13 de Febrero de 2019, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de Formula (I):**Fórmula** o un estereoisomero, un tautomero o una sal farmaceuticamente aceptable, en la que: indica un enlace simple […]
Arilhidrazidas que contienen una fracción de 2-piridona como agentes antibacterianos selectivos, del 29 de Octubre de 2018, de ABAC THERAPEUTICS, S.L: Un compuesto de la fórmula (I): **Fórmula** una sal, solvato, isótopo, polimórfo o tautómero farmacéuticamente aceptable del mismo, en donde A es […]
Aril dihidropiridinonas y piperidinonas como inhibidores de MGAT2, del 18 de Mayo de 2016, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de Formula (I):**Fórmula** o un estereoisomero, un tautomero, una sal farmaceuticamente aceptable o un solvato del mismo, en la que: […]
Preparación de dihidropiridinas, del 10 de Febrero de 2016, de LABORATORIOS LESVI, S.L.: Un proceso para la preparación de butirato de clevidipina que comprende la etapa: (i) hacer reaccionar un compuesto de fórmula (I): **Fórmula** […]
 Agente reductor de triglicéridos y agente de mejora del hiperinsulinismo, del 8 de Febrero de 2016, de KOWA COMPANY LTD.: Uso de un compuesto de pitavastatina y amlodipino o una sal del mismo para
- producir un agente reductor de triglicéridos o
- para producir un agente preventivo y/o terapéutico […]
Agente reductor de triglicéridos y agente de mejora del hiperinsulinismo, del 8 de Febrero de 2016, de KOWA COMPANY LTD.: Uso de un compuesto de pitavastatina y amlodipino o una sal del mismo para
- producir un agente reductor de triglicéridos o
- para producir un agente preventivo y/o terapéutico […]