MOTIVO DE TRANSDUCCION BIOMOLECULAR MPH-1-BTM Y UTILIZACION DEL MISMO.
Motivo de transducción biomolecular Mph-1-BTM que consiste en la secuencia de aminoácidos SEQ.
ID No.: 1 para la transducción de una molécula funcional y/o reguladora biológicamente activa en células procariotas o células eucariotas
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/KR2003/000122.
Solicitante: FORHUMANTECH. CO., LTD.
Nacionalidad solicitante: República de Corea.
Dirección: 316, VENTURE INCUBATOR CENTER, ENERGY EFFICIENCY RESEARCH DEPARTMENT, 71-2, JA ,YUSEONG-GU, DAEJON 305-343.
Inventor/es: LEE,SANG-KYOU;, LEE,SEUNG-KYOU;, SUH,BYUNG-FHY, CHAE,WOOK-JIN, KIM,JONG-BUM, LEE,JONG-SUN, YANG,JUNG-JIN.
Fecha de Publicación: .
Fecha Concesión Europea: 16 de Junio de 2010.
Clasificación Internacional de Patentes:
- C07K7/06A
Clasificación PCT:
- C07K7/06 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 7/00 Péptidos con 5 a 20 aminoácidos en una secuencia totalmente determinada; Sus derivados. › con 5 a 11 aminoácidos.
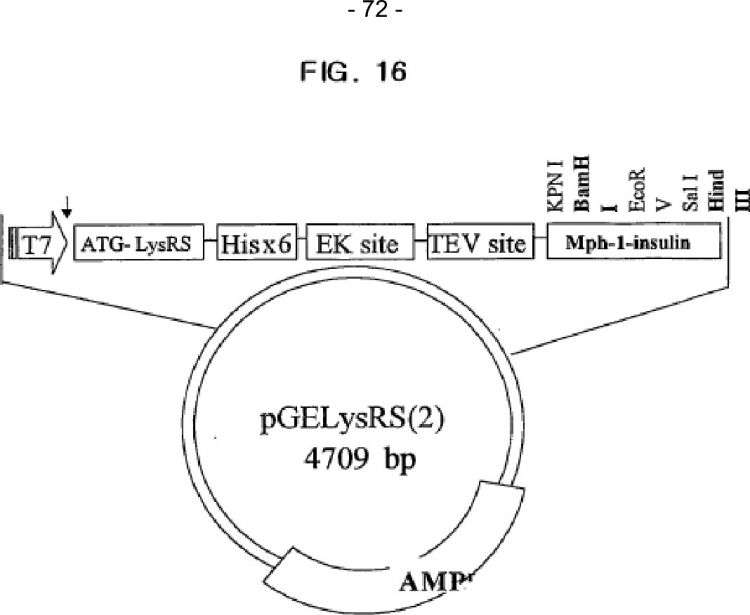
Fragmento de la descripción:
CAMPO TÉCNICO
La presente invención se refiere al motivo de transducción biomolecular (BTM) Mph-1, un nuevo péptido de transducción biomolecular intracelular que suministra in vivo e in vitro moléculas biológicamente activas, funcionales y/o reguladoras al citosol, a los orgánulos o al núcleo de células procariotas y eucariotas, y a la utilización del mismo.
ANTECEDENTES
En general, las células vivas no son permeables a macromoléculas tales como proteínas o ácidos nucleicos. El hecho de que sólo las moléculas pequeñas puedan atravesar la membrana de las células vivas a ritmos muy lentos ha restringido las investigaciones para desarrollar fármacos para curar, prevenir o diagnosticar enfermedades utilizando macromoléculas, incluyendo por ejemplo proteínas y ácidos nucleicos. Por otra parte, dado que la mayoría de las sustancias producidas para curar, prevenir o diagnosticar determinadas enfermedades han de ser suministradas al citosol en cantidades eficientes, se han desarrollado diversos métodos para suministrar estas sustancias desde la superficie de la célula diana al interior de la misma.
Los métodos utilizados para suministrar macromoléculas al interior de las células incluyen electroporación, fusión citosólica utilizando liposomas, técnica de proyección de alta concentración de un proyectil revestido con ADN en su superficie, método de precipitación de ADN-calcio-fósforo, transfección DEAEdextrano, infección con ácidos nucleicos víricos modificados y microinyección directa en una célula individual, etc. Además, actualmente se ha intentado suministrar macromoléculas utilizando nanopartículas in vitro e in vivo, pero sólo se están dando los primeros pasos tecnológicos y clínicos para este método. Además, estos métodos pueden suministrar macromoléculas únicamente a algunas de las células diana y su eficiencia no es suficiente para una aplicación clínica. Por otra parte, la mayoría de estos métodos tienen efectos secundarios en las otras células.
A este respecto, la demanda del desarrollo de un nuevo método para suministrar eficazmente macromoléculas biológicamente activas al interior de las células diana in vivo e in vitro está aumentando (L.A. Sternson, Ann. N. Y. Acad. Sci., 57, 19-21 (1987)). Se ha propuesto la adición química de péptidos lipídicos
(P. Hoffmann y col., Immunobiol., 177, 158-170 (1988)) o el uso de polímeros base como polilisina o poliarginina (W-C. Chen y col., Proc. Natl. Acad Sci., EE. UU. 75, 1872-1876 (1978)). Además, se ha informado de que el folato de un transportador fue transferido al interior de una célula en forma de un conjugado de folato. Pero todavía no se ha confirmado si el folato fue transducido en el citosol. También se conoce una exotoxina de Pseudomonas como transportador
(T. I. Prior y col., Cell. 64, 1017-1023 (1991)). Sin embargo, todavía no se han verificado claramente los efectos de las macromoléculas biológicamente activas suministradas al citosol y su aplicación en general. Por ello, existe una gran demanda de un método eficaz para la transducción de macromoléculas biológicamente activas en el citosol y el núcleo de células vivas.
Además, el suministro eficiente de ADN/ARN y de macromoléculas como proteínas al interior de células in vivo e in vitro se considera como una de las técnicas esenciales necesarias en el campo de la biotecnología y la ciencia médica aplicada. El suministro de ADN/ARN al interior de células actúa como un factor decisivo para las terapias génicas, para estudiar la relación de la función de una proteína codificada por el gen in vivo e in vitro y para el desarrollo de nuevos remedios utilizando ADN/ARN. Sin embargo, dado que el ADN/ARN no puede atravesar de forma eficiente la membrana celular, es muy importante aumentar la permeabilidad con el fin de utilizar genes en investigaciones básicas y clínicas.
Por esta razón se han desarrollado liposomas, nanomoléculas, vectores víricos, etc. para suministrar ADN y/o ARN al interior de una célula in vitro e in vivo, y se han examinado e investigado las posibilidades de uso de los mismos. Sin embargo aún quedan numerosos problemas sin resolver en cuanto a los efectos beneficiosos y los efectos secundarios. En particular en el caso de los liposomas, por ejemplo, debido a que sus efectos secundarios contra las células y su citotoxicidad son muy serios, su aplicación se ha limitado a investigaciones básicas. En cuanto a las nanomoléculas, aunque se les viene prestando gran atención actualmente, todavía se debería estudiar y resolver la descomposición de partículas portadoras in vivo, la baja eficiencia de transducción y las respuestas inmunológicas provocadas por las moléculas. Los retrovirus tienen el problema de que no pueden infectar células que no estén en división. Los adenovirus o los virus adenoasociados también tienen una aplicación clínica muy limitada. Además, estos dos tipos de vectores víricos pueden provocar respuestas inmunológicas contra las otras proteínas víricas, por lo que su eficiencia de tratamiento es muy dudosa. Por ello, se necesita un nuevo método para la transducción de ADN/ARN en el interior de células de forma eficiente y menos nociva.
Entre tanto se han producido proteínas reguladoras de fenómenos fisiológicos in vivo mediante bacterias, tales como E. coli, como una forma de proteína recombinante y se han empleado en el tratamiento de numerosas enfermedades. Sin embargo, es sabido que las proteínas que han sido sintetizadas en bacterias son ineficaces en las estructuras de plegado y las funciones en comparación con proteínas plegadas naturalmente in vivo. Por ello, en muchísimas ocasiones se han intentado producir proteínas en levaduras, células de insecto o células animales y hacer que las proteínas producidas en bacterias estuvieran replegadas utilizando animales transgénicos. Sin embargo, estos métodos requieren estudios más profundos y una total comprensión de muchos pasos intermedios biológicos celulares moleculares y sus eficiencias de transducción son muy bajas. Además genera una pésima relación coste-eficacia.
A consecuencia de esta demanda se ha informado sobre varios PTD (dominios de transducción de proteínas). Entre éstos, el más estudiado ha sido la proteína Tat, que es una proteína virica del virus de inmunodeficiencia humana 1 (VIH-1). Se sabe que la proteína Tat actúa de forma más eficiente cuando contiene los aminoácidos 47 a 57 (YGRKKRRQRRR), donde se concentran los aminoácidos con carga positiva, que la proteína continua de longitud completa de 86 aminoácidos (Fawell S. y col., Proc. Natl. Acad. Sci. EE. UU. 91, 664-668 (1994)). Otros ejemplos de PTD son los aminoácidos 267 a 300 de la proteína del virus del herpex simplex de tipo 1 (VHS-1) (Elliot G. y col., Cell, 88, 223-233 (1997)), los aminoácidos 339 a 355 de la proteína de Antennapedia (ANTP) de Drosophila (Schwarze S.R. y col., Trends Pharmacol Sci. 21, 45-48 (2000)) y una combinación artificial de aminoácidos con carga positiva. En relación con los PTD arriba mencionados, nosotros, los inventores, hemos comprobado que éstos contienen lisina y arginina en abundancia, considerándose que la arginina desempeña un papel muy importante en la transducción de biomoléculas en células. Y esto estaba respaldado por el documento publicado que reveló las actividades de transducción de péptidos artificiales consistentes en aminoácidos con carga positiva (Laus R. y col., Nature Biotechnol. 18, 1269-1272 (2000)).
Existen 2 (dos) hipótesis con respecto al mecanismo de transducción de macromoléculas en el interior de células cuando se utilizan PTD. La primera consiste en que los PTD destruyen la membrana plasmática y transmiten las moléculas a través de ésta. La segunda consiste en que el PTD utiliza la membrana plasmática para formar una nueva vesícula que puede transportar las moléculas al interior de las células. Además, de acuerdo con algunas suposiciones, los PTD tienen características estructurales que pueden formar nuevos canales en la membrana (Becker-Hapak M. y col., 2001, Jul:24(3): 247256).
No obstante, experimentos realizados con aminoácidos combinados artificialmente con 12 argininas y 12 lisinas sugieren que la hipótesis de que la presencia de lisina y arginina en posiciones específicas induce la formación de nuevos canales puede estar equivocada (Rothbard JB. y col., Nature Med. 200 Nov:6(11): 1253-1257). Además, teniendo en cuenta el hecho de que únicamente las proteínas que estaban unidas de forma covalente o no covalente con los PTD fueron transferidas...
Reivindicaciones:
1. Motivo de transducción biomolecular Mph-1-BTM que consiste en la secuencia de aminoácidos SEQ. ID No.: 1 para la transducción de una molécula funcional y/o reguladora biológicamente activa en células procariotas o células eucariotas.
2. Procedimiento para la producción de una proteína de fusión heteróloga del motivo de transducción biomolecular según la reivindicación 1 y una proteína heteróloga deseada, que incluye el paso de a. transformar una célula huésped adecuada con un vector de expresión recombinante que comprende ADN o ARN que codifica el motivo de transducción molecular y ADN o ARN que codifica la proteína deseada.
3. Procedimiento según la reivindicación 2, caracterizado porque el vector de expresión recombinante comprende además ADN que codifica una o más proteínas homólogas o heterólogas como una molécula reguladora funcional biológicamente activa y una secuencia reguladora de expresión unida funcionalmente.
4. Procedimiento según la reivindicación 2 ó 3, caracterizado porque el vector de expresión recombinante comprende además ADN o ARN que codifica una proteína de unión de ADN o ARN que se une a una secuencia de ADN o ARN específica, o un ADN o ARN deseado a transducir en células, un fragmento de ADN o ARN que contiene una o más secuencias de ácido nucleico sucesivas que se unen selectivamente a una proteína de unión de ADN o ARN y una secuencia reguladora de expresión unida funcionalmente.
5. Procedimiento según una o más de las reivindicaciones 3 a 4, caracterizado porque la secuencia reguladora de expresión es un dominio regulador que incluye un promotor o potenciador específico de células, tejidos u órganos en los que se transduce y expresa selectivamente el ADN o ARN deseado.
6. Procedimiento según una o más de las reivindicaciones 2 a 5, caracterizado porque el vector de expresión recombinante se transduce en células procariotas o en células eucariotas.
7. Procedimiento según una o más de las reivindicaciones 2 a 6, caracterizado porque el vector de expresión recombinante comprende: una secuencia de ácido nucleico que codifica una secuencia de aminoácidos que es reconocida y cortada por la proteasa presente en una superficie celular; y un ectodominio que codifica ADN de un ligando que se une específicamente a un receptor presente característicamente en la superficie de la célula, tejido u órgano en el que se transduce la proteína deseada, o ADN que codifica un anticuerpo monoclonal (mAb) que se une específicamente al receptor.
8. Procedimiento según la reivindicación 7, caracterizado porque la proteasa presente específicamente en la superficie de la célula es MMP (metaloproteasa de matriz).
9. Procedimiento según la reivindicación 7 u 8, caracterizado porque el mAb es un fragmento Fab, un fragmento F (ab'), un Fv de cadena simple o mAb humanizado.
10. Procedimiento según una o más de las reivindicaciones 2 a 9, caracterizado porque el vector de expresión recombinante comprende adicionalmente una secuencia tag para la purificación de la proteína deseada.
11. Procedimiento según las reivindicación 10, caracterizado porque el vector de expresión recombinante comprende adicionalmente seis codones de histidina sucesivos.
12. Procedimiento según una o más de las reivindicaciones 2 a 11, caracterizado porque el vector de expresión recombinante comprende adicionalmente una secuencia de aminoácidos que es reconocida específicamente y cortada por una enzima intracelular.
13. Procedimiento según una o más de las reivindicaciones 7 a 12, caracterizado porque la secuencia de aminoácidos que es reconocida específicamente y cortada por una enzima intracelular es el sitio de corte
de enteroquinasa Asp-Asp-Asp-Asp-Lys o el sitio de corte tev de Glu-Asn-Leu-Tyr-Phe-Gln-Gly.
14. Procedimiento según una o más de las reivindicaciones 2 a 13, caracterizado porque el vector de expresión recombinante comprende adicionalmente una o más glicinas y aminoácidos espaciadores o ácidos nucleicos, incluyendo aminoácidos AYY, para la estabilidad estructural y funcional o para la flexibilidad de la proteína.
Patentes similares o relacionadas:
OLIGOPÉPTIDOS NO PROTEOLIZABLES INHIBIDORES DE LA GLICOPROTEINA GP41 DEL VIH, del 21 de Octubre de 2011, de UNIVERSIDAD DEL PAIS VASCO UNIVERSIDAD DE VALENCIA: Oligopéptidos no proteolizables inhibidores de la glicoproteína 41 del virus del SIDA. La presente invención se refiere a la identificación de oligopéptidos, […]
PÉPTIDOS ESPECÍFICOS PARA LAS METÁSTASIS Y SUS APLICACIONES EN DIAGNÓSTICO Y TERAPÉUTICAS, del 19 de Julio de 2011, de UNIVERSITA' DEGLI STUDI DI TORINO: Un péptido capaz de fijarse selectivamente a células metastásicas, preferiblemente células de metástasis hepáticas humanas, que tiene el motivo de secuencia LRS, una longitud […]
CITOQUINA QUE INDUCE APOPTOSIS, del 29 de Junio de 2011, de IMMUNEX CORPORATION: Un polipéptido TRAIL soluble purificado que contiene una secuencia de aminoácidos que es al menos 80% idéntica a una secuencia seleccionada del grupo […]
ANTICUERPOS ESPECIFICOS DE TGF BETA 1, del 15 de Junio de 2011, de ELI LILLY AND COMPANY: Un anticuerpo o un fragmento de unión antigénica del mismo que neutraliza la proteína TGF-ß1 humana y tiene una K d de menos de 40pM para la TGF-ß1 […]
COMPOSICIÓN COSMÉTICA O FARMACÉUTICA QUE CONTIENE PÉPTIDOS CON LA SECUENCIA ARG-GLY-SER, del 3 de Junio de 2011, de SOCIETE D'EXTRACTION DES PRINCIPES ACTIFS ( VINCIENCE SA): Composición cosmética y/o dermatológica y/o farmacéutica caracterizada porque contiene en un medio aceptable, como principio activo, por lo menos un péptido de fórmula […]
LIGACIÓN QUÍMICA "SEUDO"- NATURAL, del 1 de Junio de 2011, de AMYLIN PHARMACEUTICALS, INC.: Procedimiento para sintetizar un polipéptido deseado de fórmula: aaNH2-Q-aax-aay-W-aaCOOH en la que Q y W indican cada uno la presencia opcional de uno o más restos […]
 USO DE PÉPTIDOS MIMÉTICOS DEL ÁCIDO POLI-ALFA 2,8-SIÁLICO PARA MODULAR FUNCIONES DE NCAM, del 27 de Mayo de 2011, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE Université de la Méditerranée - Aix-Marseille II Schafer-N Universitätsklinikum Hamburg-Eppendorf: Un péptido para uso como un medicamento para modular crecimiento, regeneración y plasticidad de células de vertebrados que expresan NCAM, en el que […]
USO DE PÉPTIDOS MIMÉTICOS DEL ÁCIDO POLI-ALFA 2,8-SIÁLICO PARA MODULAR FUNCIONES DE NCAM, del 27 de Mayo de 2011, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE Université de la Méditerranée - Aix-Marseille II Schafer-N Universitätsklinikum Hamburg-Eppendorf: Un péptido para uso como un medicamento para modular crecimiento, regeneración y plasticidad de células de vertebrados que expresan NCAM, en el que […]
 POLIPÉPTIDOS Y POLIMÉRICOS PARA LOS RECEPTORES Fc, del 19 de Mayo de 2011, de SUPPREMOL GMBH: Proteína o polipéptido polimérica/o soluble que puede inhibir la interacción de los receptores de leucocitos Fcγ (FcγR) y de inmunoglobulina G (IgG), comprendiendo […]
POLIPÉPTIDOS Y POLIMÉRICOS PARA LOS RECEPTORES Fc, del 19 de Mayo de 2011, de SUPPREMOL GMBH: Proteína o polipéptido polimérica/o soluble que puede inhibir la interacción de los receptores de leucocitos Fcγ (FcγR) y de inmunoglobulina G (IgG), comprendiendo […]