MATERIALES Y METODOS PARA LA ADMINISTRACION MINIMAMENTE INVASIVA DE UNA COMPOSICION FLUIDA QUE CONTIENE CELULAS.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/043844.
Solicitante: PERVASIS THERAPEUTICS, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 790 MEMORIAL DRIVE,CAMBRIDGE, MA 02139.
Inventor/es: NUGENT,HELEN,MARIE, EDELMAN,ELAZER, BOLLINGER,STEVE.
Fecha de Publicación: .
Fecha Concesión Europea: 2 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- A61L27/38 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › A61L 27/00 Materiales para prótesis o para revestimiento de prótesis (prótesis dentales A61C 13/00; forma o estructura de las prótesis A61F 2/00; empleo de preparaciones para la fabricación de dientes artificiales A61K 6/80; riñones artificiales A61M 1/14). › Células animales (para utilizar en piel artificial A61L 27/60).
Clasificación PCT:
- A61L24/10 A61L […] › A61L 24/00 Adhesivos o cementos quirúrgicos; Adhesivos para dispositivos de colostomía (adhesivos conductores de la electricidad que se utilizan en terapia o examen en vivo A61K 50/00). › Polipéptidos; Proteínas.
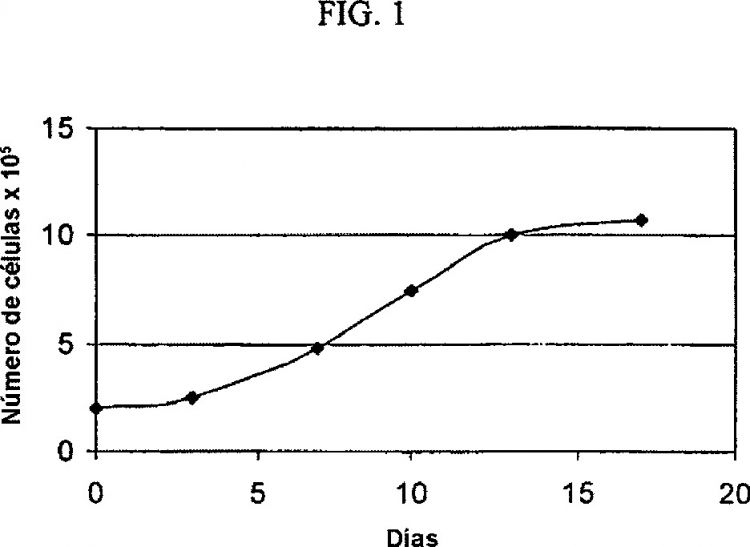
Fragmento de la descripción:
Materiales y métodos para la administración mínimamente invasiva de una composición fluida que contiene células.
Antecedentes de la invención
Las enfermedades cardiovasculares representan más de 50 millones de muertes en el mundo y un millón de muertes en los Estados Unidos cada año. Aproximadamente 1,5 millones de procedimientos se realizan cada año en los Estados Unidos en un intento por aliviar las lesiones arteriales obstructivas que se originan espontáneamente a partir de estas enfermedades. Estos procedimientos incluyen la angioplastia con balón asistida por láser, aterectomía, endoprótesis endovasculares e injertos de derivación, para nombrar unos pocos. Las arteriopatías aceleradas tras tales procedimientos limitan la eficacia a largo plazo de la angioplastia, los injertos de derivación vascular e incluso el trasplante de órganos. La pérdida de integridad endotelial, la trombosis oclusiva, el espasmo y la migración y proliferación de células del músculo liso que dan como resultado la hiperplasia de la íntima tipifican estas arteriopatías. Por ejemplo, la reestenosis conduce a lesiones arteriales obstructivas en del 20 al 50% de tales pacientes. En el plazo de tres a seis meses después de la angioplastia coronaria, más de un tercio de los pacientes requieren una intervención adicional, otra angioplastia o incluso cirugía de derivación. Los dispositivos de aterectomía no son mejores; puesto que el número de pacientes sometidos a este procedimiento aumenta, las tasas de reestenosis han subido desde el 10 hasta el 47%. El uso de endoprótesis endovasculares ha sido también un tanto decepcionante en este sentido. Un estudio reciente notifica una tasa del 35% de reestenosis además de aproximadamente un 5% de pacientes que sufrieron una complicación aguda, tal como un cierre repentino en el plazo de los primeros días después de la inserción.
Se han observado problemas similares en pacientes que se someten a cirugía de derivación vascular. El tiempo de vida medio de un injerto de interposición aortocoronario de vena safena es de sólo siete años. El diez por ciento de todos los injertos de este tipo se ocluyen en el plazo de las primeras semanas tras la cirugía. Al año y a los cinco años, el 20 y el 35% de los injertos están ocluidos, respectivamente. Las fístulas arteriovenosas en pacientes sometidos a diálisis presentan la misma patología, limitando la eficacia de la hemodiálisis.
La marca distintiva de las arteriopatías aceleradas, tal como la reestenosis, es la proliferación exuberante de células del músculo liso y la deposición de una gran cantidad de matriz extracelular generada por estas células. Ahora ha resultado evidente que tanto la aterosclerosis nativa como las arteriopatías aceleradas tras intervenciones mecánicas comparten un acontecimiento patológico inicial común, la pérdida de integridad y función de las células endoteliales.
La monocapa endotelial reviste la pared arterial y sirve como un biorregulador doble de la fisiología vascular. El endotelio proporciona integridad estructural al vaso sanguíneo formando una barrera continua, permeable de manera selectiva, no trombogénica entre la sangre circulante y la pared arterial. Sin embargo, se aprecia cada vez más que el endotelio también produce y suministra productos que controlan el flujo sanguíneo, el tono de los vasos, la trombosis oclusiva, la activación plaquetaria, la adhesión y agregación, la adhesión leucocitaria, la infiltración monocítica, y la migración y proliferación de células del músculo liso. Puesto que los mitógenos de las células del músculo liso son ubicuos dentro de la pared arterial, es la presencia de un endotelio intacto lo que mantiene el vaso sanguíneo normal en un estado quiescente. Tras el daño o la eliminación del endotelio, también se eliminan los compuestos secretados por el endotelio, y se activa una secuencia de acontecimientos que conduce a la proliferación y migración incontroladas de células del músculo liso, dando como resultado lesiones arteriales obstructivas.
Muchas intervenciones clínicas empleadas actualmente para tratar enfermedades cardiovasculares, incluyendo angioplastia coronaria, colocación de endoprótesis coronarias y aterectomía, pueden llevarse a cabo usando procedimientos quirúrgicos cerrados no invasivos. Estas estrategias de intervención endovascular no invasiva deben ir acompañadas de un modo de suministro endovascular mínimamente invasivo similar de un material terapéutico al sitio de la intervención vascular para tratar el endotelio objetivo lesionado o enfermo resultante.
Además, los métodos actuales de suministro de materiales terapéuticos por vía endovascular se basan en la administración de los materiales a la superficie luminal interior del vaso sanguíneo. Sin embargo, la administración de materiales o agentes terapéuticos a la superficie luminal interior proporciona sólo un beneficio transitorio a un endotelio objetivo lesionado o enfermo, puesto que el contacto con la sangre circulante limita la eficacia y duración de la actividad.
Un objetivo de la presente invención es proporcionar materiales para el suministro no invasivo o mínimamente invasivo de una formulación terapéutica de células a un sitio extraluminal o perivascular en, adyacente a o en la proximidad de un sitio del endotelio luminal lesionado o enfermo y reducir posteriormente la incidencia de trombosis oclusiva, reestenosis, hiperplasia de la íntima y otras secuelas clínicas asociadas con las intervenciones vasculares o enfermedades cardiovasculares. El documento US-A-8 723 131, se refiere a un material de injerto de médula ósea compuesto que comprende una matriz implantable biocompatible porosa que se enriquece con una población de células progenitoras y un material de coágulos en forma de un coágulo sanguíneo, médula ósea, gel de plaquetas o un material de coágulos de fibrina, estando dicha matriz compuesta de una superficie biocompatible porosa. El documento US-A-2003/0163192, se refiere a un método para el tratamiento de una arteria enferma que comprende el suministro de una composición fluida al sitio vascular afectado en condiciones en las que la composición forma in situ una película sólida que se adhiere a la pared vascular, aislando así el sitio vascular del flujo sanguíneo sistémico. El documento US-A-2002/0090398, da a conocer una composición fluida que contiene una matriz de un polímero biocompatible y un agente bioactivo, mediante lo cual dicha composición puede administrarse dentro de una matriz sólida in situ como un implante. El documento US-A-2001/0036451, se refiere a composiciones embólicas que comprenden una estructura principal polimérica que contiene cadenas que portan grupos reticulables que pueden formar hidrogeles mediante reticulación.
Resumen de la invención
La presente invención explota el descubrimiento de que las células injertadas en, sobre o dentro de una composición fluida implantable, pueden formularse para múltiples modos de suministro mínimamente invasivo, por ejemplo, administración endovascular y deposición perivascular en, adyacente a o en la proximidad de una superficie extraluminal de una estructura anatómica tubular, tal como, pero sin limitarse a, un vaso sanguíneo. También se contempla en el presente documento el suministro mínimamente invasivo en, sobre o alrededor de una superficie exterior de una estructura anatómica tubular. En el caso del vaso sanguíneo, los materiales de la presente invención son adecuados para tratar y manejar las secuelas clínicas asociadas con las intervenciones vasculares o enfermedades cardiovasculares.
En un aspecto, la presente invención proporciona una composición fluida según las reivindicaciones. Según una realización, la estructura anatómica tubular es un vaso sanguíneo. La composición fluida se proporciona, según algunas realizaciones, en una cantidad eficaz para reducir la proliferación de células del músculo liso, la trombosis oclusiva, la hiperplasia de la íntima, la reestenosis, la vasodilatación o la inflamación crónica o aguda, para nombrar unos pocos, en el sitio lesionado o enfermo. Para los fines de la presente invención, la composición fluida significa una composición susceptible de la administración usando una inyección o un dispositivo de suministro de tipo inyección tal como, pero sin limitarse a, una aguja, una jeringa o un catéter. También se contemplan en el presente documento otros dispositivos de suministro que emplean extrusión, eyección o expulsión.
Según una realización, las células de la composición fluida son células endoteliales o células...
Reivindicaciones:
1. Composición fluida que comprende una matriz biocompatible y células para su uso en el tratamiento de un sitio lesionado o enfermo en la luz interior de una estructura anatómica tubular en la que dicha composición fluida se suministra mediante inyección percutánea a una superficie extraluminal en o adyacente a o en la proximidad del sitio lesionado o enfermo en una cantidad eficaz para tratar el sitio lesionado o enfermo.
2. Composición según la reivindicación 1, en la que la composición debe suministrarse mediante un procedimiento cerrado mínimamente invasivo.
3. Composición según la reivindicación 1, en la que la composición debe suministrarse atravesando o penetrando en la pared interior de dicha estructura anatómica tubular.
4. Composición según una cualquiera de las reivindicaciones 1 a 3, en la que la estructura anatómica tubular es un vaso sanguíneo.
5. Composición según una cualquiera de las reivindicaciones anteriores, en la que dicha composición fluida comprende además medios de crecimiento celular.
6. Composición según una cualquiera de las reivindicaciones anteriores, en la que dichas células son células endoteliales o células que tienen un fenotipo de tipo endotelial.
7. Composición según una cualquiera de las reivindicaciones 1 a 5, en la que dichas células son un cocultivo de dos o más células seleccionadas del grupo que consiste en células endoteliales, células epiteliales, células del músculo liso, fibroblastos, células madre, células progenitoras endoteliales y cardiomiocitos.
8. Composición según una cualquiera de las reivindicaciones 1 a 5, en la que dichas células son una población de células confluente, una población de células casi confluente, una población de células posconfluente o una población de células que tiene uno cualquiera de los fenotipos anteriores.
9. Composición según una cualquiera de las reivindicaciones anteriores, en la que la composición fluida mantiene su forma.
10. Composición según una cualquiera de las reivindicaciones anteriores, en la que la matriz biocompatible comprende partículas o microportadores.
11. Composición según la reivindicación 10, en la que las partículas o microportadores tienen un diámetro de aproximadamente 20 micrómetros a aproximadamente 500 micrómetros.
12. Composición según la reivindicación 11, en la que las partículas o microportadores tienen un diámetro de aproximadamente 200 micrómetros.
13. Composición según una cualquiera de las reivindicaciones anteriores, en la que la matriz biocompatible comprende además gelatina, colágeno, fibronectina, fibrina, laminina o un péptido de unión.
14. Composición según la reivindicación 13, en la que la matriz biocompatible comprende además un péptido de unión que comprende un péptido de secuencia arginina-glicina-aspartato (RGD).
15. Composición según una cualquiera de las reivindicaciones anteriores, en la que dicha cantidad eficaz de la composición fluida reduce la proliferación de las células del músculo liso en el sitio lesionado o enfermo.
16. Composición según una cualquiera de las reivindicaciones 1 a 14, en la que dicha cantidad eficaz de la composición fluida reduce la trombosis oclusiva en el sitio lesionado o enfermo.
17. Composición según una cualquiera de las reivindicaciones 1 a 14, en la que dicha cantidad eficaz de la composición fluida reduce la hiperplasia de la íntima en el sitio lesionado o enfermo.
18. Composición según una cualquiera de las reivindicaciones 1 a 14, en la que dicha cantidad eficaz de la composición fluida reduce la estenosis o reestenosis en el sitio lesionado o enfermo.
19. Composición según una cualquiera de las reivindicaciones 1 al 14, en la que dicha cantidad eficaz de la composición fluida reduce la inflamación aguda en el sitio lesionado o enfermo.
20. Composición según una cualquiera de las reivindicaciones 1 al 14, en la que dicha cantidad eficaz de la composición fluida reduce la inflamación crónica en el sitio lesionado o enfermo.
21. Composición según una cualquiera de las reivindicaciones 1 a 14, en la que dicha cantidad eficaz de la composición fluida reduce la vasodilatación o el vasoespasmo en el sitio lesionado o enfermo.
22. Composición según una cualquiera de las reivindicaciones anteriores, que comprende además la etapa de identificar un sitio para depositar la composición fluida sobre una superficie exterior de dicha estructura anatómica tubular.
23. Composición según la reivindicación 22, en la que la etapa de identificación: (a) se produce antes de o coincidiendo con la etapa de paso a través, penetración o inyección; o (b) se lleva a cabo mediante la obtención de imágenes; o (c) se lleva a cabo mediante palpación táctil.
24. Composición según una cualquiera de las reivindicaciones anteriores, en la que la superficie exterior de dicha estructura anatómica tubular: (a) es una superficie no luminal; o (b) ocupa el espacio perivascular; o (c) es un vaso sanguíneo que comprende una endoprótesis, opcionalmente en la que dicho sitio lesionado o enfermo está en la proximidad de la endoprótesis.
25. Composición según una cualquiera de las reivindicaciones 1 a 3, en la que la estructura anatómica tubular se selecciona de: los conductos lagrimales, la tráquea, los bronquios, los bronquiolos, las fosas nasales, los senos, las vías respiratorias, las trompas de Eustaquio, el conducto auditivo externo, la cavidad bucal, el esófago, el estómago, el duodeno, el intestino delgado, el intestino grueso, los conductos biliares, el uréter, la vejiga, la uretra, las trompas de Falopio, el útero, la vagina y otros conductos del aparato reproductor femenino y el conducto deferente y otros conductos del aparato reproductor masculino.
26. Composición según una cualquiera de las reivindicaciones 1 a 3, en la que la estructura anatómica tubular es una estructura que se produce de manera natural o una anastomosis creada quirúrgicamente.
Patentes similares o relacionadas:
Matriz de soporte de injerto para reparación de cartílago y procedimiento de obtención de la misma, del 1 de Julio de 2020, de ETH ZURICH: Un procedimiento de proporción de una matriz de soporte de injerto para reparación de cartílagos, particularmente en un paciente humano, que comprende las etapas de: […]
Métodos y dispositivos para trasplante celular, del 10 de Junio de 2020, de Sernova Corporation: Un dispositivo para implantar células en un cuerpo huésped, que comprende: un andamio poroso que comprende al menos una cámara que tiene un extremo proximal y un extremo […]
Reparación de tejido cartilaginoso, del 27 de Mayo de 2020, de CartiRegen B.V: Un método para la separación electroforética de células a partir de un tejido, comprendiendo el método: a) seccionar un tejido para preparar fragmentos de dicho tejido, […]
Procedimientos de preparación de un hidrogel esterilizado de modo terminal que proviene de matriz extracelular, del 22 de Abril de 2020, de UNIVERSITY OF PITTSBURGH OF THE COMMONWEALTH SYSTEM OF HIGHER EDUCATION: Un procedimiento de preparación de un material digerido de matriz extracelular esterilizado de modo terminal capaz de gelificar, que comprende: (i) solubilizar la matriz […]
Estructuras para trasplante celular, del 15 de Abril de 2020, de PRESIDENT AND FELLOWS OF HARVARD COLLEGE: Un dispositivo que comprende una composición de estructura que presenta macroporos abiertos e interconectados, y que es capaz de controlar en el tiempo […]
Espumas de fibroína de seda inyectables y usos de la misma, del 1 de Abril de 2020, de TRUSTEES OF TUFTS COLLEGE: Un aplicador de inyección que comprende una composición inyectable, la composición inyectable comprende una espuma de fibroína de seda comprimida que tiene […]
Procedimiento para la multiplicación del cabello in vivo, del 25 de Marzo de 2020, de Prostem International B.V: Procedimiento cosmético para la multiplicación del cabello in vivo, que comprende los pasos de: (a) proporcionar al menos una parte de un folículo piloso en la fase anágena, […]
Material biocompatible que presenta un tejido de nano- o microfibras no tejidas producido por procedimiento de electrohilado, del 25 de Marzo de 2020, de SUNSTAR SUISSE SA: Material biocompatible que comprende un tejido no tejido de nano- o microfibra biocompatible producido mediante electrohilado para su uso en el tratamiento de hueso […]