PROCEDIMIENTO PARA LA OBTENCION CUIDADOSA DE SUSPENSIONES DE PARTICULAS DE ELEVADA FINURA Y PARTICULAS DE ELEVADA FINURA, ASI COMO SU APLICACION.
Procedimiento para la obtención cuidadosa de suspensiones de partículas de elevada finura,
caracterizado porque
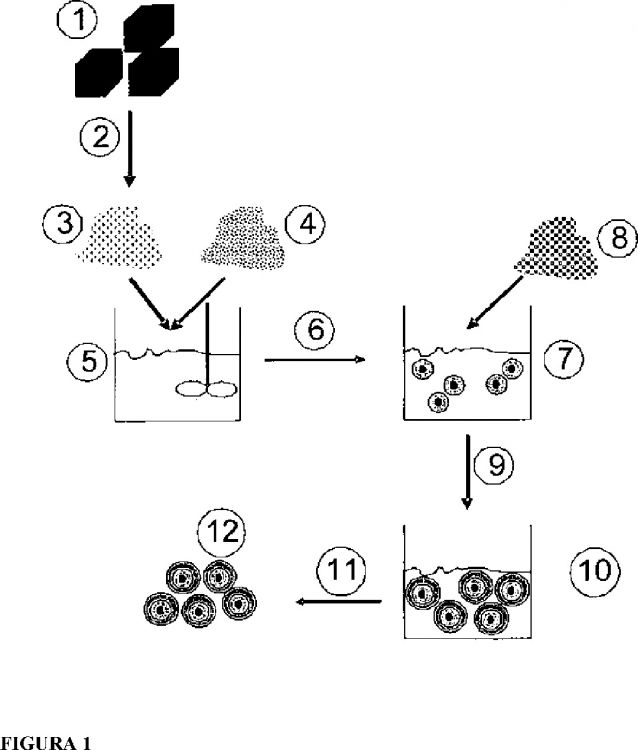
a) una sustancia sólida no soluble en agua o difícilmente soluble en agua es disuelta en un solvente adecuado,
b) posteriormente, la solución de a) es congelada formando una matriz sólida,
c) eventualmente, a la matriz sólida obtenida en b) se le extrae el solvente por secado, especialmente, por liofilización,
d) la matriz sólida obtenida en b) que, eventualmente, ha sido secada, especialmente, liofilizada según c), es dispersada en estado congelado en un agente de dispersión, y
e) posteriormente, se aplican fuerzas de intensidad media a elevada sobre la dispersión obtenida en d) antes de fundir la matriz sólida, congelada y dispersada, de modo que se obtiene una suspensión de partículas cuyo tamaño medio de partículas, determinado mediante espectroscopia de correlación de fotones (PCS), es inferior a 1000 nm, se halla, especialmente, en el rango de 50 a < 1000 nm, preferentemente, por debajo de 800 nm, preferentemente, en el rango de 50 a 600 nm, y, especialmente, por debajo de 400, preferentemente, en el rango de 50 a 200 nm, y, especialmente, por debajo de 100 nm
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2006/003377.
Solicitante: ABBOTT GMBH & CO. KG.
Nacionalidad solicitante: Alemania.
Dirección: MAX-PLANCK-RING 2,65205 WIESBADEN.
Inventor/es: LEMKE, ANDREAS, DR., MOSCHWITZER,JAN.
Fecha de Publicación: .
Fecha Concesión Europea: 6 de Enero de 2010.
Clasificación Internacional de Patentes:
- A61K9/16P4
Clasificación PCT:
- A61K9/14 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61K9/51 A61K 9/00 […] › Nanocápsulas.
Fragmento de la descripción:
Procedimiento para la obtención cuidadosa de suspensiones de partículas de elevada finura y partículas de elevada finura, así como su aplicación.
1. Ámbito de la invención
La presente invención describe un procedimiento para la obtención cuidadosa de suspensiones de partículas de elevada finura y partículas de elevada finura, cuyas partículas presentan un tamaño promedio en la escala de nanómetros, para los sectores de la farmacéutica, la cosmética, la fabricación de alimentos y la agraria.
2. Estado actual de la técnica
Debido a las técnicas utilizadas hoy en día para hallar nuevos candidatos para medicamentos (por ejemplo, el análisis de alto rendimiento, o highthroughput-screening, el modelado molecular, o molecular modelling, las técnicas de adecuación de receptor, o receptor-fit techniques) (B. Rabinow, Nanosuspensions in drug delivery), Nat. Rev. Drug Discov. 9/2004, 3(9), 785-796), cada vez más sustancias activas, obtenidas mediante el desarrollo farmacéutico son muy efectivas, pero frecuentemente también presentan una solubilidad muy baja o son prácticamente insolubles (Merisko-Liversidge E. Nanocrystals: Resolving Pharmaceutical Formulation Issues associated with poorly watersoluble Compounds (Nanocristales: resolviendo asuntos de formulación farmacéutica asociados a componentes de difícil disolución en agua). en: Marty JJ, editor. Particles (Partículas); 2002; Orlando: Marcel Dekker; 2002). Por ello se limita notablemente su biodisponibilidad, especialmente, tras la aplicación oral o tópica. También se dificulta una aplicación parenteral debido a la mala solubilidad y los grandes volúmenes inyectables requeridos por este motivo. La utilización de mezclas de solventes inyectables (por ejemplo, mezclas de agua y etanol) o solventes orgánicos (por ejemplo, polietilenglicol), también recurriendo a solubilizadores, frecuentemente produce inyecciones dolorosas y por ello también posee una evaluación negativa.
Un posible punto de partida para la mejora de la biodisponibilidad debido a una velocidad incrementada de la disolución y una mayor solubilidad de saturación, es brindado por la nanonización, es decir, la reducción del tamaño de partículas hasta un rango inferior a 1000 nm. (Merisko-Liversidge E, Liversidge GG, Cooper ER. Nanosizing: a formulation approach for poorlywater-soluble compounds. (Nanonización: una aproximación de formulación para componentes de difícil dislución en agua) European Journal of Pharmaceutical Sciences (Revista europea de ciencias farmacéuticas) 2003;18(2):113-120.) El reducido tamaño de partículas provoca, por un lado, una superficie total mucho mayor y, por otro lado, una mayor curvatura de la superficie de las partículas. De ese modo, se produce una presión incrementada de solución, correspondiente a la ecuación de Kelvin y, vinculado a ello, un incremento de la solubilidad de saturación. El incremento de la solubilidad de saturación y la superficie muy incrementada producen, acorde a la ecuación de Noyes-Whitney, una mayor velocidad de disolución. Correspondientemente con ello, a través de la nanonización de sustancias medicinales se obtiene una mayor cantidad de sustancia activa disuelta en menor tiempo, en comparación con medicamentos micronizados, por lo cual, en el caso de medicamentos de clase II según BSC (siglas en inglés de: sistema de clasificación biofarmacéutica, o pharmaceutical specification class (BSC)), la biodisponibilidad puede mejorar notablemente.
Los medicamentos de clase II (BSC II) son aquellos que tras el suministro peroral permean ligeramente, pero su biodisponibilidad está limitada a causa de una lenta velocidad de disolución/solubilidad reducida de saturación.
Se han descrito diferentes métodos para obtener sustancias activas con un tamaño de partículas en la escala de nanómetros. Se distingue principalmente entre tecnologías "bottom-up" (ascendentes) y "top-down" (descendentes). En el caso de las tecnologías "top-down" se parte de cristales de tamaño mayor de medicamentos, que en general son micronizados en un primer paso de producción mediante procedimientos de molienda (por ejemplo, la molienda mediante chorros de aire). En el caso de la aplicación de tecnologías "top-down" se presupone que una micronización previa del material inicial produce una mejor nanonización. (V.B. Patravale, Nanosuspensions: a promising drug delivery strategy (Nanosuspensiones: una estrategia prometedora para la obtención de fármacos), Journal of Pharmacy and Pharmacology (Revista de farmacia y farmacología), 56(7) 827-840).
Para la nanonización en sí se describen diferentes técnicas.
La memoria US-A-5 145 684 describe la molienda en húmedo de medicamentos con molinos de bolas, para reducir los cristales de medicamentos dispersados en soluciones de tensioactivos. El tamaño de partículas de la "macrosuspensión" es reducido a través de las bolas de molienda y sus movimientos. Una desventaja de esta tecnología es la necesidad de la utilización de materiales iniciales micronizados, una posible contaminación del producto por desgaste por el roce de las bolas de molienda (Buchmann S, Fischli, W., Thiel, F. P., Alex, R. Aqueous microsuspension, an alternative intravenous formulation for animal studies (Microsuspensión acuosa, una formulación intravenos alternativa para estudios de animales). en: 42 nd Annual Congress of the International Association for Pharmaceutical Technology (APV) (42º Congreso de la Asociación Internacional de Tecnología Farmacéutica); 1996; Mainz; 1996. p. 124) y de la notable dependencia del producto de molienda y de la necesaria duración de la molienda de las cualidades del material inicial. Dependiendo del producto molido, el tamaño de partículas que se puede obtener se halla habitualmente por debajo de 400 nm; frecuentemente, se puede lograr un tamaño de partículas de 200-300 nm. Pero, para lograr tamaños de partículas en el área de 100 nm o menos, se requieren tiempos de molienda muy prolongados y técnicas especiales (por ejemplo, el cambio del tamaño de las bolas), lo cual dificulta el proceso y lo prolonga notablemente.
Un método de fabricación alternativo es la utilización de homogeneizadores de alta presión, es decir, método basados en el principio del pistón de dos etapas o del principio de Jet-Stream (Microfluidizer-Technologie, Microfluidics Inc. (US-A-6 018 080)). El principio del microfluidizador es el choque frontal de dos chorros a una velocidad muy elevada, en la cual la colisión de las partículas provoca su reducción. Las desventajas de este método son las cantidades requeridas de ciclos (frecuentemente más de 50 ciclos) y una potencial contaminación con las micropartículas restantes.
En el caso de la utilización de homogeneizadores de pistón de dos etapas se presiona la macrosuspensión a través de una ranura muy estrecha que, dependiendo de la presión aplicada y de la viscosidad del agente de dispersión, presenta un tamaño de 5-20 µm (Rainer H. Müller, Jan Moschwitzer y Faris Nadiem Bushrab, Manufacturing of nanoparticles by milling and homogenization techniques (Fabricación de nanopartículas mediante técnicas de molienda y homogeneización), editores Gupta, Kompella, Edit: Marcel Dekker; en prensa). A su vez, la elevada velocidad de corriente produce fuerzas de cavitación, adicionalmente, tanto la colisión de partículas así como las fuerzas de cizallado también provocan una reducción de partículas. La patente US-A-5 858 410 describe la utilización de homogeneizadores de pistón de dos etapas para la reducción de partícula dispersadas en mezclas puras de agua y tensioactivo. La memoria WO-A-0103670, por el contrario, describe la utilización de esta técnica para homogeneizar partículas que están dispersadas en medios no acuosos o en mezclas de agua con líquidos miscibles en agua. Los tamaños de partículas que se pueden obtener con los homogeneizadores de pistón de dos etapas se encuentran, a su vez, en el rango de, aproximadamente, 200-600 nm y, en el caso de materiales muy duros, en el rango de alrededor de 700-900 nm (Muller RH, Jacobs C, Kayser O. Nanosuspensions as particulate drug formulations in therapy: Rationale for development and what we can expect for the future (Nanosuspensiones como formulaciones particulares de fármacos en la terapia: Fundamento para el desarrollo y aquello que podemos esperar en el futuro). Advanced Drug Delivery Reviews 2001; 47(1):3-19;).
Mediante las técnicas "top-down" descritas hasta hoy es imposible, o prácticamente imposible, obtener, con un costo aceptable, nanosuspensiones con un tamaño medio de partículas muy inferior a 100 nm y un tamaño máximo...
Reivindicaciones:
1. Procedimiento para la obtención cuidadosa de suspensiones de partículas de elevada finura, caracterizado porque
2. Procedimiento acorde a la reivindicación 1, caracterizado porque la sustancia sólida por disolver es una sustancia de acción medicinal, una sustancia de acción cosmética, un aditivo para alimentos, un colorante o un pigmento.
3. Procedimiento acorde a una de las reivindicaciones 1 o 2, caracterizado porque las fuerzas de intensidad media a elevada son fuerzas de cizallado, de cavitación, de molienda y/o de ultrasonido, aplicadas, especialmente, por homogeneizadores de alta presión, equipos Jet-Stream, molinos coloidales rotor y estator, molinos de bolas, mezcladores de alto cizallado o aparatología de ultrasonido, asimismo, el equipo utilizado trabaja, preferentemente, con una densidad de potencia de 106 a 1013/m3, especialmente, en el rango de 109 a 1013/m3.
4. Procedimiento acorde a una de las reivindicaciones 1 a 3, caracterizado porque los solventes utilizados para la disolución de la sustancia sólida no soluble en agua o de escasa disolución en agua son líquidos hidrófilos, especialmente, alcoholes, preferentemente, metanol, etanol e isopropanol, mezclas de agua con líquidos miscibles total o parcialmente con agua o líquidos hidrófilos, especialmente, alcoholes, preferentemente, metanol, etanol o isopropanol u otros solventes orgánicos, o líquidos no miscibles con agua, especialmente, cloroformo o diclorometano, asimismo, los solventes preferidos son N-metil-2-pirrolidinona, 2-pirrolidona, dimetilacetamida, ethanol, acetona, cloroformo, diclorometano, dimetilsulfóxido, N-propanol, glicerol, etilenglicol, dimetilformamida, dimetilacetamida o ácidos y bases, especialmente, ácido de cloruro de hidrógeno, ácido sulfúrico, ácido acético, ácido fórmico, trietanolamina, piridina, amoníaco, asimismo, se utiliza, eventualmente, una mezcla de dos o más de ellos.
5. Procedimiento acorde a una de las reivindicaciones 1 a 4, caracterizado porque la solución de sustancia sólida obtenida en a) contiene, además, una o múltiples sustancias auxiliares y sustancias estabilizantes de la dispersión, especialmente, tensioactivos, estabilizantes del tipo de antifloculantes y polímeros, así como otras sustancias de relleno inertes, asimismo, las concentraciones por componente, en relación al peso, se encuentran, preferentemente, en el rango de 1-90%, especialmente, de 1-20% y, preferentemente, por debajo del 10%, de manera ideal, por debajo del 0,01-5%.
6. Procedimiento acorde a la reivindicación 5, caracterizado porque las sustancias estabilizantes contienen compuestos de la serie de poloxámeros poloxaminas, mono y diglicéridos etoxilados, lípidos y lipoides etoxilados, alcoholes grasos y alquilfenoles etoxilados, ésteres de ácidos grasos, éteres y ésteres de poliglicerina, lecitinas, ésteres y éteres de azúcares o alcoholes de azúcar con ácidos grasos o alcoholes grasos, fosfolípidos y esfingolípidos, esterinas, sus ésteres o éteres y las mezclas de estos compuestos.
7. Procedimiento acorde a la reivindicación 5, caracterizado porque las sustancias estabilizantes comprenden lecitina de huevo, lecitina de soja o lecitina hidrogenada, sus mezclas o mezclas de una o ambas lecitinas con uno o múltiples componentes de fosfolípidos, colesterol, palmitato de colesterol, estigmasterina u otras esterinas.
8. Procedimiento acorde a la reivindicación 5, caracterizado porque los estabilizadores comprenden diacetilfosfato, fosfatidilglicerol, ácidos grasos saturados o insaturados, colato de sodio, peptizadores o aminoácidos.
9. Procedimiento acorde a una de las reivindicaciones 5 a 8, caracterizado porque la solución de sustancia sólida contiene una o múltiples sustancias que elevan la viscosidad, especialmente, éteres o ésteres de celulosa, derivados de polivinilo, alginatos, xantanos, pectinas, poliacrilatos, poloxámeros y poloxaminas, alcohol de polivinilo, polivinilpirrolidona.
10. Procedimiento acorde a una de las reivindicaciones 5 a 9, caracterizado porque la solución de sustancia sólida contiene, además, una o múltiples otras sustancias auxiliares, especialmente, azúcar o alcoholes de azúcar, preferentemente, glucosa, manosa, trehalosa, manita y sorbita, fructosa, citrato de sodio, fosfato de hidrógeno de sodio, fosfato de sulfito de dihidrógeno de sodio, cloruro de sodio, cloruro de potasio, glicerina, colorantes o pigmento.
11. Procedimiento acorde a una de las reivindicaciones 1 a 10, caracterizado porque para el procedimiento de enfriado en b) se utilizan procedimientos a través de los cuales se lleva a cabo un enfriamiento completo de la parte por enfriar en ese momento de la solución obtenida, en menos de 60 segundos, preferentemente, en menos de 30 segundos, de modo especialmente preferido, en menos de 10 segundos, de manera especial, en menos de 1 segundo.
12. Procedimiento acorde a una de las reivindicaciones 1 a 12, caracterizado porque a la matriz sólida obtenida por extracción de frío en b) se le extrae por liofilización el solvente, antes de la dispersión en la cual el agentes de dispersión, que conforma la fase externa, especialmente, en el caso de utilizar solventes inadecuados para la aplicación directa en seres humanos y animales.
13. Procedimiento acorde a una de las reivindicaciones 1 a 12 caracterizado porque el secado se lleva a cabo de modo cuidadoso, a lo largo de varias horas, preferentemente, en menos de 168 horas, de modo especialmente preferido, en menos de 72 horas, especialmente, en menos de 24 horas, en casos especiales, en menos de 12 horas, en un aparato de liofilización, a presiones bajas, preferentemente, a 0,5 mbar, de modo especialmente preferido, a 0,1 mbar, de manera especial, a 0,05 mbar, y a a temperaturas, preferentemente, inferiores a 20ºC, especialmente, inferiores a 0ºC y especialmente, inferiores a -20ºC.
14. Procedimiento acorde a una de las reivindicaciones 1 a 13, caracterizado porque la matriz sólida obtenida tras la extracción del o de los solventes contiene la sustancia sólida en forma cristalina, parcialmente cristalina o amorfa y una cantidad residual de solvente, en relación al peso, de menos de 50 por ciento, preferentemente, menos de 10 por ciento, de modo especialmente preferido, menos de 5 por ciento, especialmente, menos de 1 por ciento.
15. Procedimiento acorde a una de las reivindicaciones 1 a 14, caracterizado porque la matriz sólida obtenida tras la extracción del solvente es dispersada en un agente de dispersión, especialmente, por agitación, con agitadores de paletas planas, sistemas rotor-estator o mezcladores estáticos, de modo que se obtiene una dispersión.
16. Procedimiento acorde a la reivindicación 15, caracterizado porque como agente de dispersión se utiliza agua, mezclas de agua y o líquidos no miscibles con agua, medios no acuosos o solventes orgánicos o líquidos lipófilos, especialmente, aceites y aceites grasos, en los cuales la sustancia sólida es insoluble o difícilmente soluble.
17. Procedimiento acorde a una de las reivindicaciones 1 a 16, caracterizado porque la dispersión obtenida en d) puede contener, además, una o múltiples sustancias auxiliares y una o múltiples sustancias estabilizantes de la dispersión, especialmente, tensioactivos, estabilizadores del tipo de antifloculantes y polímeros, así como otras sustancias de relleno inertes, asimismo, las concentraciones por componente, en relación al peso, se encuentran, preferentemente, en el rango de 1-90%, especialmente, de 1-20% y, preferentemente, por debajo del 10%, de manera ideal, por debajo del 0,01-5%.
18. Procedimiento acorde a la reivindicación 17, caracterizado porque las sustancias estabilizantes de la dispersión contienen compuestos de la serie de poloxámeros poloxaminas, mono y diglicéridos etoxilados, lípidos y lipoides etoxilados, alcoholes grasos y alquilfenoles etoxilados, ésteres de ácidos grasos, éteres y ésteres de poliglicerina, lecitinas, ésteres y éteres de azúcares o alcoholes de azúcar con ácidos grasos o alcoholes grasos, fosfolípidos y esfingolípidos, esterinas, sus ésteres o éteres y las mezclas de estos compuestos.
19. Procedimiento acorde a la reivindicación 17, caracterizado porque las sustancias estabilizantes de la dispersión comprenden lecitina de huevo, lecitina de soja o lecitina hidrogenada, sus mezclas o mezclas de una o ambas lecitinas con uno o múltiples componentes de fosfolípidos, colesterol, palmitato de colesterol, estigmasterina u otras esterinas.
20. Procedimiento acorde a la reivindicación 17, caracterizado porque los estabilizadores comprenden dicetilfosfato, fosfatidilglicerol, ácidos grasos saturados o insaturados, colato de sodio, peptizadores o aminoácidos.
21. Procedimiento acorde a una de las reivindicaciones 1 a 20, caracterizado porque en la dispersión se encuentran una o múltiples sustancias que elevan la viscosidad, especialmente, éteres o ésteres de celulosa, derivados de polivinilo, alginatos, xantanos, pectinas, poliacrilatos, poloxámeros y poloxaminas, alcohol de polivinilo, polivinilpirrolidona.
22. Procedimiento acorde a una de las reivindicaciones 1 a 21, caracterizado porque la dispersión contiene, además, sustancias auxiliares, como azúcar o alcoholes de azúcar, preferentemente, glucosa, manosa, trehalosa, manita y sorbita, fructosa o sustancias auxiliares como citrato de sodio, fosfato de hidrógeno de sodio, fosfato de sulfito de dihidrógeno de sodio, cloruro de sodio, cloruro de potasio, glicerina.
23. Procedimiento acorde a una de las reivindicaciones 1 a 22, caracterizado porque la energía aplicada es aplicada por un proceso de alta presión, en el cual se utilizan, especialmente, homogeneizadores pistón de dos etapas (por ejemplo, APV Gaulin, NiroSoavi, Avestin), Jet-Stream (por ejemplo, microfluidizadores) o un French Press (SLM Instruments, Urbana, USA).
24. Procedimiento acorde a una de las reivindicaciones 1 a 23, caracterizado porque al utilizar homogeneizadores de presión elevada, la presión de homogeneización se halla por encima de los 100 bar, preferentemente, a 500 bar o más, especialmente, a 1500 bar o más, de manera más favorable, a 2000 bar o más.
25. Procedimiento acorde a una de las reivindicaciones 1 a 24, caracterizado porque en el caso de prescindir del secado de la matriz congelada, ésta es dispersada en el estado congelado en una fase externa y las fuerzas actúan sobre la matriz dispersada, aún congelada, de modo que se lleva a cabo una fundición de la matriz congelada y, unida a ella, una liberación de las partículas de sustancia sólida no disueltas, directamente en el momento de la primera acción de la fuerza por utilizar.
26. Procedimiento acorde a una de las reivindicaciones 23 o 24, caracterizado porque al utilizar homogeneizadores de alta presión para alcanzar un tamaño medio de partículas PCS inferior a 1000 nm, la cantidad de ciclos de homogeneización es de menos de 10, especialmente, menos de 5, de modo preferido, de menos de 3 y, especialmente, sólo 1.
27. Procedimiento acorde a una de las reivindicaciones 1 a 26, caracterizado porque las partículas contenidas en la suspensión de partículas obtenida en e) son separadas o secadas, especialmente, liofilizadas.
28. Procedimiento acorde a una de las reivindicaciones 1 a 27, caracterizado porque la suspensión obtenida o las partículas obtenidas tras la separación de la suspensión son procesadas hasta obtener productos intermedios o finales.
29. Procedimiento acorde a una de las reivindicaciones 1 a 28, caracterizado porque la suspensión obtenida, o las partículas obtenidas tras la separación de la suspensión, son procesadas mediante la aplicación en pellets de azúcar o mediante la incorporación en pellets de matriz.
30. Procedimiento acorde a las reivindicaciones 1 a 26, caracterizado porque la suspensión obtenida es secada por pulverización o liofilizada.
31. Procedimiento acorde a una de las reivindicaciones 1 a 30, caracterizado porque la reducción de sustancias sólidas en e) se lleva a cabo mediante homogeneizadores de alta presión y, al mismo tiempo, se provoca una modificación en la superficie de las partículas de sustancias sólidas, asimismo,
32. Procedimiento acorde a la reivindicación 31, caracterizado porque en el caso de las nanopartículas de sustancia sólida obtenidas por homogeneización a alta presión, se trata de nanocristales de sustancias medicinales, que, a los fines de la modificación de superficie y de la estabilización, están revestidos con, al menos, dos capas de polielectrolitos con cargas contrarias, con un valor de pH determinado del agente de dispersión.
33. Procedimiento acorde a la reivindicación 31 o 32, caracterizado porque la modificación de la superficie de las nanopartículas de sustancia sólida mediante una primera cobertura, que consiste, al menos, en un primer polielectrolito que se halla presente como policatión en el caso de un valor de pH determinado del agente de dispersión y una segunda cobertura, de un segundo polielectrolito, que se halla presente como polianión en el caso de un valor de pH determinado del agente de dispersión.
34. Procedimiento acorde a una de las reivindicaciones 31 a 33, caracterizado porque en el caso de los polielectrolitos utilizados se trata de polimetacrilatos, ftalato de acetato de celulosa (CAP), ftalato de hidroxipropilmetilcelulosa (HPMCP), succinato de acetato de hidroxipropilmetilcelulosa (HPMCAS), ácido poliacrílico, ácido algínico, carboximetilcelulosa, sulfato de dextrano, ácido sulfónico de lignina, ácido sulfónico de polivinilo, ácido fosfónico de polivinilo, ácido sulfónico de condroitina, gelatinas A, gelatinas B, quitosano, sulfato de protamina, ácido hialuronico, ácido polilisico, ácido poliláctico, carragenanos, pectinas, goma arábiga, ácido nucleico, polietilenimina, polivinilamina y polivinilpirridina, así como, respectivamente, sus diferentes sales, bases libres o ácidos libres.
35. Procedimiento acorde a una de las reivindicaciones 31 a 34, caracterizado porque las nanopartículas de sustancia activa resultantes que modifican la superficie poseen un potencial zeta, medido en agua, con una conductividad en el rango de 50 µS, con valores de pH entre 4 a 7, en el rango de 5 mV a 100 mV, preferentemente, en el rango de 20 mV a 80 mV, de modo especialmente preferido, en el rango de 30 mV a 60 mV, asimismo, solamente es relevante el monto del potencial zeta y no sus signos.
36. Utilización de suspensiones de partículas obtenidas acorde a una de las reivindicaciones 1 a 35, o de partícula obtenidas tras la separación de las suspensiones de partículas, para la obtención de preparados farmacéuticos y cosméticos, preferentemente, en forma de pastillas y cápsulas, cremas, pomadas o polvos para la reconstitución antes de la aplicación.
37. Utilización acorde a la reivindicación 36, caracterizada porque la suspensión obtenida se utiliza como líquido de granulación, y el granulado obtenido en el paso de granulación eventualmente es prensado antes de la utilización, para obtener pastillas.
38. Utilización acorde a la reivindicación 36 o 37, caracterizada porque las suspensiones o partículas obtenidas son utilizadas vertidas en cápsulas de gelatina rígida o blanda.
39. Utilización acorde a una de las reivindicaciones 36 a 38, caracterizada porque las suspensiones o partículas obtenidas son utilizadas en los sectores de la alimentación, la industria textil y agraria, especialmente, como suspensiones de pesticidas.
Patentes similares o relacionadas:
GRANULADO QUE CONTIENE UNA SUSTANCIA FARMACÉUTICAMENTE ACTIVA Y UN EMULSIONANTE Y MÉTODO PARA SU PRODUCCIÓN, del 12 de Diciembre de 2011, de ECHO PHARMACEUTICALS B.V: Un granulado con un diámetro medio ponderado en volumen de 1-200 µm y que contiene: - al menos 0,1 % en peso de una sustancia farmacéuticamente activa; - al menos 10 […]
 PROCEDIMIENTO PARA LA PREPARACIÓN DE MICROPARTÍCULAS, del 7 de Junio de 2011, de EVONIK ROHM GMBH: Procedimiento para la preparación de micropartículas, que comprende las etapas a) preparar una masa fundida de polímero que comprende al menos un polímero de soporte y […]
PROCEDIMIENTO PARA LA PREPARACIÓN DE MICROPARTÍCULAS, del 7 de Junio de 2011, de EVONIK ROHM GMBH: Procedimiento para la preparación de micropartículas, que comprende las etapas a) preparar una masa fundida de polímero que comprende al menos un polímero de soporte y […]
 AEROSOLES QUE COMPRENDEN FÁRMACOS EN NANOPARTÍCULAS, del 20 de Mayo de 2011, de ELAN PHARMA INTERNATIONAL LIMITED: Una composición en aerosol de polvo seco que comprende agregados de partículas de fármaco nanoparticulado, en la que: (a) los agregados […]
AEROSOLES QUE COMPRENDEN FÁRMACOS EN NANOPARTÍCULAS, del 20 de Mayo de 2011, de ELAN PHARMA INTERNATIONAL LIMITED: Una composición en aerosol de polvo seco que comprende agregados de partículas de fármaco nanoparticulado, en la que: (a) los agregados […]
 PROCEDIMIENTO PARA LA PREPARACIÓN DE PARTÍCULAS A PARTIR DE UNA EMULSIÓN EN CO2 SUPERCRÍTICO O LÍQUIDO, del 26 de Enero de 2011, de INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE (INSERM): Procedimiento para la preparación de partículas que comprende las etapas que consisten en: i) preparar una emulsión que contiene: - como fase continua, CO2 líquido o supercrítico, […]
PROCEDIMIENTO PARA LA PREPARACIÓN DE PARTÍCULAS A PARTIR DE UNA EMULSIÓN EN CO2 SUPERCRÍTICO O LÍQUIDO, del 26 de Enero de 2011, de INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE (INSERM): Procedimiento para la preparación de partículas que comprende las etapas que consisten en: i) preparar una emulsión que contiene: - como fase continua, CO2 líquido o supercrítico, […]
PELLETS DE LIBERACIÓN SOSTENIDA QUE COMPRENDEN UN MATERIAL TIPO CERA, del 17 de Enero de 2011, de FARNAM COMPANIES, INC: Una composición que comprende: (a) de aproximadamente un 5% a aproximadamente un 90% de un ingrediente activo; (b) de aproximadamente un 5% a aproximadamente […]
 COMPOSICION BIOREABSORBIBLE DE LIBERACION CONTROLADA, del 1 de Julio de 2010, de LIDDS AB: Un procedimiento que comprende las etapas de:
i)mezclar una o más cerámicas bioreabsorbibles e hidratables con una o más sustancias terapéutica, profiláctica y/o diagnósticamente […]
COMPOSICION BIOREABSORBIBLE DE LIBERACION CONTROLADA, del 1 de Julio de 2010, de LIDDS AB: Un procedimiento que comprende las etapas de:
i)mezclar una o más cerámicas bioreabsorbibles e hidratables con una o más sustancias terapéutica, profiláctica y/o diagnósticamente […]
 FORMULACIONES OPIOIDES ADMINISTRABLES ORALMENTE OBTENIDAS MEDIANTE EXTRUSION POR FUSION, del 11 de Mayo de 2010, de EURO-CELTIQUE S.A.: Forma de dosificación oral, analgésica, de liberación sostenida, que comprende una masa extruída en fusión, farmacéutica, que incluye un analgésico opioide en […]
FORMULACIONES OPIOIDES ADMINISTRABLES ORALMENTE OBTENIDAS MEDIANTE EXTRUSION POR FUSION, del 11 de Mayo de 2010, de EURO-CELTIQUE S.A.: Forma de dosificación oral, analgésica, de liberación sostenida, que comprende una masa extruída en fusión, farmacéutica, que incluye un analgésico opioide en […]
Métodos y composiciones para la administración oral de proteínas, del 22 de Julio de 2020, de Entera Bio Ltd: Una única composición farmacéutica oral que comprende una proteína que tiene un peso molecular de hasta 100.000 Daltons, siendo dicha proteína PTH; […]