FRAGMENTOS SOLUBLES DEL ECTODOMINIO DE MET Y USOS DE LOS MISMOS.
Método de ensayo que comprende:
(a) proporcionar un fragmento del ectodominio de MET en forma monomérica,
donde dicho fragmento del ectodominio de MET consiste en los aminoácidos 25-928 del ectodominio de MET o es un fragmento N-terminal del mismo que tiene por lo menos 495 aminoácidos;
(b) proporcionar un agente; y
(c) determinar el grado en el que el agente interacciona con dicho fragmento
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2004/003957.
Solicitante: MEDICAL RESEARCH COUNCIL.
Nacionalidad solicitante: Reino Unido.
Dirección: MEWBURN ELLIS LLP 33 GUTTER LANE,LONDON EC2V 8AS.
Inventor/es: GHERARDI,ERMANNO,MRC CENTRE.
Fecha de Publicación: .
Fecha Concesión Europea: 31 de Marzo de 2010.
Clasificación Internacional de Patentes:
- C07K14/71 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › para factores de crecimiento; para reguladores de crecimiento.
Clasificación PCT:
- A61K38/17 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que provienen de animales; que provienen de humanos.
- C07K14/71 C07K 14/00 […] › para factores de crecimiento; para reguladores de crecimiento.
- C12N15/12 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Genes que codifican proteínas animales.
- G01N33/68 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen proteínas, péptidos o aminoácidos.
Clasificación antigua:
- A61K38/17 A61K 38/00 […] › que provienen de animales; que provienen de humanos.
- C07K14/71 C07K 14/00 […] › para factores de crecimiento; para reguladores de crecimiento.
- C12N15/12 C12N 15/00 […] › Genes que codifican proteínas animales.
- G01N33/68 G01N 33/00 […] › en los que intervienen proteínas, péptidos o aminoácidos.
Fragmento de la descripción:
Fragmentos solubles del ectodominio de MET y usos de los mismos.
Campo de la invención
La presente invención se refiere a fragmentos de proteína monomérica derivados del ectodominio del receptor MET.
Antecedentes de la invención
Los receptores tirosina quinasas (RTKs) median en las señales intercelulares esenciales para el desarrollo y mantenimiento de las células de organismos multicelulares. La estructura de dominio mínima de RTKs consiste en un dominio extracelular de unión a ligando, una única hélice transmembrana y un dominio quinasa citoplasmático. Esta estructura mínima, sin embargo, es muy rara y habitualmente la parte extracelular de RTKs, el ectodominio, consiste en grupos de dominios complejos y diferentes que permiten la clasificación de los RTKs en diferentes familias (1).
Existe una gran preferencia para que ciertos dominios aparezcan en el ectodominio de RTKs. El dominio de fibronectina tipo 3 (FN-3), por ejemplo, está presente como 2 copias en la gran familia de receptores Eph, 3 copias en los receptores de insulina e IGF-1 y por lo menos 7 copias en el receptor ROS (1). Los dominios ricos en cisteína de longitud variable también se encuentran habitualmente en RTKs.
Una gran cantidad de RTKs contiene dominios de inmunoglobulina (IG) y el ectodominio de ciertas familias consiste únicamente en dominios IG; los receptores FGF contienen 2 ó 3, dependiente del corte y empalme ("splicing") de ARN, los receptores PDGF, CSF1, KIT y FLK2/STK2 contienen 5 y los receptores FLT1, FLK1, FLT4 y CCK4 contienen 7 (1). Los dominios IG también pueden estar presentes en combinación con FN-2, dominios ricos en cisteína u otros dominios (1). DE forma destacada, la mayoría de los dominios IG presentes en RTKs y moléculas de adhesión celular pertenecen a un grupo estructural diferente conocidos como "grupo I", con una arquitectura intermedia entre los grupos V y C1 (2).
MET, el RTK codificado por el proto-oncogén c-met (3, 4), es el receptor para HGF/SF (5), un factor de crecimiento polipeptídico grande descubierto como una proteína que provoca la dispersión de colonias epiteliales y la migración celular (factor de dispersión) (6, 7) y como mitógeno hepático (factor de crecimiento de los hepatocitos) (8-10). HGF/SF y MET son esenciales para el desarrollo de varios tejidos y órganos, incluyendo la placenta (11, 12), el hígado (11) y varios grupos de músculo esquelético (13). También juegan un papel principal en la migración anormal de células cancerosas como resultado de la sobreexpresión de mutaciones de MET (14). A diferencia de la gran cantidad de datos sobre los mecanismos de transducción de señales activadas por MET (15), poco se sabe sobre el MET extracelular.
La implicación de MET en la extensión de tumores hace que este gen sea una diana adecuada para el desarrollo de antagonistas que podrían evitar la activación de este RTK. El desarrollo de ensayos adecuados que implican proteínas complejas grandes puede ser difícil, particularmente cuando se desea tener un proceso robusto adecuado para cribados de alto rendimiento. Esto puede ser particularmente problemático cuando, como con MET, se cree que la dimerización del receptor es necesaria para la unión a su ligando afín.
Mark et al, J. Biol. Chem. 1992, 267; 26166-26171, describen fusiones del dominio extracelular del receptor MET a la región constante de una cadena pesada de IgG. Estas fusiones producen una proteína met soluble que forma un dímero a través de la presencia de la región de cadena pesada.
Descripción de la invención
Se han investigado las propiedades del receptor MET y se observó que sorprendentemente un fragmento derivado del ectodominio de MET en forma de monómero se une a HGF/SF en presencia o ausencia de heparina. La disponibilidad de formas monoméricas solubles del receptor MET permitió estudios de sus propiedades en solución y la unión a HGF/SF.
Por consiguiente, la presente invención proporciona un método de ensayo que comprende:
La interacción del fragmento de ectodominio con el agente incluye la unión de dicho agente a dicho fragmento, la alteración de la dimerización de dicho fragmento, la alteración de la capacidad de dicho fragmento para unirse a HGF/SF o un fragmento del mismo que se une a dicho ectodominio, o la alteración de la capacidad del fragmento para unirse a heparina o sulfato de heparano.
En una realización preferida, se realiza el ensayo en presencia de HGF/SF o un fragmento del mismo que se une a dicho ectodominio.
En un aspecto adicional, el ensayo de la invención se puede realizar en presencia de heparina o sulfato de heparano.
El ensayo se puede realizar en cualquier formato conveniente, por ejemplo en solución o en el que uno de los componentes está en un soporte sólido.
La presente invención proporciona además una proteína aislada que consiste en un fragmento de ectodominio de MET.
La presente invención también proporciona una composición que comprende proteínas del fragmento de ectodominio de MET de la invención.
Descripción de los dibujos
La figura 1 muestra la localización por deleción y la expresión de dominios MET.a. Vista esquemática y límites de las secuencias de las deleciones N y C terminales del ectodominio de MET. Las cadenas alfa y beta se muestran en grados de grises diferentes. L indica una inmunoglobulina líder de 21 aminoácidos utilizada para la secreción de proteínas de MET y la caja negra corresponde a la secuencia rica en cisteína (aminoácidos 520-561) de la cadena beta de MET. Los ADNc correspondientes a varias deleciones C-terminales del ectodominio de MET (bandas superiores, M) se muestra junto con una banda de vector (V). c. Expresión de las mismas deleciones en MET en sobrenadantes de transfectantes estables de la línea de mieloma de ratón NS0. H y GH definen las construcciones de MET monoméricas y diméricas, respectivamente.
La figura 2 muestra la unión de las deleciones en MET a HGF/SF (a y b) o heparina (c y d). a y b. Unión de las deleciones en MET a HGF/SF de cada sencilla (a) o doble cadena (b) medida en un ensayo en fase sólida. C y d. Unión de tres construcciones de MET (25-519GH, 25-932GH y 567-928GH) a heparina inmovilizada. Tanto MET de longitud completa (25-932GH) como MET 25-519GH mostraron unión, mientras que MET 567-928GH no mostró ninguna. La unión fuerte a heparina de HGF/SF maduro (doble cadena) se muestra por comparación en la figura 2c.
La figura 3 muestra MET monomérica de longitud completa y complejos HGF/SF-MET. a. SDS-PAGE bajo condiciones reductoras de MET 25-838H de células NS0 (carril 1) o células Lec 8 (carril 2) y MET 25-928H de células Lec 8. b. Electroforesis en gel bajo condiciones nativas de HGF/SF, MET y complejos HGF/SF-MET en ausencia o presencia de heparina. c-h. Análisis de la velocidad de sedimentación de HGF/SF (c y d), MET (e y f) y el complejo HGF/SF heparina-MET (g y h). c, e y g son representaciones de g(s*) frente a s*20,w, d, f y h son representaciones de los residuales, a partir de los modelos de ajuste de los datos, frente a s*20,w a la derecha. Los experimentos mostrados en los paneles b, e y g se llevaron a cabo con cantidades equimolares de HGF/SF y MET 25-928H derivadas de células Lec 8s (4 x 10-6 M) y un exceso de heparina de 2,5 veces.
La figura 4 muestra la unión de HGF/SF a MET en un ensayo en fase sólida.
La figura 5 muestra un gráfico para ilustrar la unión de HGF/SF biotinilado a MET en un ensayo ELISA. Se inmovilizó MET en una placa HisGrab recubierta de níquel (Pierce) a 4 µg/ml o una placa Maxisorp (Nunc) a 8 µg/ml. Los valores EC50 fueron 2,2x10-10 mol l-1 o 1,95x1010 mol l-1 de las placas HisGrab o Maxisorp, respectivamente.
La figura 6 muestra la inhibición de la unión de HGF/SF biotinilado a MET en un ensayo en presencia de un compuesto positivo de un cribado de biblioteca más otros tres identificados de una búsqueda por subestructura.
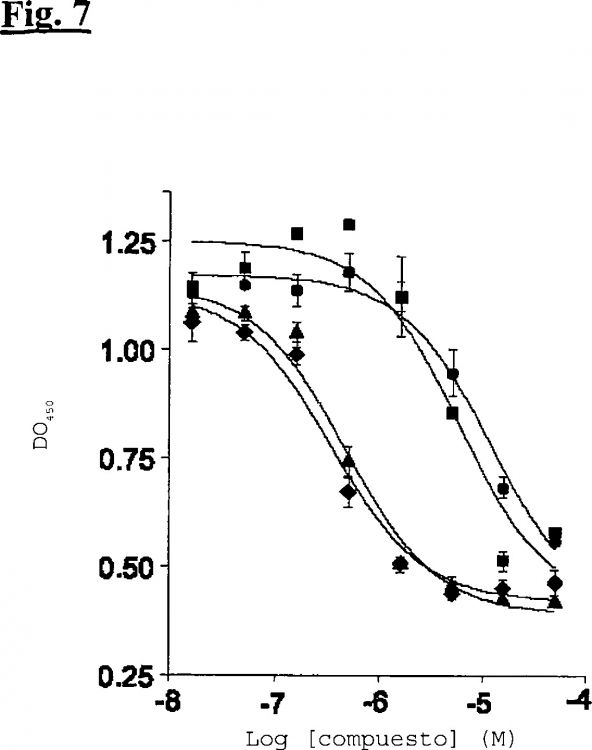
La figura 7 muestra la inhibición de la unión de HGF/SF biotinilado a MET en un ensayo en presencia de un compuesto positivo de un cribado de biblioteca más otros tres identificados de una búsqueda por subestructura.
Descripción...
Reivindicaciones:
1. Método de ensayo que comprende:
(a) proporcionar un fragmento del ectodominio de MET en forma monomérica, donde dicho fragmento del ectodominio de MET consiste en los aminoácidos 25-928 del ectodominio de MET o es un fragmento N-terminal del mismo que tiene por lo menos 495 aminoácidos;
(b) proporcionar un agente; y
(c) determinar el grado en el que el agente interacciona con dicho fragmento.
2. Ensayo según la reivindicación 1, que se realiza en presencia de HGF/SF o un fragmento del mismo que se unen a dicho ectodominio.
3. Ensayo según la reivindicación 1 ó 2, que se realiza en presencia de heparina o sulfato de heparano.
4. Ensayo según cualquiera de las reivindicaciones anteriores, en el que el fragmento del ectodominio de MET es un fragmento seleccionado entre 25-519, 25-567, 25-656, 25-741 y 25-838.
5. Ensayo según cualquiera de las reivindicaciones anteriores, en el que la etapa de determinación (c) examina el grado en el que se dimeriza el fragmento del ectodominio de MET.
6. Ensayo según cualquiera de las reivindicaciones anteriores, en el que el ensayo se realiza utilizando electroforesis en gel, filtración en gel o ultracentrifugación.
7. Ensayo según cualquiera de las reivindicaciones 1 a 5, que es un ensayo de unión en fase sólida.
8. Fragmento del ectodominio de MET aislado en forma monomérica, en el que dicho fragmento del ectodominio de MET consiste en los aminoácidos 25-298 del ectodominio de MET o es un fragmento N-terminal del mismo que tiene por lo menos 495 aminoácidos.
9. Fragmento aislado según la reivindicación 8, en el que el fragmento del ectodominio de MET es un fragmento seleccionado entre 25-519, 25-567, 25-656, 25-741 y 25-838.
10. Fragmento aislado según la reivindicación 8 ó 9, que comprende adicionalmente una etiqueta detectable de no más de 40 aminoácidos de secuencias que no son de MET, en cualquiera de los extremos.
11. Composición que comprende proteínas del fragmento del ectodominio de MET según cualquiera de las reivindicaciones 8 a 10, junto con un diluyente o portador.
12. Composición según la reivindicación 11, que comprende además HGF/SF o un fragmento del mismo que se une a dicho ectodominio.
13. Composición según la reivindicación 11 ó 12, que comprende además heparina o sulfato de heparano.
14. Ensayo según cualquiera de las reivindicaciones 1 a 7, que comprende además identificar un farmacóforo y modelar el farmacóforo para diseñar compuestos adicionales que presentan una mayor actividad de unión.
15. Ensayo según la reivindicación 14, en el que el agente es un péptido y dicho método comprende las etapas de (i) analizar el agente para determinar los residuos de aminoácidos esenciales e importantes para la actividad de unión para definir un farmacóforo, y (ii) modelar el farmacóforo para diseñar y/o cribar miméticos candidatos que presentan la actividad de unión.
Patentes similares o relacionadas:
Anticuerpo biespecífico o mezcla de anticuerpos con cadenas ligeras comunes, del 15 de Julio de 2020, de Jiangsu Alphamab Biopharmaceuticals Co., Ltd: Anticuerpo biespecífico o parte de unión a antígeno del mismo, en el que el anticuerpo biespecífico o la parte de unión a antígeno del mismo tiene una cadena […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Un polipéptido de receptor de factor de crecimiento de fibroblastos 3 (FGR3) soluble para su uso en la prevención o tratamiento de trastornos de retraso del crecimiento esquelético, del 15 de Abril de 2020, de INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE (INSERM): Un polipéptido de receptor del factor de crecimiento de fibroblastos 3 soluble (sFGFR3) aislado para su uso en la prevención o tratamiento de una enfermedad […]
Variantes derivadas de ActRIIB y usos de los mismos, del 8 de Abril de 2020, de ACCELERON PHARMA, INC: Una proteína ActRIIB variante para su uso en el tratamiento de la caquexia, en donde la proteína ActRIIB variante comprende una secuencia de aminoácidos que es al menos 90% […]
Endodermo que expresa pdx1, del 8 de Abril de 2020, de VIACYTE, INC: Un método para producir una población celular que comprende células humanas de endodermo positivas para PDX1, dicho método comprende los pasos de: cultivar […]
Uso combinado de trampas de GDF y activadores del receptor de la eritropoyetina para aumentar los niveles de glóbulos rojos, del 11 de Marzo de 2020, de ACCELERON PHARMA, INC: Un polipéptido para su uso para tratar o prevenir la anemia o aumentar los niveles de glóbulos rojos en un paciente, donde dicho aumento, tratamiento o prevención comprende […]
Composiciones y métodos para tratar la hipertensión pulmonar, del 8 de Enero de 2020, de THE BRIGHAM AND WOMEN'S HOSPITAL, INC.: Una trampa del ligando de TGF-β que comprende un dominio de unión al ligando de TGF-β de un receptor tipo II de TGF-β y un dominio Fc de una inmunoglobulina […]
Receptores de antígenos quiméricos (CARS) con mutaciones en la región del espaciador Fc y métodos para su uso, del 23 de Octubre de 2019, de CITY OF HOPE: Un receptor de antígeno quimérico (CAR) recombinante que tiene una unión deteriorada a un receptor Fc (FcR), que comprende: un dominio de reconocimiento de antígeno; […]