DERIVADOS DE PIRIMIDINA 5-SUSTITUIDOS DE ANALOGOS NUCLEOSIDOS BLOQUEADOS CONFORMACIONALMENTE.
Un derivado pirimidina 5-sustituido de un análogo nucleosídico bloqueado conformacionalmente que tiene la fórmula:
en la que B es un derivado de uracilo 5-sustituido, en el que el 5-sustituyente es I, CH=CH2, CH=CHF, CH=CHCl, CH=CHBr o CH=CHI
Tipo: Resumen de patente/invención. Número de Solicitud: W0123246US.
Solicitante: THE GOVERNMENT OF THE UNITED STATES OF AMERICA, AS REPRESENTED BY THE SECRETARY DEPARTMENT OF HEALTH.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: OFFICE OF TECHNOLOGY TRANSFER, NATIONAL INSTITUTES OF HEALTH, PATENT BRANC,ROCKVILLE, MD 20850.
Inventor/es: MARQUEZ, VICTOR, E., RUSS,PAMELA,L.
Fecha de Publicación: .
Fecha Concesión Europea: 9 de Septiembre de 2009.
Clasificación Internacional de Patentes:
- C07D239/54 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 239/00 Compuestos heterocíclicos que contienen ciclos de diazina-1,3 o diazina-1,3 hidrogenada. › como átomos de oxígeno doblemente enlazados o como radicales hidroxi insustituidos.
- C07D239/553 C07D 239/00 […] › con átomos de halógeno o con radicales nitro unidos directamente a los átomos de carbono del ciclo, p. ej. fluorouracilo.
Clasificación PCT:
- A61K31/513 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › teniendo grupos oxo unidos directamente al heterociclo, p. ej. citosina.
- A61P31/12 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › Antivirales.
- C07D239/54 C07D 239/00 […] › como átomos de oxígeno doblemente enlazados o como radicales hidroxi insustituidos.
Clasificación antigua:
- C07D239/00 C07D […] › Compuestos heterocíclicos que contienen ciclos de diazina-1,3 o diazina-1,3 hidrogenada.
Fragmento de la descripción:
Derivados de pirimidina 5-sustituidos de análogos nucleósidos bloqueados conformacionalmente.
El presente invento se refiere a derivados de pirimidina 5-sustituidos de análogos nucleósidos bloqueados conformacionalmente y al uso de estos derivados como agentes antivirales y anticancerígenos
Se ha reconocido que incorporar análogos no funcionales modificados de sustituyentes de ADN durante la replicación es un método eficaz para terminar la replicación de ADN y a su vez impedir la generación de progenie viable. Estudios recientes han demostrado que las ribosas modificadas y sintéticas y las bases nitrogenadas tienen una actividad antiviral frente a géneros virales variables dependiendo de la modificación. Hay una necesidad constante de agentes antivirales y anticancerígenos eficaces.
El presente invento proporciona derivados de pirimidina 5-sustituidos de análogos nucleosídicos bloqueados conformacionalmente y el uso de estos derivados como agente antivirales y anticancerígenos.
Marquez y otros, J. Med. Chem. 39:3739 (1996) describe análogos nucleósidos de purina y pirimidina que tienen bases naturales unidas a un molde de pseudoazúcar biciclo [3.1.0] hexano. Grignet-Debrus y otros, Cancer Gene Therapy 7: 215 (2000) describe bases modificadas, particularmente uracilos 5-sustituidos que son restos característicos de nucleósidos antivirales cuando se unen a azúcares comunes. La sustituición de las bases modificadas de Grignet-Debrus y otros, por las bases naturales de Marquez y otros produce análogos de pirimidina que son completamente sorprendentes, debido a que la incorporación de estas bases conocidas a un molde biciclo [3.1.0] hexano proporciona compuestos con actividad antiviral que son potentes como sus homólogos nucleosídicos y los análogos carbocíclicos con un anillo ciclopentano plano.
El documento de patente WO 95/08541-A describe análogos nucleósidos carboxílicos fusionados a 4',6'ciclopropano bloqueado conformacionalmente preparados mediante condensación de un alcohol alílico carbocíclico fusionado a ciclopropano con purina sustituidos o bases pirimidina, modificando después el producto de condensación para producir análogos nucleosídicos de la adenosina, guanosina, citidina, timidina y uracilo. Los compuestos son descritos como terapéuticamente útiles como antimetabolitos, o en la preparación de agentes metabólicos.
El documento de patente WO 98/05662-A describe un método para el tratamiento de la infección por herpes virus administrando una cantidad inhibidora de virus eficaz de un 2'desoxinucleósido carbocíclico ciclopropano a un individuo con necesidad de la misma. Los análogos nucleosídicos son descritos como eficaces frente al virus del herpes simplex tipos 1 y 2, virus de Epstein-Barr y citomegalovirus humano.
El presente invento está dirigido a derivados de pirimidina 5-sustituidos de análogos nucleosídicos bloqueados conformacionalmente, y a métodos para usar estos derivados como agentes anti-virales y anticancerígenos.
Los derivados de pirimidina 5-sustituidos de análogos nucleosídicos bloqueados conformacionalmente tienen la fórmula:
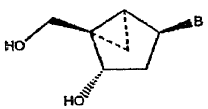
B es un derivado 5-sustituido de uracilo y el 5-sustituyente es un miembro del grupo que consiste en I, CH=CH2, CH=CHF, CH=CHCl, CH=CHBr y CH=CHI.
Derivados de pirimidina 5-sustituida de análogos nucleósidos bloqueados conformacionalmente pueden ser ensayados en lo que respecta a su actividad antiviral por una variedad de métodos conocidos en la técnica.
Un ensayo es el ensayo de inhibición del efecto citopatogénico. Otro ensayo es el ensayo de reducción de placas víricas.
El ensayo de inhibición de efecto citopatogénico procede generalmente como sigue. Marquez y otros, J. Med. Chem. 39: 3739 (1996). Células de fibroblasto de prepucio humano (HFF) de bajo número de pases (3-10) son tripsinizadas contadas, y sembradas en placas de cultivo tisular de 96 pocillos a una concentración de 2,5 x 104 células en 0,1 ml de medio esencial mínimo (MEM) suplementeado con 10% de medio de suero bovino fetal (FBS). Las células son entonces incubadas durante 24 h a 37ºC en una atmósfera humidificada al 90% con 5% CO2-95% aire. El medio es entonces eliminado, y 100 µl de MEM que contiene 2% FBS es añadido a todas las filas excepto a la primera. En la primera fila, 125 µl de medio que contiene el compuesto experimental son añadidos en pocillos por triplicado. El medio solo es añadido a ambos pocillos testigo de células y de virus.
El compuesto en la primera fila de pocillos es entonces diluido en serie 1:5 a lo largo de los pocillos restantes transfiriendo 25 µl usando la máquina de manejo de líquidos Cetus (Cetus Liquid Handling Machine). Las placas son entonces incubadas durante 1 h, y 100 µl de la concentración viral apropiada es añadida a cada pocillo, excluyendo los pocillos testigo de células, que reciben 100 µl de MEM. La concentración viral utilizada es 1000 PFU/pocillo. Las placas son entonces incubadas a 37ºC en un incubador de CO2 durante 3 días. Tras el período de incubación, el medio es aspirado y las células teñidas con una disolución de cristal violeta al 0,1% durante 30 min. La tinción es entonces eliminada y las placas son lavadas con agua corriente hasta que todo exceso de tinción es eliminado. Las placas se permite que se sequen durante 24 h y entonces son leídas en un Autolector Multiplaca Bio Tek.
El ensayo de reducción de placas virales procede generalmente como sigue. Marquez y otros, J. Med. Chem. 39:3739 (1996). En la fecha del ensayo, el fármaco es hecho a 2 veces la concentración deseada en 2 x MEM y después diluido en serie 1:5 en 2 x MEM para dar seis concentraciones de fármaco. Las concentraciones de fármaco utilizadas son normalmente 200 hasta 0,06 µg/ml. El virus a ser usado es diluido en MEM que contiene 10% FBS a una concentración deseada que dará 20-30 placas/pocillo. El medio es entonces aspirado de los pocillos, y 0,2 ml de virus es añadido a cada pocillo en duplicado con 0,2 mL de medio que es añadido a los pocillos de toxicidad de fármaco. Las placas son entonces incubadas durante 1 h con agitación cada 15 min. Tras el período de incubación, una cantidad igual a 1% de agarosa es añadida a un volumen igual de cada dilución del fármaco. Esto dará una concentración de fármaco final que comienza a 100 y termina a 0,03 µg/ml y una concentración de recubrimiento de agarosa de 0,5%. La mezcla de fármaco-agarosa es aplicada a cada pocillo en 2 ml de volumen, y las placas son incubadas durante 3 días, tras lo cual las células son teñidas con una disolución de 1,5 de rojo neutro. Al final del período de 4-6 h de incubación, la tinción es aspirada, y las placas son contadas usando un estereomicroscopio a una magnificación 10 x.
Los derivados 5-sustituidos de análogos nucleósidos bloqueados conformacionalmente se ha encontrado que poseen propiedades farmacológicas valiosas. Tienen un efecto antiviral. Este efecto puede ser demostrado usando el ensayo de inhibición del efecto citopatogénico y el ensayo de reducción de placas virales.
La (North)-metanocarbatimina bloqueada conformacional-mente es un agente antiherpes potente y selectivo, 30 veces más potente que el aciclovir frente al virus de Herpes simplex-1 (HSV-1) y al virus del Herpes simplex-2 (HSV-2) en el ensayo de reducción de placa.
Puesto que el 5-sustituyente en nucleósidos pirimidina es un modulador de actividad antiherpes, tal como en el compuesto antiviral bromoviniluridina (BVDU) muy eficaz, los autores decidieron explorar un grupo de sustituyentes de uracilos 5-sustituidos (Br, I, CH=CH-Br) en esta nueva clase de nucleósidos carboxílicos ensamblados en un molde biciclo [3.1.0] hexano. La serie fue limitada sólo a los análogos North bloqueados conformacionalmente puesto que la antípoda conformacional south de metanocarbatimina se encontró que era inactiva. La síntesis de estos compuestos puede proceder linealmente a partir de la carbociclicamina correspondiente vía el análogo uracilo o mediante una aproximación convergente vía acoplamiento Mitsunobu con la base 5-sustituida.
Las Tablas 1, 2, y 3 demuestran actividad antiviral de uracilos 5-sustituidos (Br, I, CH=CH-Br) unido al molde biciclo [3.1.0]hexano relativo a los testigos activos conocidos correspondientes usando el ensayo de inhibición de efecto citopatogénico y el ensayo de reducción de placas virales. Estos resultados...
Reivindicaciones:
1. Un derivado pirimidina 5-sustituido de un análogo nucleosídico bloqueado conformacionalmente que tiene la fórmula:
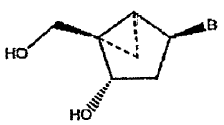
en la que B es un derivado de uracilo 5-sustituido, en el que el 5-sustituyente es I, CH=CH2, CH=CHF, CH=CHCl, CH=CHBr o CH=CHI.
2. El análogo nucleósido de la reivindicación 1, que es un nucleósido de uracilo 5-sustituido por yodo.
3. El análogo nucleósido de la reivindicación 1, que es un nucleósido de uracilo 5-sustituido por Bromovinilo.
4. Un método para ensayar el análogo nucleósido de cualquiera de las reivindicaciones 1-3, en lo que respecta a su actividad antiviral que comprende la etapa de medir el efecto en un ensayo de inhibición del efecto citopatogénico.
5. Un método para ensayar el análogo nucleósido de cualquiera de las reivindicaciones 1-3 para la actividad antiviral que comprende la etapa de medir su efecto en un ensayo de reducción de placas virales.
6. Un método para hacer el análogo nucleósido de cualquiera de las reivindicaciones 1-3 que comprende la etapa de combinar un resto pirimidina 5-sustituido con un molde biciclo [3.1.0] hexano.
7. Un método para hacer el análogo nucleósido de cualquiera de las reivindicaciones 1-3 que comprende la etapa de proceder vía acoplamiento Mitsunobu con una base 5-sustituida.
8. Usar un compuesto de cualquier de las reivindicaciones 1-3, en un vehículo farmacéuticamente aceptable para la fabricación de un medicamento para tratar infecciones virales en un individuo con necesidad del mismo.
9. El uso de la reivindicación 8, en el que dicha infección viral es seleccionada a partir de grupo que consiste en virus del Herpes simplex (HSV), virus de Varicella zoster (VZV), virus de Epstein Barr (EBV), y citomegalovirus (CMV).
10. El uso de la reivindicación 8, en el que la etapa de administración del medicamento es parenteral, entérica, tópica, o de liberación sostenida o dirigida.
11. El uso de la reivindicación 8 en el que la cantidad eficaz del compuesto es alrededor de 100 mg a 500 mg por dosificación unitaria.
12. El uso de un compuesto de cualquiera de las reivindicaciones 1-3 en un vehículo farmacéuticamente aceptable para la fabricación de un medicamento para terminar la elongación de al cadena de ADN en las células de un individuo con necesidad del mismo.
13. El uso de la reivindicación 12 en el que dichas células son modificadas para expresar una timidina quinasa del virus del Herpes simplex.
14. Una composición farmacéutica que comprende el compuesto de cualquier de las reivindicaciones 1-3 en un excipiente farmacéuticamente aceptable.
15. Una paquete que comprende el compuesto de cualquiera de las reivindicaciones 1-3 en forma de dosificación unitaria.
Patentes similares o relacionadas:
Potenciador de efecto antitumoral, del 4 de Marzo de 2020, de TAIHO PHARMACEUTICAL CO., LTD.: Una combinación para su uso en un método de tratamiento de tumores, comprendiendo la combinación (A) un agente antitumoral, y (B) un […]
Derivado de sulfonamida y su uso medicinal, del 8 de Enero de 2020, de EA Pharma Co., Ltd: Un derivado de sulfonamida representado por la siguiente fórmula general o una de sus sales farmacéuticamente aceptables: **(Ver fórmula)** en […]
Dispersión sólida amorfa de un antagonista del receptor de la hormona liberadora de gonadotropina disponible por vía oral, del 20 de Noviembre de 2019, de SANDOZ AG: Una dispersión sólida que comprende elagolix sódico amorfo y al menos un compuesto inorgánico a base de silicio, en donde el compuesto inorgánico a base de silicio es un material […]
Combinaciones que comprenden derivados de 5-fenoxi-3H-pirimidin-4-ona y sus usos para la profilaxis o el tratamiento de la infección por VIH, del 20 de Noviembre de 2019, de MERCK SHARP & DOHME CORP: Una combinación que comprende (i) un compuesto de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable, y (ii) uno o más agentes […]
Uso de derivados de N-(piridin-2-il)-amida para aplicaciones de etiquetado con terahercios, del 19 de Junio de 2019, de COUNCIL OF SCIENTIFIC & INDUSTRIAL RESEARCH: Uso de un compuesto seleccionado de una lista de compuestos (a) a (i), (aa) y (cc) en la autenticación de un producto detectando la resonancia del compuesto […]
Derivados de arilsulfuro y arilsulfóxido con uracilos unidos por C-C como agentes de control de plagas, del 14 de Junio de 2019, de BAYER CROPSCIENCE AG: Compuesto de la fórmula (I)**Fórmula** en donde V1 y V2 representan independientemente entre sí un oxígeno o representan un azufre; R3 representa […]
Derivados de 5-fenoxi-3H-pirimidin-4-ona y su uso como inhibidores de la transcriptasa inversa del VIH, del 20 de Septiembre de 2017, de MERCK SHARP & DOHME CORP: Un compuesto de Fórmula I:**Fórmula** o una de sus sales farmacéuticamente aceptables, en la que: M es CH2, CH2CH2, CH2CH2CH2, CH(CH3), C(CH3)2 o C(O)N(RA); […]
Procedimiento para la preparación de derivados de acrilato de cianofenoxi-pirimidiniloxi-fenilo sustituido, del 8 de Marzo de 2017, de ADAMA MAKHTESHIM LTD: Procedimiento para la reacción entre un derivado de cianofenol y un sustrato aromático, en el que el sustrato aromático se selecciona de entre el grupo que consiste en grupos […]