DERIVADO DE DIBENZOTIAZEPINA CRISTALINO Y SU USO COMO AGENTE ANTIPSICOTICO.
Un compuesto que es 11-(4-[2-(2-hidroxi-etoxi)etil]-1-piperazinil)dibenzo[b, f][1, 4]tiazepina cristalina
Tipo: Resumen de patente/invención. Número de Solicitud: W9802260GB.
Solicitante: ASTRAZENECA AB.
Nacionalidad solicitante: Suecia.
Dirección: NO FIGURA,151 85 SODERTALJE.
Inventor/es: SNAPE,EVAN WILLIAM,ZENECA PHARMACEUTICALS.
Fecha de Publicación: .
Fecha Concesión Europea: 7 de Octubre de 2009.
Clasificación PCT:
- A61K31/55 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen ciclos con siete eslabones, p. ej. azelastina, pentilentetrazol.
- C07D281/16 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 281/00 Compuestos heterocíclicos que contienen ciclos de más de seis miembros que tienen un átomo de nitrógeno y un átomo de azufre como únicos heteroátomos del ciclo. › [b, f]-condensados.
Clasificación antigua:
- A61K31/55 A61K 31/00 […] › que tienen ciclos con siete eslabones, p. ej. azelastina, pentilentetrazol.
- C07D281/16 C07D 281/00 […] › [b, f]-condensados.
Fragmento de la descripción:
Derivado de dibenzotiazepina cristalino y su uso como agente antipsicótico.
La presente invención se refiere a un procedimiento para la preparación de derivados de tiazepina y, en particular, para la preparación de 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina. El compuesto, 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina (Fórmula I)
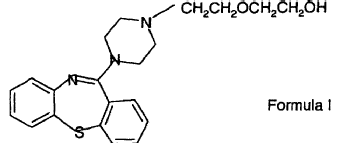
muestra una útil actividad antidopaminérgica y se puede usar, por ejemplo, como agente antipsicótico con una sustancial reducción de potenciales efectos secundarios tales como distonía aguda, discinesia aguda, pseudo-Parkinsonismo y discinesia tardía.
El compuesto de fórmula I se describe en la patente europea concedida EP 240.228. Esta patente describe las propiedades del compuesto de fórmula I y su síntesis a partir de dibenzo[b,f][1,4]tiazepina-11(10-H)-ona. En esta ruta sintética es necesario preparar y purificar el compuesto 2-(2-hidroxietoxi)etil-1-piperazina (HEEP).
La patente europea concedida EP 282.236 describe un procedimiento mejorado para la preparación del compuesto de fórmula I que obvia la necesidad de preparar y purificar el compuesto 2-(2-hidroxietoxi)etil)-1-piperazina ya que este procedimiento mejorado no emplea 2-(2-hidroxietoxi)etil-1-piperazina. También obvia la necesidad de usar carboxietil piperazina que se emplea para preparar 2-(2-hidroxietoxi)etil-1-piperazina.
Muchos compuestos farmacéuticos se desarrollan como sales de ácidos o bases farmacológicamente aceptables. Esto se suele hacer si la sustancia biológicamente activa tiene una forma física que la hace inadecuada para manejarla en los procedimientos de fabricación. La mayoría de los procedimientos de fabricación implican el manejo de materiales en la mezcla y formulación lo que se facilita si los materiales activos son líquidos o sólidos con alto punto de fusión con flujo libre. Aunque las sales pueden estar hechas con los ácidos o bases adecuados con frecuencia no añaden nada al beneficio terapéutico de la composición farmacéutica y por tanto biológicamente son superfluas. Sería mejor si el compuesto farmacéutico se pudiera fabricar como sustancia activa pura.
La síntesis descrita de 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina proporciona 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina como sal de fumarato ya que ha sido necesario preparar la sal para obtener de forma eficiente un producto suficientemente puro. Además, para preparar la sal de fumarato ha sido necesario preparar primero la sal hidrógeno fumarato y posteriormente convertirla en el fumarato.
La presente invención se basa, al menos en parte, en un método mejorado para purificar el compuesto de fórmula I, y en particular en un método para purificar el compuesto de fórmula I de manera que el compuesto de fórmula I se obtenga en forma cristalina.
Según la presente invención se proporciona 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina cristalina.
La 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina cristalina se puede convertir en una de sus sales farmacéuticamente aceptables.
La 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina cristalina generalmente se proporciona en forma esencialmente pura. Generalmente se prefiere que la 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina cristalina tenga una pureza de más del 90%, más preferiblemente una pureza del 99% o más del 99%.
Según la presente invención también se proporciona un procedimiento para preparar 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina cristalina que comprende cristalizar 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina a partir de un disolvente que es un éster de fórmula R1CO2R2 en la que R1 y R2 son grupos alquilo(1-4C); un éter de fórmula R3OR4 en la que R3 y R4 son grupos alquilo(1-4C); o una cetona de fórmula R5COR6 en la que R5 y R6 son grupos alquilo(1-4C) esencialmente en ausencia de agua.
Ejemplos específicos de disolventes adecuados incluyen, por ejemplo, acetato de etilo, acetato de isobutilo, metil iso-butilcetona y metil terc-butil éter.
Disolventes de particular interés incluyen, por ejemplo, éteres. Así, un disolvente de particular interés es metil terc-butil éter;
La cristalización se puede iniciar con la ayuda de un cristal de siembra.
Las sales de 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina comprenderán generalmente sales de adición. Sales convenientes se pueden seleccionar de aquellas sales farmacéuticamente aceptables conocidas en la técnica. Se pueden obtener mediante cualquier método de preparación de sales convencional conocido en la técnica. Por ejemplo, se pueden obtener sales haciendo reaccionar 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina con un ácido conveniente, tal como, ácido clorhídrico, ácido maleico, ácido fumárico, ácido cítrico, ácido fosfónico, ácido metanosulfónico y ácido sulfúrico.
Las sales preferidas incluyen sales fumarato y en particular la sal hemi-fumarato. Generalmente se prefiere que la sal fumarato de 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina sea fumarato de bis-[11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina].
Generalmente se prefiere, por ejemplo, que el disolvente esté seco. Además se prefiere que la 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina esté también seca de manera que la disolución que se forma disolviendo 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina en el disolvente esté esencialmente exenta de agua. Más especialmente, la disolución formada en el procedimiento de cristalización debería estar exenta de agua.
La temperatura de la disolución que contiene 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina se puede disminuir durante la cristalización. En general, la temperatura descenderá hasta aproximadamente 0ºC. Es conveniente, que la temperatura descienda gradualmente a lo largo de un periodo de tiempo. Así, en un ejemplo específico, la temperatura desciende hasta la temperatura ambiente (aproximadamente 25ºC) y después desciende adicionalmente hasta aproximadamente 0ºC durante un periodo superior a 1 hora y generalmente superior a 2 horas. En particular, la temperatura desciende desde temperatura ambiente hasta 0ºC a lo largo de un periodo de aproximadamente 2 a 4 horas, preferiblemente aproximadamente 3 horas. Cuando se usa un cristal para sembrar generalmente se añadirá a la mezcla de cristalización cuando la mezcla esté a temperatura ambiente. En el caso en el que la temperatura desciende, el cristal de siembra, en general, se añadirá justo antes de hacer descender la temperatura (desde temperatura ambiente).
La cantidad de disolvente empleada para cristalizar 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinyl)-dibenzo[b,f][1,4]tiazepina variará de acuerdo con el disolvente preciso seleccionado. En particular la cantidad de disolvente es tal que, cuando 11-(4-[2-(2-hidroxietoxi)etilo]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina se disuelve en él, da una concentración (antes de la cristalización) de aproximadamente 120 a 160 mg/ml, más particularmente 130 a 150 mg/ml. Generalmente se prefiere que la cantidad de disolvente sea tal que proporcione una concentración (antes de la cristalización) de aproximadamente 135 a 145 mg/ml.
En una realización particular de la presente invención se proporciona un método para purificar 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina que comprende cristalizar 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinyl)-dibenzo[b,f][1,4]tiazepina a partir de metil terc-butileter en ausencia de agua.
Condiciones preferidas, particulares y específicas incluyen las mencionadas anteriormente.
También se proporciona un método para preparar la sal fumarato de 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina, tal método comprende hacer reaccionar 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina cristalina con ácido fumárico.
Reivindicaciones:
1. Un procedimiento para preparar 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil-dibenzo[b,f][1,4]tiazepina cristalina que comprende cristalizar 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1.4]tiazepina a partir de una disolución de 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina en un disolvente que es un éster de fórmula R1CO2R2 en la que R1 y R2 son grupos alquilo (1-4C); un éter de fórmula R3OR4 en la que R3 y R4 son grupos alquilo(1-4C); o una cetona de fórmula R5COR6 en la que R5 y R6 son grupos alquilo (1-4C); y en la que la disolución está esencialmente exenta de agua.
2. Un procedimiento según la reivindicación 1, en el que el disolvente se selecciona de acetato de etilo, acetato de isobutilo, metil iso-butilcetona y metil terc-butil éter.
3. Un procedimiento según la reivindicación 2, en el que el disolvente es metil terc-butil éter.
4. Un procedimiento según una cualquiera de las reivindicaciones 1 a 3, en el que la 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina y el disolvente se calientan para dar una disolución y la temperatura de la disolución que contiene la 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina se disminuye hasta temperatura ambiente y después se disminuye adicionalmente hasta aproximadamente 0ºC a lo largo de un periodo superior a 1 hora.
5. Un procedimiento según la reivindicación 4, en el que la temperatura se disminuye desde temperatura ambiente hasta 0ºC a lo largo de un periodo de aproximadamente 2 a 4 horas.
6. Un procedimiento según la reivindicación 4 ó 5, en el que la temperatura se disminuye desde temperatura ambiente hasta 0ºC a lo largo de un periodo de aproximadamente 3 horas.
7. Un procedimiento según una cualquiera de las reivindicaciones 1 a 6, en el que la cantidad de disolvente es tal que, cuando se disuelve en él 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina, da una concentración (antes de la cristalización) de aproximadamente 120 a 160 mg/ml.
8. Un procedimiento según la reivindicación 7, en el que la cantidad de disolvente da una concentración (antes de la cristalización) de 135 a 145 mg/ml.
9. Un procedimiento según una cualquiera de las reivindicaciones 1 a 8, que comprende hacer reaccionar 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b,f][1,4]tiazepina cristalina con ácido fumárico para dar la sal fumarato de 11-(4-[2-(2-hidroxietoxi)etil]-1-piperazinil)-dibenzo[b-f][1,4]tiazepina.
Patentes similares o relacionadas:
Tratamientos de combinación que comprenden imidazopirazinonas para el tratamiento de trastornos psiquiátricos y/o cognitivos, del 29 de Julio de 2020, de H. LUNDBECK A/S: Un compuesto de Fórmula (I) **(Ver fórmula)** en donde n es 0 o 1; q es 0 o 1; R1 se selecciona del grupo que consiste en bencilo, indanilo, indolina y heteroarilos […]
Combinación de agonistas inversos del receptor de histamina-3 con inhibidores de acetilcolinesterasa, del 24 de Junio de 2020, de SUVEN LIFE SCIENCES LIMITED: Una combinación que comprende un agonista inverso del receptor de histamina-3 y un inhibidor de acetilcolinesterasa; en donde el agonista inverso del receptor de histamina-3 […]
Amidas heterocíclicas como inhibidores de quinasa, del 3 de Junio de 2020, de GlaxoSmithKline Intellectual Property Development Limited: Un compuesto que es **(Ver fórmula)** o un tautómero del mismo o una sal del mismo.
INHIBIDORES DE TGF-ß1 Y PRODUCTORES DE ENDOGLINA PARA SU USO EN EL TRATAMIENTO DE EPIDERMÓLISIS BULLOSA, del 14 de Mayo de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): La presente invención se refiere a un fármaco inhibidor de la ruta de TGF-ß1 y estimulador de endoglina o una composición farmacéutica del mismo, […]
Inhibidores de EZH2 (potenciador del homólogo Zeste 2), del 13 de Mayo de 2020, de Glaxosmithkline Intellectual Property (No. 2) Limited: Un compuesto según la Fórmula (I) o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en la que: representa un enlace sencillo […]
INHIBIDORES DE TGF-ß1 Y PRODUCTORES DE ENDOGLINA PARA SU USO EN EL TRATAMIENTO DE EPIDERMÓLISIS BULLOSA, del 8 de Mayo de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Inhibidores de TGF-{beta}1 y productores de endoglina para su uso en el tratamiento de epidermólisis bullosa. La presente invención se refiere a un fármaco inhibidor […]
Benzazepinas fusionadas para el tratamiento de la tartamudez, del 29 de Abril de 2020, de Emalex Biosciences, Inc: Un antagonista selectivo para el receptor D1 y/o selectivo para D5 para su uso en el tratamiento de la tartamudez en un sujeto.
Compuestos de oxima como agonistas del receptor muscarínico M1 y/o M4, del 15 de Abril de 2020, de HEPTARES THERAPEUTICS LIMITED: Un compuesto de la fórmula : **(Ver fórmula)** o una sal del mismo, en donde: p es 0, 1 o 2; q es 0, 1 o 2; Y es N, O, S o C; X1 y X2 son grupos […]