COMPOSICIONES DE TICLOPIDINA DE LIBERACION MODIFICADA.
Composiciones de ticlopidina de liberación modificada multiparticulada que,
al administrar a un paciente, aporta ticlopidina de una manera bimodal, multimodal o continua. La composición de liberación modificada multiparticulada comprende un primer componente y al menos un componente subsiguiente, comprendiendo el primer componente una primera población de partículas que contienen ingrediente activo y comprendiendo al menos un componente subsiguiente una segunda población de partículas que contienen ingrediente activo. La invención también se refiere a una forma de dosificación oral sólida que contiene tal composición de liberación modificada multiparticulada y a métodos para inhibir la agregación de plaquetas, inhibir la coagulación sanguínea y reducir el riesgo de apoplejía en un paciente
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/022597.
Solicitante: ELAN CORPORATION, PLC.
Nacionalidad solicitante: Irlanda.
Dirección: TREASURY BUILDING LOWER GRAND CANAL STREET,DUBLIN 2.
Inventor/es: FANNING, NIALL, STARK, PAUL, LIVERSIDGE, GARY, DEVANE,JOHN, JENKINS,SCOTT, REKHI,GURVINDER.
Fecha de Solicitud: 9 de Junio de 2006.
Fecha de Publicación: .
Fecha de Concesión: 25 de Junio de 2010.
Clasificación Internacional de Patentes:
- A61K9/50M
Clasificación PCT:
- A61K9/14 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61K9/26 A61K 9/00 […] › Partículas distintas en una matriz soporte.
Fragmento de la descripción:
Composiciones de ticlopidina de liberación modificada.
Referencia cruzada a solicitudes relacionadas
Esta solicitud reivindica el beneficio de la Solicitud Provisional de EE.UU. Nº 60/686.931, presentada el 12 de junio de 2005, y es una continuación en parte de la Solicitud de EE.UU. Nº 11/372.857, presentada el 10 de marzo de 2006, que es una continuación en parte de la Solicitud de EE.UU. Nº 10/827.689, presentada el 19 de abril de 2004, que es una continuación de la Solicitud de EE.UU. Nº 10/354.483, presentada el 30 de enero de 2003, ahora Patente de EE.UU. Nº 6.793.936, que a su vez es una continuación de la Solicitud de EE.UU. Nº 10/331.754, presentada el 30 de diciembre de 2002, ahora Patente de EE.UU. Nº 6.902.742, que a su vez es una continuación de la Solicitud de EE.UU. Nº 09/850.425, presentada el 7 de mayo de 2001, ahora Patente de EE.UU. Nº 6.730.325, que a su vez es una continuación de la Solicitud de EE.UU. Nº 09/566.636, presentada el 8 de mayo de 2000, ahora Patente de EE.UU. Nº 6.228.398, que a su vez es una continuación de la Solicitud PCT Nº PCT/US99/25632, presentada el 1 de noviembre de 1999, que reivindica el beneficio de la Solicitud Provisional de EE.UU. Nº 60/106.726, presentada el 2 de noviembre de 1998, todas las cuales se incorporan en la presente memoria mediante referencia en su totalidad.
Campo de la invención
La presente invención se refiere a nuevas composiciones y formas de dosificación para pacientes que necesiten una terapia de inhibición de la agregación de plaquetas. En particular, la presente invención se refiere a nuevas composiciones y formas de dosificación para el aporte de ticlopidina y a métodos de tratamiento y supresión usando las mismas.
Antecedentes de la invención
La ticlopidina se conoce como (5-[(2-clorofenil)metil]-4,5,6,7-tetrahidrotieno[3,2-c]piridina). El hidrocloruro de ticlopidina, la sal de hidrocloruro de ticlopidina, tiene un peso molecular de 300,25 y es un sólido cristalino blanco. Es soluble en agua y se autotampona hasta un pH de aproximadamente 3,6. Se disuelve en metanol, es poco soluble en cloruro de metileno y etanol, ligeramente soluble en acetona e insoluble en una solución tamponadora de pH 6,3.
La fórmula estructural de la sal de hidrocloruro de ticlopidina se muestra posteriormente:
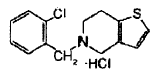
La ticlopidina pertenece a la clase tienopiridínica de compuestos y se usa como un inhibidor de la agregación de plaquetas. La ticlopidina provoca una inhibición dependiente del tiempo y la dosis de la unión plaqueta-fibrinógeno inducida por ADP así como prolongación del tiempo de sangrado. El efecto sobre la función de las plaquetas es irreversible durante la vida de la plaqueta, según se muestra tanto por la inhibición persistente de la unión a fibrinógeno después de lavar las plaquetas ex vivo como por la inhibición de la agregación de plaquetas después de la resuspensión de las plaquetas en medio tamponado. La reducción de fibrinógeno en plasma tiene los efectos de disminuir la viscosidad sanguínea y mejorar la plasticidad de los glóbulos rojos. En vista de esta actividad para prevenir la coagulación sanguínea excesiva, la ticlopidina se usa para reducir el riesgo de apoplejía, particularmente en pacientes que han tenido previamente una apoplejía o que han experimentado ataques sistémicos transitorios (TIAs o "minia-poplejías").
El hidrocloruro de ticlopidina en tabletas convencional es comercializado por Roche Laboratories (Nutley, New Jersey) bajo el nombre comercial Ticlid®. Además de 250 mg de hidrocloruro de ticlopidina, estas tabletas revestidas con película también contienen ácido cítrico, estearato magnésico, celulosa microcristalina, povidona, almidón y ácido esteárico. Las tabletas de hidrocloruro de ticlopidina, tales como Ticlid®, tienen una semivida de aproximadamente 12,6 horas y se administran oralmente dos o más veces al día.
Durante la administración oral de una sola dosis de 250 mg, el hidrocloruro de ticlopidina se absorbe rápidamente con niveles plasmáticos máximos que se producen aproximadamente 2 horas después de la dosificación y se metaboliza ampliamente. La absorción es mayor de 80%. La administración después de las comidas da como resultado un incremento de 20% en el AUC de la ticlopidina. El hidrocloruro de ticlopidina presenta farmacocinética no lineal y la depuración disminuye notablemente durante la dosificación repetida. En voluntarios ancianos la semivida aparente de la ticlopidina después de una sola dosis de 250 mg es aproximadamente 12,6 horas; con dosificación repetida con 250 mg dos veces al día, la semivida de eliminación terminal asciende hasta de 4 a 5 días y se obtienen niveles de estado estacionario de hidrocloruro de ticlopidina en plasma después de aproximadamente 14 a 21 días.
El hidrocloruro de ticlopidina se une reversiblemente (98%) a proteínas plasmáticas, principalmente a albúmina y lipoproteínas del suero. La unión a albúmina y lipoproteínas no es saturable a lo largo de un amplio intervalo de concentración. La ticlopidina también se une a glicoproteína ácida alfa-1. A las concentraciones alcanzadas con la dosis recomendada, solo 15% o menos de ticlopidina en plasma se une a esta proteína. El hidrocloruro de ticlopidina es ampliamente metabolizado por el hígado; solo cantidades traza de fármaco intacto se detectan en la orina. Después de una dosis oral de hidrocloruro de ticlopidina radiactivo administrada en solución, 60% de la radiactividad se recupera en la orina y 23% en las heces. Aproximadamente 1/3 de la dosis excretada en las heces es hidrocloruro de ticlopidina intacto, posiblemente excretado en la bilis. El hidrocloruro de ticlopidina es un componente secundario en el plasma (5%) después de una sola dosis, pero en el estado estacionario es el componente principal (15%). De aproximadamente 40% a 50% de los metabolitos radiactivos que circulan en el plasma están unidos covalentemente a proteínas plasmáticas, probablemente mediante acilación.
Se han descritos compuestos de ticlopidina en las Patentes de EE.UU. Nº 4.051.141 de Castaigne, titulada "Derivados de tieno[3,2-c]piridina"; 4.591.592 de Chowhan, titulada "Composición estabilizada con ácido de compuestos derivados de tienopiridina" y 5.520.928 de Sherman, titulada "Composición farmacéutica de hidrocloruro de ticlopidina", cada una de las cuales se incorpora por la presente memoria mediante referencia en su totalidad.
La eficacia de los compuestos farmacéuticos en la prevención y el tratamiento de estados de enfermedad depende de una variedad de factores, incluyendo la velocidad y la duración de aporte del compuesto a partir de la forma de dosificación al paciente. La combinación de velocidad de aporte y duración exhibida por una forma de dosificación dada en un paciente puede describirse como su perfil de liberación in vivo, y, dependiendo del compuesto farmacéutico administrado, se asociará con una concentración y duración del compuesto farmacéutico en el plasma sanguíneo, denominado un perfil plasmático. Como los compuestos farmacéuticos varían en sus propiedades farmacocinéticas tales como biodisponibilidad y velocidades de absorción y eliminación, el perfil de liberación y el perfil plasmático resultante se convierten en elementos importantes a considerar en el diseño de terapias farmacológicas eficaces.
Los perfiles de liberación de las formas de dosificación pueden exhibir diferentes velocidades y duraciones de liberación y pueden ser continuos o pulsátiles. Los perfiles de liberación continuos incluyen perfiles de liberación en los que uno o más compuestos farmacéuticos se liberan continuamente, a una velocidad bien constante o bien variable, y los perfiles de liberación pulsátiles incluyen perfiles de liberación en los que al menos dos cantidades discretas de uno o más compuestos farmacéuticos se liberan a diferentes velocidades y/o a lo largo de diferentes espacios de tiempo. Para cualquier compuesto farmacéutico dado o combinación de tales compuestos, el perfil de liberación para una forma de dosificación dada da lugar a un perfil plasmático asociado en un paciente. De forma similar a las variables aplicadas al perfil de liberación, el perfil plasmático asociado en un paciente puede exhibir niveles de concentración en plasma sanguíneo constantes o variables de los compuestos farmacéuticos en la forma de dosificación a lo largo de la duración de la acción y puede ser continuo o pulsátil. Los perfiles plasmáticos continuos incluyen...
Reivindicaciones:
1. Una composición farmacéutica que comprende un primer componente de partículas que contienen ingrediente activo y al menos un componente subsiguiente de partículas que contienen ingrediente activo, en la que al menos uno de dichos componentes comprende ticlopidina y al menos uno de dichos componentes comprende además un revestimiento de liberación modificada, un material de matriz de liberación modificada o ambos, de modo que la composición, después del aporte oral a un sujeto, aporta el ingrediente activo de una manera bimodal o multimodal.
2. La composición de acuerdo con la reivindicación 1, en la que cada componente comprende partículas que contienen ticlopidina.
3. La composición de acuerdo con la reivindicación 1, en la que la composición comprende un primer componente de partículas que contienen ticlopidina y un componente subsiguiente de partículas que contienen ticlopidina.
4. La composición de acuerdo con la reivindicación 3, en la que el primer componente comprende un componente de liberación inmediata y el segundo componente comprende un componente de liberación modificada.
5. La composición de acuerdo con la reivindicación 1, en la que las partículas que contienen ingrediente activo son erosionables.
6. La composición de acuerdo con la reivindicación 1, en la que al menos uno de dichos componentes comprende además un revestimiento de liberación modificada.
7. La composición de acuerdo con la reivindicación 1, en la que al menos uno de dichos componentes comprende además un material de matriz de liberación modificada.
8. La composición de acuerdo con la reivindicación 7, en la que dicho material de matriz de liberación modificada se selecciona del grupo que consiste en polímeros hidrófilos, polímeros hidrófobos, polímeros naturales, polímeros sintéticos y mezclas de los mismos.
9. La composición de acuerdo con la reivindicación 8, en la que la ticlopidina se libera al ambiente circundante mediante erosión.
10. La composición de acuerdo con la reivindicación 9, en la que dicha composición comprende además un potenciador.
11. La composición de acuerdo con la reivindicación 8, que comprende de aproximadamente 0,1 mg a aproximadamente 500 mg de ticlopidina.
12. Una composición farmacéutica que comprende un primer componente de partículas que contienen ingrediente activo y al menos un componente subsiguiente de partículas que contienen ingrediente activo, en la que al menos uno de dichos componentes comprende ticlopidina y al menos uno de dichos componentes comprende además un revestimiento de liberación modificada, un material de matriz de liberación modificada o ambos, de modo que la composición, después del aporte oral a un sujeto, aporta el ingrediente activo de una manera continua.
13. La composición de acuerdo con la reivindicación 12, en la que cada componente comprende partículas que contienen ticlopidina.
14. La composición de acuerdo con la reivindicación 12, en donde la composición comprende un primer componente de partículas que contienen ticlopidina y un componente subsiguiente de partículas que contienen ticlopidina.
15. La composición de acuerdo con la reivindicación 14, en la que el primer componente comprende un componente de liberación inmediata y el segundo componente comprende un componente de liberación modificada.
16. La composición de acuerdo con la reivindicación 12, en la que las partículas que contienen ingrediente activo son erosionables.
17. La composición de acuerdo con la reivindicación 12, en la que al menos uno de dichos componentes comprende además un revestimiento de liberación modificada.
18. La composición de acuerdo con la reivindicación 12, en la que al menos uno de dichos componentes comprende además un material de matriz de liberación modificada.
19. La composición de acuerdo con la reivindicación 18, en la dicho material de matriz de liberación modificada se selecciona de grupo que consiste en polímeros hidrófilos, polímeros hidrófobos, polímeros naturales, polímeros sintéticos y mezclas de los mismos.
20. La composición de acuerdo con la reivindicación 19, en la que la ticlopidina se libera al ambiente circundante mediante erosión.
21. La composición de acuerdo con la reivindicación 20, en donde dicha composición comprende además un potenciador.
22. La composición de acuerdo con la reivindicación 19, que comprende de aproximadamente 0,1 mg a aproximadamente 500 mg de ticlopidina.
23. Una forma de dosificación que comprende la composición de acuerdo con la reivindicación 1.
24. La forma de dosificación de acuerdo con la reivindicación 23, que comprende una combinación de partículas que contienen ingrediente activo contenidas dentro de una cápsula de gelatina dura o gelatina blanda.
25. La forma de dosificación de acuerdo con la reivindicación 24, en la que las partículas que contienen ingrediente activo están en la forma de minitabletas y la cápsula contiene una mezcla de dichas minitabletas.
26. La forma de dosificación de acuerdo con la reivindicación 25, en forma de tableta.
27. La forma de dosificación de acuerdo con la reivindicación 26, en la que las partículas que contienen ticlopidina se proporcionan en una forma de dosificación que se disuelve rápidamente.
28. La forma de dosificación de acuerdo con la reivindicación 26, en la que la tableta es una tableta de fusión rápida.
29. Una forma de dosificación que comprende la composición de acuerdo con la reivindicación 12.
30. La forma de dosificación de acuerdo con la reivindicación 29, que comprende una combinación de partículas que contienen ingrediente activo contenidas dentro de una cápsula de gelatina dura o gelatina blanda.
31. La forma de dosificación de acuerdo con la reivindicación 30, en la que las partículas que contienen ingrediente activo están en la forma de minitabletas y la cápsula contiene una mezcla de dichas minitabletas.
32. La forma de dosificación de acuerdo con la reivindicación 31, en forma de tableta.
33. La forma de dosificación de acuerdo con la reivindicación 32, en la que las partículas que contienen ticlopidina se proporcionan en una forma de dosificación que se disuelve rápidamente.
34. La forma de dosificación de acuerdo con la reivindicación 32, en la que la tableta es una tableta de fusión rápida.
35. Uso de una composición farmacéutica según cualquiera de las reivindicaciones 1-11, para la preparación de un medicamento para inhibir la agregación de plaquetas.
36. Uso de una composición farmacéutica según cualquiera de las reivindicaciones 1-11, para la preparación de un medicamento para inhibir la coagulación sanguínea.
37. Uso de una composición farmacéutica según cualquiera de las reivindicaciones 1-11, para la preparación de un medicamento reducir el riesgo de apoplejía.
38. Uso de una composición farmacéutica según cualquiera de las reivindicaciones 12-22, para la preparación de un medicamento para inhibir la agregación de plaquetas.
39. Uso de una composición farmacéutica según cualquiera de las reivindicaciones 12-22, para la preparación de un medicamento para inhibir la coagulación sanguínea.
40. Uso de una composición farmacéutica según cualquiera de las reivindicaciones 12-22, para la preparación de un medicamento reducir el riesgo de apoplejía.
41. La composición de acuerdo con la reivindicación 1, en la que el revestimiento de liberación modificada comprende un revestimiento de polímero dependiente del pH para liberar un impulso del ingrediente activo en dicho paciente después de un retardo temporal de aproximadamente 6 a aproximadamente 12 horas después de la administración de dicha composición a dicho paciente.
42. La composición de acuerdo con la reivindicación 41, en la que dicho revestimiento de polímero comprende copolímeros de metacrilato.
43. La composición de acuerdo con la reivindicación 41, en la que el revestimiento de polímero comprende polímero Eudragit® en una relación suficiente para alcanzar un impulso del ingrediente activo después de un retardo temporal de al menos aproximadamente 6 horas.
Patentes similares o relacionadas:
FORMULACIÓN DE LIBERACIÓN PROLONGADA DE PALIPERIDONA, del 14 de Febrero de 2012, de TEVA PHARMACEUTICAL INDUSTRIES LTD.: Comprimidos de liberación prolongada de paliperidona en forma de un comprimido de incrustación que comprende: (a) un núcleo de incrustación que comprende paliperidona […]
COMPOSICIÓN DE LIBERACIÓN POR IMPULSO TEMPORIZADO, del 9 de Febrero de 2012, de SUN PHARMA ADVANCED RESEARCH COMPANY LIMITED: Una composición de liberación por impulso temporizado que comprende: a. una composición de núcleo que comprende un agente terapéuticamente activo, un agente […]
 COMPOSICIONES FARMACEUTICAS PARA EL SUMINISTRO COORDINADO DE NSAID, del 13 de Diciembre de 2010, de POZEN, INC.: Comprimido multicapa apto para su administración oral a un paciente, que comprende: (a) una capa externa de un inhibidor ácido, seleccionado de entre un inhibidor […]
COMPOSICIONES FARMACEUTICAS PARA EL SUMINISTRO COORDINADO DE NSAID, del 13 de Diciembre de 2010, de POZEN, INC.: Comprimido multicapa apto para su administración oral a un paciente, que comprende: (a) una capa externa de un inhibidor ácido, seleccionado de entre un inhibidor […]
 COMPOSICIONES FARMACEUTICAS DE LIBERACION CONTROLADA ESTABLES QUE CONTIENEN FENOFIBRATO Y PRAVASTATINA, del 16 de Julio de 2010, de GALEPHAR M/F: Composición farmacéutica que comprende cantidades efectivas de:
(a)pravastatina y/o una sal farmacéuticamente aceptable de la misma
(b)fenofibrato; y
(c)bicarbonato […]
COMPOSICIONES FARMACEUTICAS DE LIBERACION CONTROLADA ESTABLES QUE CONTIENEN FENOFIBRATO Y PRAVASTATINA, del 16 de Julio de 2010, de GALEPHAR M/F: Composición farmacéutica que comprende cantidades efectivas de:
(a)pravastatina y/o una sal farmacéuticamente aceptable de la misma
(b)fenofibrato; y
(c)bicarbonato […]
COMPOSICIONES DE LIBERACION CONTROLADA Y NANOPARTICULADAS QUE COMPRENDEN DERIVADOS DE PROSTAGLANDINA, del 8 de Julio de 2010, de ELAN PHARMA INTERNATIONAL LIMITED: Composiciones de liberación controlada y nanopartículadas que comprenden derivados de prostaglandina preferentemente limaprost o una sal o derivado […]
 PRODUCTOS RESISTENTES A LA MANIPULACION INDEBIDA PARA EL APORTE DE OPIOIDES, del 22 de Junio de 2010, de EURO-CELTIQUE S.A.: Producto farmacéutico que comprende:
a)una pluralidad de partículas extrusionadas, comprendiendo cada una de las partículas un antagonista opioide […]
PRODUCTOS RESISTENTES A LA MANIPULACION INDEBIDA PARA EL APORTE DE OPIOIDES, del 22 de Junio de 2010, de EURO-CELTIQUE S.A.: Producto farmacéutico que comprende:
a)una pluralidad de partículas extrusionadas, comprendiendo cada una de las partículas un antagonista opioide […]
 FORMA DE DOSIFICACION ORAL QUE COMPRENDE UN AGENTE TERAPEUTICO Y UN AGENTE DE EFECTO ADVERSO, del 28 de Abril de 2010, de EURO-CELTIQUE S.A.: Forma de dosificación oral que comprende una primera composición y una segunda composición, en la que la primera composición comprende una cantidad eficaz de un agente […]
FORMA DE DOSIFICACION ORAL QUE COMPRENDE UN AGENTE TERAPEUTICO Y UN AGENTE DE EFECTO ADVERSO, del 28 de Abril de 2010, de EURO-CELTIQUE S.A.: Forma de dosificación oral que comprende una primera composición y una segunda composición, en la que la primera composición comprende una cantidad eficaz de un agente […]
Métodos y composiciones para la administración oral de proteínas, del 22 de Julio de 2020, de Entera Bio Ltd: Una única composición farmacéutica oral que comprende una proteína que tiene un peso molecular de hasta 100.000 Daltons, siendo dicha proteína PTH; […]