17ALFA-CIANOMETIL-17BETA-HIDROXI-ESTRA-4,9-DIEN-3-ONA DE ALTO GRADO DE PUREZA Y PROCESO PARA LA SINTESIS DEL MISMO.
Proceso para la síntesis de 17a-cianometil-17ß-hidroxi-estra-4,9-dien-3-ona (además de la formación de dienogest), de fórmula (I)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/HU2006/000091.
Solicitante: RICHTER GEDEON NYRT.
Nacionalidad solicitante: Hungría.
Dirección: GYOMROI UT 19-21,1103 BUDAPEST.
Inventor/es: MAHO, SANDOR, DANCSI,LAJOSNE, ARANYI,ANTAL, HORVATH,JANOS.
Fecha de Publicación: .
Fecha Concesión Europea: 9 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- C07J41/00C70
Clasificación PCT:
- C07J41/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07J ESTEROIDES (seco-steroides C07C). › Esteroides normales que contienen uno o más átomos de nitrógeno que no pertenecen a un heterociclo.
Fragmento de la descripción:
17a-cianometil-17ß-hidroxi-estra-4,9-dien-3-ona de alto grado de pureza y proceso para la síntesis del mismo.
La invención se refiere a un proceso para la síntesis de 17a-cianometil-17ß-hidroxi-estra-4,9-dien-3-ona de alto grado de pureza (además de la formación de dienogest) de fórmula (I)
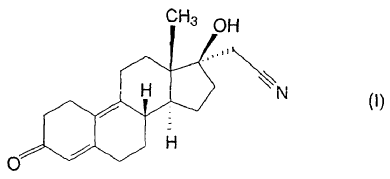
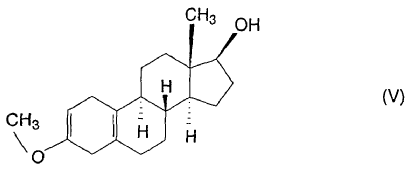
a partir del 3-metoxi-17-hidroxi-estra-2,5(10)-dieno de fórmula (V).
Este compuesto se emplea como ingrediente activo en composiciones farmacéuticas anticonceptivas como componente progestágeno, en la terapia de reemplazo hormonal, así como también en composiciones contra la endometriosis.
En esta descripción, dienogest de alto grado de pureza significa que la cantidad total de impurezas es inferior al 0,1%, mientras que la cantidad de 4-bromo-dienogest está por debajo del límite de detección (0,02%).
Los procedimientos conocidos para la síntesis de diogenest de fórmula (I) parten de intermedios de la síntesis total de estrona. La diferencia principal entre los procedimientos conocidos es que los dos enlaces dobles característicos para el compuesto deseado están ya incluidos en el material inicial o no lo están y, en este último caso, se forman en el último paso de la síntesis.
De acuerdo con la solicitud de patente alemana DD 132,497 se hace reaccionar 3-metoxi-17ß-espiro-1',2'-oxiran-estra-2,5(10)-dieno con un cianuro de metal alcalino para dar un derivado de 17a- cianometil-17ß-hidroxi-3-enol éter. A continuación, el compuesto así obtenido se hidroliza, se broma y se desbroma para suministrar el dienogest de fórmula (I) con un rendimiento del 32%. La pureza del dienogest obtenido se caracteriza por el punto de fusión (204-214ºC) y la rotación óptica ([a]25D = -290º, piridina, c = 0,5%). De acuerdo con el método descrito en la solicitud de patente DD 80,023 se puede sintetizar el 3-metoxi-17ß-espiro-1',2'-oxiran-estra-2,5(10)-dieno utilizado como material inicial haciendo reaccionar metiluro de dimetilsulfonio y el derivado 17-oxo obtenido mediante oxidación de Oppenauer del grupo 17-hidroxi del 3-metoxi-17-hidroxi-estra-2,5(10)-dieno de la fórmula (V), éste último sintetizado por métodos conocidos.
El proceso descrito en la solicitud de patente alemana DD 160,418 es una modificación del proceso anterior, donde primero el compuesto de fórmula (V) se transforma en 3,3-dimetoxi-17-hidroxi-estra-5(10)-eno, el grupo 17-hidroxi se oxida con clorocromato de piridinio, en lugar de oxidación de Oppenauer, a continuación se forma 17ß-espiro-1',2'-oxirano con metiluro de dimetilsulfonio y éste último se hace reaccionar con un cianuro de metal alcalino para obtener 3,3-dimetoxi-17a-cianometil-17ß-hidroxi-estra-5(10)-eno. Este compuesto se hidroliza con ácido sulfúrico para dar 17a-cianometil-17ß-hidroxi-estra-5(10)-eno, a partir del cual se obtiene, después de bromación y subsiguiente desbromación, el dienogest con un 48% de rendimiento. El rendimiento total del proceso es del 24%.
La solicitud de patente alemana DD 296,495 describe una síntesis en un solo recipiente, de acuerdo con la cual primero el ceto esteroide inicial -la posición 3 del cual contiene un grupo hidroxi o un grupo oxo protegido con uno o más grupos alcoxi- se hace reaccionar con un cianometil-litio formado in situ en la reacción de alquil-litios o dialquilamidas de litio y acetonitrilo en un disolvente orgánico a baja temperatura. De esta manera se forma un grupo 17-hidroxi y un grupo 17-cianometilo a partir del grupo 17-oxo, la mezcla de reacción obtenida se trata con agua y el derivado de 17-hidroxi-17-cianometilo obtenido se aísla o se transforma en dienogest mediante hidrólisis ácida directa. El rendimiento del producto final es del 82%, comenzando a partir de 3,3-dimetoxi-estra-5(10),9(11)-dien-17-ona, mientras que usando el derivado 3,3-(1,3-propilendioxi)estra-5(10),9(11)-dieno como material inicial el rendimiento es del 80%. La pureza del producto se caracteriza por el punto de fusión: 208-211,5ºC. La síntesis consiste en 6 pasos, incluyendo la preparación del derivado 17-oxo utilizado como material inicial.
De acuerdo con la solicitud de patente EP 0776904, primero se transforma una 3,3-(2,2-dimetilpropilen-1,3-dioxi)-4,5-seco-estra-9-eno-5,17-diona en estra-4,9-dieno-3,17-diona y ésta última en 3,3-etilendioxi-estra-5(10),9(11)-dien-17-ona. Después de reaccionar con yoduro de dimetilsulfonio, se obtiene un derivado de 17ß-espiro-1',2'-oxirano, el cual se hace reaccionar con cianuro de potasio para dar 17a-cianometil-17ß-hidroxi-estra-5(10),9(11)-dien-3-etilen cetal. El grupo cetal de este compuesto se hidroliza con ácido clorhídrico para dar el producto final de dienogest con más de un 98% de pureza.
De acuerdo con los procesos que comienzan a partir del 3-metoxi-17-hidroxi-estra-2,5(10)-dieno de fórmula (V) citado, primero se forma un derivado de 3,3-dialcoxi-cetal-5(10)-eno, luego este último se oxida a un compuesto ceto, el cual se hace reaccionar con un metiluro de dimetilsulfonio para dar un derivado de 17ß-espiro-1',2'-oxirano, y éste se transforma en un derivado de 17a-cianometil-17ß-hidroxi. El compuesto obtenido se hidroliza con ácido, luego se broma y se desbroma, para dar el dienogest de fórmula (I) en 6 pasos.
De acuerdo con el otro proceso que comienza también a partir del compuesto de fórmula (V), después de la oxidación del grupo hidroxilo en la posición 17 mediante una oxidación de Oppenauer, se sintetiza el derivado de 17ß-espiro-1',2'-oxirano, el cual se hace reaccionar con un cianuro de metal alcalino, luego se hidroliza, se broma y se desbroma el 3-enol éter obtenido, para dar el dienogest en 5 pasos.
De acuerdo con el otro método mencionado anteriormente, se hace reaccionar el 3,3-etilendioxi-estra-5(10),9(11)-dien-17-ona directamente con cianometil-litio o primero se forma un espiro-oxirano y se abre el anillo oxirano con un cianuro alcalino, para dar el derivado de 17a-cianometil-17ß-hidroxi, el cual se hidroliza para dar el producto final de fórmula (I).
Las síntesis de los derivados de 17ß-espiro-1',2'-oxirano que comienzan a partir de compuestos 17-ceto y derivados de dimetilsulfonio de acuerdo con los métodos descritos en las solicitudes de patente DD 132,497 y EP 0,776,904 son costosos y no gratos desde el punto de vista ambiental. El uso de un cianuro alcalino para la apertura del anillo oxirano requiere seguir estrictamente las instrucciones de seguridad y, después, el desarrollo de la mezcla de reacción provoca problemas ambientales.
En las solicitudes de patente anteriormente citadas, la calidad del producto sólo se caracteriza por el punto de fusión o, como mucho, por el contenido de sustancia. Los requisitos de la farmacopea más reciente especifican diversos métodos de examen para la cantidad de sustancia e impurezas, tales como cromatografía líquida y de capa delgada, así como también para determinar y limitar la cantidad y el número de impurezas.
K. Schubert y col. describen un proceso para la preparación de dienogest donde se transforma el 3-metoxi-17-hidroxi-estra-2,5(10)-dieno con isopropilato de aluminio en 3-metoxi-estra-2,5(10)-dien-17-ona, que posteriormente se hace reaccionar con metiluro de dimetilsulfonio, cianuro de sodio, se hidroliza con ácido sulfúrico y se trata con bromuro de piridinio o bromhídrico para proporcionar dienogest ("Synthesis, effects and metabolism of the progestagen and potential interceotive dienogest", Studies in Organic Chemistry (Amsterdam), 20 (Nat. Prod.Chem.), 143-158).
Nuestro objetivo era eliminar las desventajas mencionadas anteriormente de los procedimientos conocidos y proporcionar una síntesis más económica y respetuosa con el medio ambiente, que se pudiese llevar a cabo a escala industrial, preferiblemente usando un intermedio de la síntesis total de estrona, el 3-metoxi-17-hidroxi-estra-2,5(10)-dieno de fórmula (V) como material inicial.
Nuestro otro objetivo era sintetizar un producto de alto grado de pureza, en el cual la cantidad total de impurezas fuera inferior al 0,1%, mientras que la cantidad de 4-bromo-dienogest estuviera por debajo del límite de detección (0,02%) y que, en consecuencia, fuera apropiado para producir diferentes formulaciones de fármacos.
Sorprendentemente se encontró que empleando el compuesto de fórmula (V) como material inicial en la síntesis del compuesto de fórmula (III) no...
Reivindicaciones:
1. Proceso para la síntesis de 17a-cianometil-17ß-hidroxi-estra-4,9-dien-3-ona (además de la formación de dienogest), de fórmula (I)
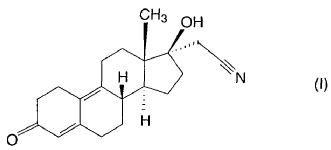
a partir de 3-metoxi-17-hidroxi-estra-2,5(10)-dieno de fórmula (V),
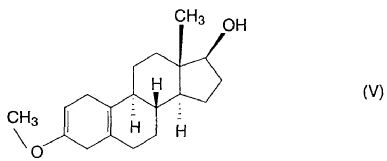
caracterizado porque
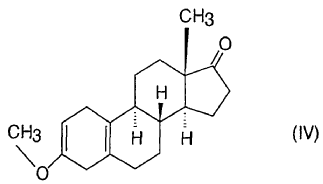
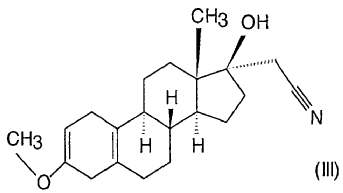
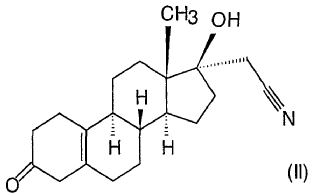
2. Proceso según la reivindicación 1, caracterizado porque se lleva a cabo la oxidación del paso i) en tolueno en presencia de 20-25 equivalentes de ciclohexanona, entre 100 y 120ºC.
3. Proceso según las reivindicaciones anteriores, caracterizado porque se prepara el reactivo de cianometil-litio del paso ii) in situ a partir de hexil-litio y acetonitrilo.
4. Proceso según las reivindicaciones anteriores, caracterizado porque se lleva a cabo la reacción de cianometilación del paso ii) a entre 0 y -30ºC.
5. Proceso según las reivindicaciones anteriores, caracterizado porque se lleva a cabo la reacción de cianometilación del paso ii) a entre -10 y -20ºC.
6. Proceso según las reivindicaciones anteriores, caracterizado porque se emplean 2 equivalentes de reactivo de cianometil-litio en el paso ii).
7. Proceso según las reivindicaciones anteriores, caracterizado porque se lleva a cabo el tratamiento ácido del paso iii) con un ácido orgánico dibásico o tribásico en tetrahidrofurano.
8. Proceso según las reivindicaciones anteriores, caracterizado porque se lleva a cabo el tratamiento ácido del paso iii) con 2 equivalentes de dihidrato de ácido oxálico.
9. Proceso según las reivindicaciones anteriores, caracterizado porque se hace reaccionar el compuesto de fórmula (II) con 1,05 equivalentes de tribromuro de piridinio en el paso iv).
10. Proceso según las reivindicaciones anteriores, caracterizado porque se hace reaccionar el compuesto de fórmula (II) con tribromuro de piridinio a entre 0 y 60ºC en el paso iv).
11. Proceso según las reivindicaciones anteriores, caracterizado porque se hace reaccionar el compuesto de fórmula (II) con tribromuro de piridinio a entre 25 y 50ºC.
12. Proceso según las reivindicaciones anteriores, caracterizado porque se purifica el dienogest de fórmula (I) mediante HPLC usando gel de sílice como adsorbente.
13. Proceso según las reivindicaciones anteriores, caracterizado porque se purifica el dienogest de fórmula (I) mediante HPLC usando las siguientes mezclas de disolventes como eluyentes: 70:30 diclorometano/acetato de etilo o 80:20 diclorometano/metil tert-butil éter o 90:10 diclorometano/acetona.
14. Proceso según las reivindicaciones anteriores, caracterizado porque la recristalización del dienogest de fórmula (I) se obtiene mediante HPLC preparativa a partir de acetato de etilo, acetona, metil tert-butil éter, diisopropil éter, acetonitrilo, metanol, etanol o una mezcla acuosa de proporciones diferentes de estos disolventes.
Patentes similares o relacionadas:
Derivados de ácidos biliares como agonistas FXR/TGR5, del 1 de Julio de 2020, de ENANTA PHARMACEUTICALS, INC: Un compuesto representado por la Formula I, o una sal o ester aceptable farmaceuticamente de este: **(Ver fórmula)** en donde: Ra es hidrogeno o -C1-C8 alquilo […]
Composiciones y métodos para el tratamiento de trastornos del SNC, del 26 de Febrero de 2020, de Sage Therapeutics, Inc: Compuesto de fórmula (II): **(Ver fórmula)** o una sal farmacéuticamente aceptable de los mismos. en la que: el anillo A es arilo […]
Derivados de colano para su uso en el tratamiento y/o prevención de enfermedades mediadas por FXR y TGR5/GPBAR1, del 4 de Diciembre de 2019, de Bar Pharmaceuticals S.r.l: Un compuesto seleccionado del grupo que consiste en:**Fórmula**
Materiales de hidrogel que incorporan un compuesto de elución de ceragenina, del 22 de Octubre de 2019, de BRIGHAM YOUNG UNIVERSITY: Un dispositivo médico que comprende un material de hidrogel de elución de ceragenina, el dispositivo médico comprendiendo un polímero de […]
Formas de sales polimórficas y amorfas de dilactato de escualamina, del 15 de Octubre de 2019, de Enterin, Inc: Forma amorfa de la sal de dilactato de 38-(N-[3-aminopropil]-1,4-butanodiamina)-7a,24R-dihidroxi-5a-colestano-24- sulfato, donde un patrón de difracción del […]
Compuestos anfifílicos con propiedades neuroprotectoras, del 2 de Octubre de 2019, de Ustav Organicke Chemie a Biochemie AV CR, v.v.i: Compuesto anfifílico, seleccionado de: 3-sulfato de piridinio(3R,5R,8S,9S,10 S,13S,14S)-10,13-dimetilhexadecahidro-1H-ciclopenta[a]fenantren-3- […]
3alfa-etinil, 3beta-hidroxi-5alfa-pregnan-20-oxima para usar en el tratamiento de trastornos del SNC, del 2 de Octubre de 2019, de Umecrine Cognition AB: 3α-etinil, 3β-hidroxi, 5α-pregnan-20-oxima o una de sus sales farmacéuticamente aceptables. Una formulación farmacéutica que comprende un compuesto como […]
 Inhibidores de SHIP y uso de los mismos, del 31 de Julio de 2019, de THE RESEARCH FOUNDATION OF THE STATE UNIVERSITY OF NEW YORK: Una composición farmacéutica que comprende:
un compuesto inhibidor de SHIP de fórmula (I), o una sal farmacéuticamente aceptable del […]
Inhibidores de SHIP y uso de los mismos, del 31 de Julio de 2019, de THE RESEARCH FOUNDATION OF THE STATE UNIVERSITY OF NEW YORK: Una composición farmacéutica que comprende:
un compuesto inhibidor de SHIP de fórmula (I), o una sal farmacéuticamente aceptable del […]