PROCESO PARA AISLAR LOS ENANTIOMEROS DE LA CETAMINA.
Un proceso de obtención de los enantiómeros de la cetamina que se caracteriza por comprender los pasos que consisten en:
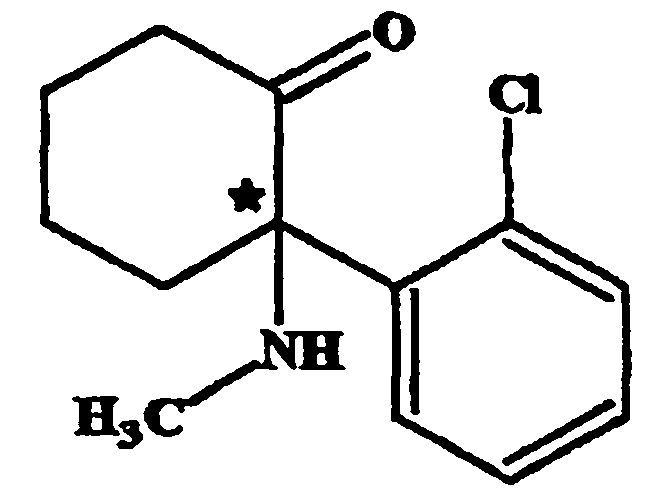
(a) Preparar una solución de base cetamina racémica en un disolvente miscible con agua seleccionado del grupo que consiste en alcoholes C1-C6, tetrahidrofurano y acetona o sus mezclas, en una concentración que varía de 0, 1 M a 1, 0 M de cetamina; (b) Agregar a la mezcla/solución preparada en el paso (a), una forma enantiomérica de un ácido tartárico en una cantidad que varía de 0, 25 a 0, 80 equivalentes molares con relación a la base cetamina, y agua en una cantidad que varía de 5% a 20% (v/v) en relación con el disolvente miscible con agua, y dejar el sistema en reflujo y en agitación a una temperatura de 50 a 60°C, hasta la disolución completa de los sólidos; (c) Apagar el calentamiento y mantener la agitación hasta que se complete la precipitación del tartrato de cetamina; (d) Separar la sal diastereoisomérica precipitada formada en (c) por medio de filtración, centrifugación u otro procedimiento usual de separación de sólido-líquido; (e) Disolver en agua la sal diastereoisomérica del enantiómero de cetamina obtenido en (d) para obtener una concentración que no sea superior al 20% de dicha sal; (f) Agregar a la solución obtenida en (e) una solución alcalina, de modo de ajustar el pH final en el rango de 9 a 12 para precipitar el enantiómero de la cetamina; (g) Separar la base libre del enantiómero de cetamina precipitado en (f) por medio de filtración o centrifugación; (h) Recristalizar el producto obtenido en (g) en un disolvente seleccionado del grupo que consiste en alcoholes C1-C6, cicloalcanos C5-C12, alcanos C5-C12, acetona, mezclas de éstos o mezclas de cada uno con agua, para obtener el enantiómero en un exceso enantiomérico superior al 99%; (i) Evaporar el disolvente remanente del paso (d) para separar el otro diastereoisómero de la cetamina; (j) Disolver el sólido resultante del paso (j) en cantidad suficiente de solución de ácido clorhídrico0, 1 N a 3, 0 N y repetir los pasos (e) a (h), para obtener el otro enantiómero de la cetamina en un exceso enantiomérico superior al 99%.
Tipo: Resumen de patente/invención.
Solicitante: CRISTALIA PRODUTOS QUIMICOS E FARMACEUTICOS LTDA.
Nacionalidad solicitante: Brasil.
Dirección: PAOLETTI AV., 363, ITAPIRA,CEP-13970-000 SAO PAULO, SP.
Inventor/es: TORRES RUSSO,VALTER,FREIRE, MANNOCHIO DE SOUZA RUSSO,ELISA.
Fecha de Publicación: .
Fecha Concesión Europea: 14 de Noviembre de 2007.
Clasificación PCT:
- A61P23/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Anestésicos.
- A61P25/04 A61P […] › A61P 25/00 Medicamentos para el tratamiento de trastornos del sistema nervioso. › Analgésicos que actúan sobre el sistema nervioso central, p.ej. opioides.
- C07B57/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07B PROCESOS GENERALES DE QUIMICA ORGANICA; SUS APARATOS (preparación de ésteres de ácidos carboxílicos por telomerización C07C 67/47; procesos para la preparación de compuestos macromoleculares, p.ej. telomerzación C08F, C08G). › Separación de compuestos ópticamente activos.
- C07C221/00 C07 […] › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › Preparación de compuestos que contienen grupos amino y átomos de oxígeno, unidos por enlaces dobles, unidos a la misma estructura carbonada.
Patentes similares o relacionadas:
Preparación sólida que contiene colorante, del 29 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Preparación farmacéutica sólida que comprende monobencenosulfonato de ácido [(1R,5S,6S)-6-(aminometil)-3- etilbiciclo[3.2.0]hept-3-en-6-il]acético […]
Derivados de bencimidazol como inhibidores Nav 1.7 (subunidad alfa del canal de sodio, dependiente del voltaje, tipo IX (SCN9A)) para tratar el dolor, la disuria y la esclerosis múltiple, del 22 de Julio de 2020, de Sumitomo Dainippon Pharma Co., Ltd: Un compuesto de fórmula (I): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, donde R1a, R1b, R1c, y R1d son independientemente hidrógeno, […]
Regímenes de dosificación de buprenorfina, del 1 de Julio de 2020, de Indivior UK Limited: Buprenorfina para su uso en un método para tratar el trastorno por uso de opioides en un ser humano que lo necesite, que comprende las etapas […]
Compuesto de tetrahidrooxepinopiridina, del 17 de Junio de 2020, de ASTELLAS PHARMA INC.: Compuesto de fórmula (I) o sal del mismo: **(Ver fórmula)** (en la fórmula, R1 es H o alquilo inferior, R2 es H o CN, uno cualquiera […]
Compuestos piperidínicos con actividad multimodal contra el dolor, del 27 de Mayo de 2020, de ESTEVE PHARMACEUTICALS, S.A: Compuesto de acuerdo con la fórmula V, **(Ver fórmula)** en la que m es 1 o 2, n es 0 o 1; R1 es -COR6, -CONR8R9, -COCR6R7NR8R9, […]
Derivado de amina cíclica y utilización farmacéutica del mismo, del 20 de Mayo de 2020, de TORAY INDUSTRIES, INC.: Derivado de amina cíclica representado por una fórmula general (I) o sal aceptable farmacológicamente del mismo: **(Ver fórmula)** en la que n representa 1, […]
Derivados de diarilmetilideno piperidina y su uso como agonistas del receptor opioide delta, del 29 de Abril de 2020, de Pharmnovo AB: Compuesto de la fórmula I **(Ver fórmula)**
Formulación farmacéutica acuosa de tapentadol para administración por vía oral, del 22 de Abril de 2020, de GRUNENTHAL GMBH: Una composición farmacéutica acuosa que contiene tapentadol o una sal fisiológicamente aceptable del mismo y que está adaptada para administración […]