PROCEDIMIENTO PARA LA PREPARACION DE ZIPRASIDONA.
Procedimiento para la preparación de ziprasidona (I) o una sal farmacéuticamente aceptable de la misma,
**(Ver fórmula)** que comprende
a) reducir un compuesto (III) **(Ver fórmula)** mediante tratamiento con un borohidruro de metal alcalino para producir un compuesto (V) **(Ver fórmula)**
b) reducir el compuesto (V) para producir un compuesto (II) **(Ver fórmula)**
c) hacer reaccionar el compuesto (II) con un compuesto (IV) **(Ver fórmula)**
d) y, si se desea, convertir el compuesto (I) en una sal farmacéuticamente aceptable del mismo
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06023525.
Solicitante: DIPHARMA S.P.A.
LUNDBECK PHARMACEUTICALS ITALY S.P.A.
Nacionalidad solicitante: Italia.
Dirección: VIA XXIV MAGGIO 40,33036 MERETO DI TOMBA (UDINE).
Inventor/es: SBROGIO, FEDERICO, CASTELLIN,ANDREA, ZANON,JACOPO, MARTINI,OSCAR, CIARDELLA,FRANCESCO, GREGORI,LUCA.
Fecha de Publicación: .
Fecha Solicitud PCT: 13 de Noviembre de 2006.
Fecha Concesión Europea: 28 de Octubre de 2009.
Clasificación Internacional de Patentes:
- C07D209/34 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 209/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros, condensados con otros ciclos, con solamente un átomo de nitrógeno como heteroátomo. › en posición 2.
- C07D417/12 C07D […] › C07D 417/00 Compuestos heterocíclicos que contienen dos o más heterociclos, teniendo al menos un ciclo átomos de nitrógeno y azufre como únicos heteroátomos del ciclo, no previstos por el C07D 415/00. › unidos por una cadena que contiene heteroátomos como enlaces de cadena.
Clasificación PCT:
- C07D209/34 C07D 209/00 […] › en posición 2.
- C07D417/12 C07D 417/00 […] › unidos por una cadena que contiene heteroátomos como enlaces de cadena.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Procedimiento para la preparación de ziprasidona.
Campo de la invención
La presente invención se refiere a un procedimiento novedoso para la preparación de ziprasidona, 5-(2-(4-benzo[d]isotiazol-3-il)piperazin-1-il)etil)-6-cloro-1,3-dihidro-2H-indol-2-ona, y a un producto intermedio novedoso útil para su preparación.
Antecedentes tecnológicos
La ziprasidona, de fórmula (I)

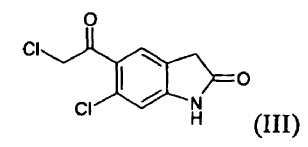
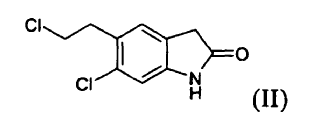
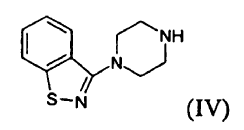
es un fármaco antipsicótico conocido a partir de los documentos US 4.831.031 y WO 03/070246. El procedimiento para la preparación de ziprasidona dado a conocer en el documento US 4.831.031 comprende la formación de un compuesto (II) mediante la reducción de un compuesto (III) y la posterior reacción con un compuesto (IV), según el siguiente esquema:
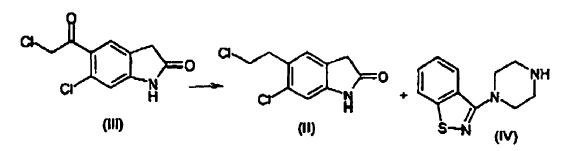
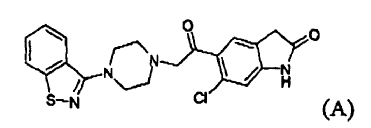
La reducción de un compuesto (III) para formar un compuesto (II) se lleva a cabo mediante reacción con ácido trifluoroacético y trietilsilano, que son muy caros, afectando por tanto de manera notable al coste del producto. La clorocetona (III) es un irritante para los ojos y su presencia, incluso en cantidades traza, como impureza en el producto intermedio (II) y en el producto final, es un problema para los operarios. Además, dicha impureza reacciona con un compuesto (IV) para formar otra impureza (A), 5-(2-(4-benzo[d]isotiazol-3-il)piperazin-1-il)acetil)-6-cloro-1,3-dihidro-2H-indol-2-ona, que está presente en el producto final y es difícil de eliminar.
Por tanto, las desventajas del procedimiento según el documento US 4.831.031 son evidentes. Por tanto, existe la necesidad de un procedimiento mejorado para la preparación de ziprasidona que sea menos caro y esté libre de las desventajas de los métodos conocidos.
Sumario de la invención
Se ha descubierto ahora un procedimiento mejorado para la preparación de ziprasidona, en el que las cantidades de agentes reductores caros usados disminuyen notablemente. En particular, el contenido en clorocetona (III) y en impureza (A) en el producto final disminuye notablemente.
Descripción detallada de la invención
Un primer objeto de la invención es un procedimiento para la preparación de ziprasidona (I) o una sal farmacéuticamente aceptable de la misma,
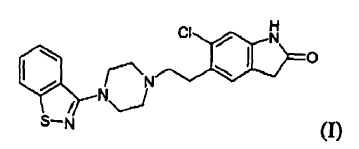
que comprende
a) reducir un compuesto (III)
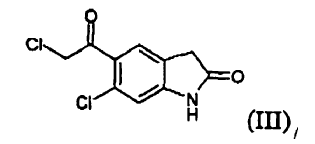
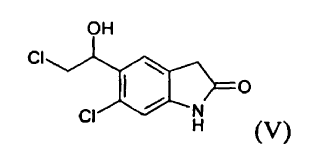
mediante tratamiento con un borohidruro de metal alcalino para producir un compuesto (V)
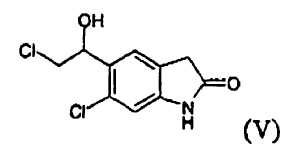
b) reducir el compuesto (V) para producir un compuesto (II)
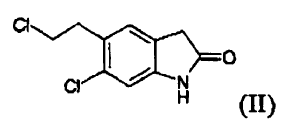
c) hacer reaccionar el compuesto (II) con un compuesto (IV)
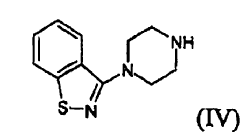
d) y, si se desea, convertir el compuesto (I) en una sal farmacéuticamente aceptable del mismo.
Puede salificarse un compuesto (I) con un ácido orgánico o inorgánico, tal como se da a conocer en el documento US 4.831.031, opcionalmente en forma de hidrato, normalmente como el mono, di o trihidrato (documentos US 4.831.031, US 5.312.925 y US 2004/0048876).
Puede reducirse un compuesto (III) mediante tratamiento con un borohidruro de metal alcalino, en particular de sodio o litio, preferiblemente borohidruro de sodio. La reacción puede llevarse a cabo en un disolvente seleccionado de, por ejemplo, agua; un alcanol C1-C4, normalmente metanol, etanol, propanol, isopropanol, n-butanol; éteres cíclicos y alicíclicos alifáticos; glicoles o derivados de los mismos, normalmente dietil éter, diisopropil éter, metil terc-butil éter, tetrahidrofurano, 2-metiltetrahidrofurano y metoxietilglicol; y ácido acético; a una temperatura que oscila aproximadamente desde 0 hasta 60ºC, preferiblemente desde 20 hasta 40ºC.
Posteriormente, puede reducirse un compuesto (V) mediante tratamiento con ácido trifluoroacético y trietilsilano, según métodos conocidos.
El compuesto (V), 6-cloro-5-(2-cloro-1-hidroxi-etil)-1,3-dihidro-indol-2-ona, en particular en forma cristalina, es novedoso y es un objeto de la invención.
La reacción entre un compuesto (II) y un compuesto (IV) puede llevarse a cabo, por ejemplo, tal como se da a conocer en el documento US 4.831.031. La reacción se lleva a cabo preferiblemente en una fase homogénea, normalmente en dimetilsulfóxido, durante un tiempo que oscila aproximadamente desde 1 hasta 24 horas, preferiblemente desde 6 hasta 15 horas, a una temperatura que oscila aproximadamente desde 90 hasta 110ºC, preferiblemente desde 95 hasta 100ºC. La conversión de un compuesto (I) en una sal farmacéuticamente aceptable del mismo y/o su preparación en forma de hidrato puede llevarse a cabo según métodos conocidos.
Según el procedimiento de la invención, la reducción de un compuesto (III) se lleva a cabo en dos etapas, por medio de la formación de un compuesto (V), reduciéndose de ese modo de manera notable la cantidad necesaria de ácido trifluoroacético/trietilsilano, un agente reductor muy caro, que de hecho se sustituye por el borohidruro de metal alcalino mucho más barato. La reducción en dos etapas de un compuesto (III) para dar un compuesto (II), y la diferente solubilidad en disolvente de la halohidrina (V) aislada, en comparación con una clorocetona (III), reduce de manera sorprendente la presencia de esta última como impureza en el producto intermedio (II) y en el producto final hasta una cantidad no superior a aproximadamente 500 ppm, normalmente no superior a aproximadamente 100 ppm. Como consecuencia, el compuesto (A), 5-(2-(4-benzo[d]isotiazol-3-il)piperazin-1-il)acetil)-6-cloro-1,3-dihidro-2H-indol-2-ona está presente en el producto final como impureza en cantidades no superiores a aproximadamente 500 ppm, normalmente no superiores a aproximadamente 100 ppm.
Se da a conocer un procedimiento para la preparación de ziprasidona, o una sal farmacéuticamente aceptable de la misma, que contiene 5-(2-(4-benzo[d]isotiazol-3-il)piperazin-1-il)acetil)-6-cloro-1,3-dihidro-2H-indol-2-ona en cantidades no superiores a aproximadamente 500 ppm; preferiblemente no superior a aproximadamente 100 ppm, y si es el caso de una clorocetona (III) en cantidades no superiores a aproximadamente 500 ppm, preferiblemente no superiores a aproximadamente 100 ppm.
Se da a conocer también una composición farmacéutica que comprende un vehículo y/o excipiente, como principio activo, ziprasidona o una sal farmacéuticamente aceptable de la misma, que contiene 5-(2-(4-benzo[d]isotiazol-3-il)piperazin-1-il)acetil)-6-cloro-1,3-dihidro-2H-indol-2-ona en cantidades no superiores a aproximadamente 500 ppm, preferiblemente no superiores a aproximadamente 100 ppm, y si es el caso de una clorocetona (III) en cantidades no superiores a aproximadamente 500 ppm, preferiblemente no superiores a aproximadamente 100 ppm.
La composición farmacéutica puede prepararse según métodos conocidos y usarse en terapia para el tratamiento de aquellas patologías en las que se usa la ziprasidona o una sal de ziprasidona, por ejemplo, esquizofrenia. La dosis diaria de ziprasidona puede oscilar habitualmente desde aproximadamente 0,5 mg hasta aproximadamente 500 mg; preferiblemente desde 20 hasta 80 mg, en administraciones diarias únicas o repetidas.
Los siguientes ejemplos ilustran la invención.
Ejemplo 1
6-Cloro-5-(2-cloro-1-hidroxi-etil)-1,3-dihidro-indol-2-ona (V)
Se carga un reactor con 200 g (0,82 moles) de 6-cloro-5-(2-cloroacetil)-1,3-dihidro-indol-2-ona, en 1 l de etanol. Se añaden a la mezcla de reacción 15,5 g (0,41 moles) de borohidruro de sodio en porciones, con fuerte agitación, a temperatura ambiente. Se mantiene la temperatura a 15-20ºC durante la adición, tras lo cual se deja la mezcla con agitación durante aproximadamente 15 h a temperatura ambiente. Se añaden entonces...
Reivindicaciones:
1. Procedimiento para la preparación de ziprasidona (I) o una sal farmacéuticamente aceptable de la misma,
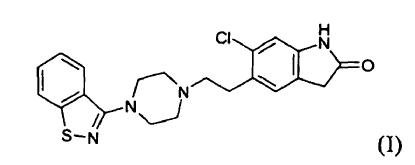
que comprende
a) reducir un compuesto (III)
mediante tratamiento con un borohidruro de metal alcalino para producir un compuesto (V)
b) reducir el compuesto (V) para producir un compuesto (II)
c) hacer reaccionar el compuesto (II) con un compuesto (IV)
d) y, si se desea, convertir el compuesto (I) en una sal farmacéuticamente aceptable del mismo.
2. Procedimiento según la reivindicación 1, en el que la reducción de un compuesto (III) se lleva a cabo en un disolvente seleccionado de agua, un alcanol C1-C4, éteres cíclicos o alicíclicos alifáticos, glicoles o derivados de los mismos, y ácido acético.
3. Procedimiento según la reivindicación 2, en el que se reduce un compuesto (III) mediante tratamiento con borohidruro de sodio en etanol.
4. Procedimiento según la reivindicación 1, en el que la reacción entre un compuesto (II) y un compuesto (IV) se lleva a cabo en una fase homogénea.
5. Procedimiento según la reivindicación 4, en el que la reacción se lleva a cabo en dimetilsulfóxido, a una temperatura que oscila aproximadamente desde 90 hasta 110ºC.
6. Procedimiento según la reivindicación 1, en el que está presente la clorocetona (III) en el producto intermedio (II) en cantidades no superiores a aproximadamente 500 ppm.
7. 6-Cloro-5-(2-cloro-1-hidroxi-etil)-1,3-dihidro-indol-2-ona.
Patentes similares o relacionadas:
Bloqueador de canales de sodio, del 29 de Julio de 2020, de DAEWOONG PHARMACEUTICAL CO., LTD.: Un compuesto representado por la Fórmula Química 1 más abajo, o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en la Fórmula […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Ureas asimétricas p-sustituidas y usos médicos de las mismas, del 22 de Julio de 2020, de Helsinn Healthcare SA: Un compuesto de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: una línea discontinua indica un enlace opcional; X es CH; […]
Inhibidores de lisina gingipaína, del 1 de Julio de 2020, de Cortexyme, Inc: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde Z es ariloximetil-carbonilo sustituido con halógeno; […]
Moduladores de la indolamina 2,3-dioxigenasa, del 24 de Junio de 2020, de Glaxosmithkline Intellectual Property (No. 2) Limited: Un compuesto que tiene la estructura de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: X es **(Ver fórmula)** […]
Compuestos de diaminopirimidilo sustituidos, composiciones de los mismos y procedimientos de tratamiento con ellos, del 17 de Junio de 2020, de SIGNAL PHARMACEUTICALS LLC: Un compuesto de fórmula (I): **(Ver fórmula)** o una sal, un tautómero, un isotopólogo o un estereoisómero farmacéuticamente aceptable […]
Modificador del sabor dulce, del 17 de Junio de 2020, de Firmenich Incorporated: Un compuesto que tiene la fórmula estructural (Ia): **(Ver fórmula)** o una sal o solvato del mismo; en la que m es 4 y n es 0 o m es 3 y […]
Compuestos para el tratamiento del cáncer, del 3 de Junio de 2020, de Oncternal Therapeutics, Inc: Un compuesto representado por la fórmula II: **(Ver fórmula)** en donde Q es S, NH, u O; Z es CH o N; A es fenilo sustituido o no sustituido; indolilo […]