MUTEÍNAS DEL FACTOR DE CRECIMIENTO PLACENTARIO DE TIPO 1, MÉTODO DE PREPARACIÓN Y APLICACIÓN DE LAS MISMAS.
Muteína de la forma monomérica del factor de crecimiento placentario de tipo 1 (PLGF-1) humano o animal,
que implica la sustitución o la eliminación en la secuencia polipeptídica de la proteína de tipo salvaje de por lo menos el residuo cisteína (Cys) situado en la posición 142 de la secuencia polipeptídica de la preproteína, correspondiente a la cisteína situada en la posición 125 de la secuencia SEC ID nº 2, y que dicha sustitución o eliminación no afecta a la formación del dímero biológicamente activo aunque impide la multimerización de dicha forma monomérica
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IT2003/000296.
Solicitante: GEYMONAT S.P.A.
Nacionalidad solicitante: Italia.
Dirección: 2 VIA S.ANNA I-03012 ANAGNI FR ITALIA.
Inventor/es: MAGLIONE, DOMENICO, BATTISTI,MAURO, CONTI,ETTORE, SALVIA,GIUSEPPE, TUCCI,MARINA, MION,Alberto.
Fecha de Publicación: .
Fecha Solicitud PCT: 19 de Mayo de 2003.
Clasificación Internacional de Patentes:
- C07K14/515 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Factor angiogénico; Angiogenina.
Clasificación PCT:
- C12N15/18 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Hormonas de crecimiento.
Clasificación antigua:
- C12N15/18 C12N 15/00 […] › Hormonas de crecimiento.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2356360_T3.pdf


Fragmento de la descripción:
Campo de la invención
La presente invención se refiere a muteínas estables de factor de crecimiento placentario de tipo 1 (PLGF-1), a su preparación, a su uso terapéutico y cosmético y a composiciones farmacéuticas y cosméticas que contienen 5 dichos derivados. De manera similar, la invención se refiere a la producción de anticuerpos contra dichos derivados y a su utilización en el diagnóstico y tratamiento de patologías tumorales y no tumorales.
Estado de la técnica
El factor de crecimiento placentario de tipo 1 (PLGF-1) es una glucoproteína homodimérica angiogénica. La actividad angiogénica se refiere a la forma dimérica, debido a que la forma monomérica es inactiva. La secuencia 10 polinucleótida completa codificante de la proteína PLGF-1, conjuntamente con su secuencia polipeptídica, fueron descritas por Maglione y Persico en la patente EP nº B-0 550 519 (patente WO nº A-92/06194).
La patente anteriormente indicada describe un método para producir PLGF-1 en bacterias modificadas utilizando un sistema de expresión inducible, comprendiendo dicho método, tras la inducción, la lisis bacteriana y la extracción directa de la proteína cruda a partir de la solución de lisado. La proteína obtenida de esta manera muestra 15 niveles bajos de actividad biológica.
Un método para la extracción y purificación del factor placentario crudo, obtenido mediante la expresión en bacterias, ha sido descrito por Maglione et al. en la solicitud de patente WO nº 2003/066676. El método comprende una serie de etapas de extracción, renaturalización y purificación, que globalmente permite obtener la proteína pura en una forma esencialmente dimérica, es decir, en su forma más activa. De hecho, es conocido que la forma 20 dimérica de la proteína es biológicamente inactiva y sólo requiere funciones angiogénicas tras la renaturalización en la forma dimérica.
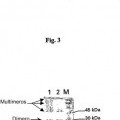
Sin embargo, los presentes inventores han observado que la proteína en la forma dimérica es parcialmente inestable, y da lugar, en una solución acuosa, durante el almacenamiento o el procesamiento, a formas multiméricas que muestran menos actividad biológica y por ello resultan menos adecuadas para el uso terapéutico debido a la 25 variabilidad de las dosis y actividad biológica.
Por lo tanto, el objetivo de la presente invención es resolver el problema de la estabilidad química/biológica reducida de PLGF-1 que se observa principalmente al conservarlo en soluciones acuosas.
Descripción resumida de la invención
La invención se basa en el inesperado descubrimiento de que los derivados de la proteína natural PLGF-1 30 con modificaciones en su secuencia polipeptídica, específicamente que implican la sustitución o eliminación de por lo menos un residuo cisteína, muestran una estabilidad química muy incrementada, manteniendo simultáneamente su actividad biológica original esencialmente invariada. A la luz de este descubrimiento, un primer objetivo de la solicitud está representado por una muteína de la forma monomérica del factor de crecimiento placentario de tipo 1 (PLGF-1) humano o animal que comprende la sustitución o eliminación en la secuencia polipeptídica de la proteína 35 de tipo salvaje de por lo menos uno de los nueve residuos cisteína (Cys) contenidos en la misma. Dicha sustitución o eliminación no afecta al proceso de dimerización esencial para obtener la proteína en su forma biológicamente activa, pero evita la multimerización de la forma monomérica.
Entre los diversos residuos cisteína, se ha observado que la eliminación o sustitución de un residuo presente en la parte C-terminal, y específicamente en la posición 142 de la secuencia polipeptídica completa, es 40 decir que comprende tanto la proteína PLGF-1 madura como el péptido de señal correspondiente, resulta particularmente efectiva. En la realización preferente de la invención, el residuo Cys 142 se sustituye por un residuo de glicina (Gly). Esta sustitución produce una muteína de la forma monomérica de PLGF-1 que presenta una capacidad de dimerización no modificada, pero que es básicamente incapaz de generar productos de multimerización. Además de las modificaciones anteriormente indicadas, las muteínas según la invención pueden 45 contener otras eliminaciones, sustituciones o adiciones de uno o más aminoácidos de la proteína de tipo salvaje, con la condición de que dichas modificaciones no alteren las características funcionales de la muteína misma.
Por lo tanto, un segundo objetivo de la invención está representado por una muteína del factor PLGF-1 en forma dimérica, preferentemente purificada de manera que comprenda esencialmente el dímero solo. Dicha muteína igualmente puede ser perfectamente la proteína madura o la preproteína, que comprende un péptido de señal en la 50 parte N-terminal.
Un objetivo adicional de la invención es la secuencia de nucleótidos que comprende el ADN codificante de la muteína. La secuencia se caracteriza porque se elimina o se modifica un codín TGC o TGT codificante del aminoácido cisteína en la secuencia natural de PLGF-1. En una realización preferente, el codón correspondiente a la
cisteína se sustituye por un codón GGC, GGT, GGA o GGG, todos codificantes del aminoácido glicina (Gly). Preferentemente es la base timidina (T) en la posición 382 (codón TGC) de la secuencia SEC ID nº 1 que se sustituye por la base guanidina (G), generando el codón GGC.
Un objetivo adicional de la invención es un sistema de expresión que comprende la secuencia de nucleótidos indicada anteriormente, flanqueada por secuencias no traducidas que controlan y regulan la expresión. 5 Este sistema puede inducirse en células procarióticas, preferentemente en células bacterianas.
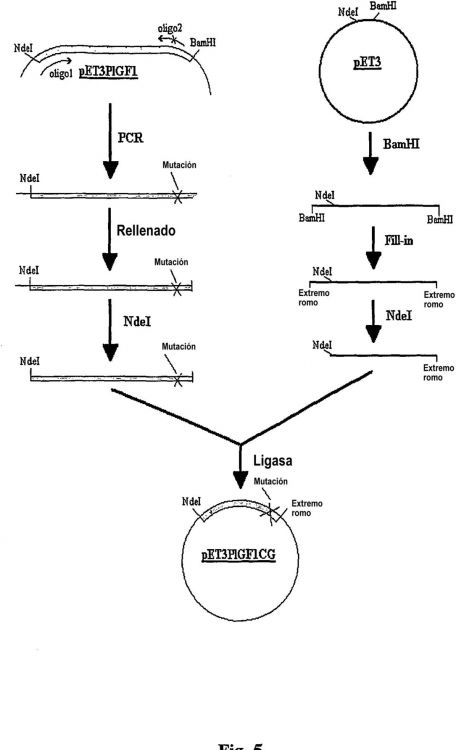
La expresión se encuentra bajo el control de un promotor inducible y puede inducirse por medio de compuestos adecuados. Las células huésped modificadas utilizando el sistema de expresión indicado anteriormente también son el objetivo de la invención. Éstas son células procarióticas, preferentemente células bacterianas tales como E. coli. La invención también cubre procedimientos para la producción de la secuencia de nucleótidos, en la 10 que el ADN codificante de la muteína es producido por la reacción en cadena de la polimerasa (PCR) utilizando como cebador oligonucleótidos que han sido convenientemente modificados con respecto a la secuencia de la proteína de tipo salvaje. Preferentemente, el oligonucleótido de secuencia SEC ID nº 3 se utiliza como cebador directo 5'-3' y el oligonucleótido de secuencia SEC ID nº 4 se utiliza como cebador inverso 5'-3'.
Un objetivo adicional de la invención es un procedimiento para la producción y extracción de la muteína, en 15 el que las células huésped, preferentemente bacterianas, modificadas utilizando el sistema de expresión según la invención, se cultivan en un medio de cultivo adecuado, se induce la expresión de la proteína mediante un inductor adecuado, se aíslan las células y se lisan, y la muteína se extrae de la mezcla de lisis. Durante la etapa de fermentación y antes de la inducción de la etapa de expresión, las células se cultivan hasta alcanzar una elevada densidad óptica (D.O.) del medio de cultivo. A continuación, se induce la expresión de la proteína mediante la 20 adición de agentes de inducción adecuados. Durante las etapas siguientes, las células se lisan, para liberar los materiales endocelulares al medio de cultivo, específicamente el material nucleico y los cuerpos de inclusión, solubilizando estos últimos, y la proteína obtenida de esta manera se renaturaliza en la forma dimérica. El procedimiento de extracción y purificación puede comprender etapas opcionales adicionales para la purificación de la proteína dimérica. En una realización preferente, el procedimiento comprende por lo menos una etapa adicional 25 de purificación mediante cromatografía de intercambio iónico o de fase inversa. En una realización adicional, el procedimiento comprende una purificación inicial mediante cromatografía de intercambio aniónico seguido de cromatografía de fase inversa.
La muteína obtenida utilizando el procedimiento de producción, extracción y purificación según la invención contiene no menos de 98,5% de proteína activa y no más de 1,5% de la forma monomérica. La forma activa 30 esencialmente consiste de la forma dimérica y contiene únicamente trazas de la forma multimérica. Los ensayos de estabilidad subrayan la elevada estabilidad durante... [Seguir leyendo]
Reivindicaciones:
1. Muteína de la forma monomérica del factor de crecimiento placentario de tipo 1 (PLGF-1) humano o animal, que implica la sustitución o la eliminación en la secuencia polipeptídica de la proteína de tipo salvaje de por lo menos el residuo cisteína (Cys) situado en la posición 142 de la secuencia polipeptídica de la preproteína, correspondiente a la cisteína situada en la posición 125 de la secuencia SEC ID nº 2, y que dicha sustitución o eliminación no afecta a la formación del dímero biológicamente activo aunque impide la 5 multimerización de dicha forma monomérica.
2. Muteína según la reivindicación 1, en la que el residuo Cys situado en la posición 142 se ha sustituido por un residuo de glicina (Gly).
3. Muteína según cualquiera de las reivindicaciones 1 a 2, en forma de una preproteína o proteína madura.
4. Muteína según cualquiera de las reivindicaciones 1 a 3, en la que uno o más aminoácidos adicionales de la 10 proteína de tipo salvaje se eliminan, sustituyen o añaden sin alterar la actividad angiogénica de la muteína.
5. Muteína según cualquiera de las reivindicaciones 1 a 4, en forma dimérica.
6. Muteína según la reivindicación 5, que comprende por lo menos 98,5% de la forma dimérica.
7. Secuencia de nucleótidos que comprende el ADN codificante de la muteína según cualquiera de las reivindicaciones 1 a 4. 15
8. Secuencia de nucleótidos según la reivindicación 7, en la que un codón TGC o TGT en la secuencia codificante del PLGF-1 de tipo salvaje se ha eliminado o modificado.
9. Secuencia de nucleótidos según la reivindicación 8 en la que se ha sustituido un codón TGC o TGT por un codón GGC, GGT, GGA o GGG.
10. Secuencia de nucleótidos según la reivindicación 9, en la que la base timidina situada en la posición 382 de 20 la secuencia SEC ID nº 1, o derivados de la misma causados por la degeneración del ADN, se ha sustituido por la base guanidina.
11. Sistema de expresión que comprende la secuencia de nucleótidos reivindicada según cualquiera de las reivindicaciones 7 a 10, flanqueada por secuencias no traducidas para el control y la regulación de la expresión. 25
12. Sistema de expresión según al reivindicación 11, que es un sistema de expresión inducible en células bacterianas.
13. Sistema de expresión según la reivindicación 11 ó 12, en el que la expresión se encuentra bajo el control de un promotor inducible.
14. Sistema de expresión según cualquiera de las reivindicaciones 11 a 13, que es el sistema de expresión de 30 la ARN polimerasa del fago T7, y que la expresión resulta inducida mediante lactosa, isopropil-β-D-tiogalactopiranósido (IPTG) o análogo funcionalmente equivalente.
15. Célula huésped transformada por medio del sistema de expresión según cualquiera de las reivindicaciones 11 a 14.
16. Célula según la reivindicación 15, que es una célula bacteriana. 35
17. Célula bacteriana según la reivindicación 16, que se deriva de una cepa de E. coli.
18. Procedimiento para la producción de la secuencia de nucleótidos según cualquiera de las reivindicaciones 7 a 10, en el que el ADN codificante de la muteína es producido por la reacción en cadena de la polimerasa (PCR) utilizando cebadores oligonucleótidos que han sido convenientemente modificados con respecto a la secuencia de nucleótidos de tipo salvaje. 40
19. Procedimiento según la reivindicación 18 en el que el oligonucleótido de secuencia SEC ID nº 3 se utiliza como cebador 5'-3' (directo) y el oligonucleótido de secuencia SEC ID nº 4 se utiliza como cebador 5'-3' (inverso).
20. Procedimiento según la reivindicación 19, en el que la secuencia de ADN codificante de la proteína PLGF-1 sin la proteína de señal se utiliza como molde en la reacción en cadena de la polimerasa. 45
21. Procedimiento según cualquiera de las reivindicaciones 18 a 20, en el que la secuencia de ADN obtenida en la reacción en cadena de la polimerasa se somete a una reacción de completado, después se digiere con enzimas de restricción adecuados y se clona en un vector adecuado.
22. Procedimiento para la producción y extracción de una muteína del factor PLGF-1, en el que las células huésped según cualquiera de las reivindicaciones 15 a 17 se cultivan en un medio de cultivo adecuado, la expresión de la proteína se induce utilizando un inductor adecuado, las células se aíslan y se lisan, y la muteína se extrae de la mezcla de lisis.
23. Procedimiento según la reivindicación 22, en el que el medio de cultivo comprende uno o más agentes de 5 selección, extracto de levadura, glicerol y sales amónicas, y se encuentra libre de material de origen animal o humano.
24. Procedimiento según la reivindicación 22 ó 23, en el que las células se cultivan, antes de la etapa de inducción de la expresión, hasta alcanzar una densidad óptica (D.O.) del medio de cultivo de entre 0,2 y 50 unidades, a 600 nm. 10
25. Procedimiento según cualquiera de las reivindicaciones 22 a 24, en el que la expresión se induce utilizando lactosa o isopropil-β-tiogalactopiranósido (IPTG).
26. Procedimiento según cualquiera de las reivindicaciones 22 a 25, en el que la lisis celulares se lleva a cabo por medio de congelación/descongelación, prensa francesa u otras técnicas equivalentes.
27. Procedimiento según cualquiera de las reivindicaciones 22 a 26, en el que los cuerpos de inclusión 15 liberados durante la lisis se aíslan por medio de por lo menos dos ciclos de centrifugación y lavado en un tampón adecuado.
28. Procedimiento según cualquiera de las reivindicaciones 22 a 27, en el que los cuerpos de inclusión se solubilizan en un tampón desnaturalizante que contiene urea, isotiocianato de guanidina, hidrocloruro de guanidina u otro agente desnaturalizante, y opcionalmente se homogeneizan o se sonican. 20
29. Procedimiento según cualquiera de las reivindicaciones 22 a 28, en el que, tras la solubilización de los cuerpos de inclusión, la solución se diluye y el material proteico se renaturaliza en forma dimérica mediante la adición a la solución de agentes oxidorreductores y la incubación durante 10 a 30 horas, durante 18 a 20 horas a una temperatura de entre 10ºC y 30ºC, bajo agitación.
30. Procedimiento según cualquiera de las reivindicaciones 22 a 29, que comprende por lo menos una etapa de 25 purificación de proteína dimérica.
31. Procedimiento según la reivindicación 30, en el que la etapa de purificación consiste de una cromatografía de intercambio iónico.
32. Procedimiento según la reivindicación 30 ó 31, en el que la solución procedente de la etapa de renaturalización se carga en una columna de intercambio aniónico con una proporción de volumen de 30 carga/volumen de columna de entre 1:1 y 10:1.
33. Procedimiento según la reivindicación 30 ó 31, que comprende una etapa de purificación en columna mediante cromatografía de fase inversa.
34. Procedimiento según cualquiera de las reivindicaciones 22 a 33, que comprende un pase adicional de ultrafiltración seguido de liofilización en presencia o en ausencia de aditivos adecuados. 35
35. Muteína según la reivindicación 5 ó 6, para la utilización en un método de tratamiento terapéutico.
36. Muteína según la reivindicación 35, en el tratamiento de enfermedades isquémicas.
37. Muteína según la reivindicación 36, en el tratamiento de la isquemia del tejido miocárdico, el infarto miocárdico, el ictus isquémico y enfermedades miocárdicas isquémicas crónicas tales como la isquemia cerebral y el ictus isquémico, la isquemia intestinal y la isquemia periférica de las extremidades. 40
38. Muteína segun la reivindicación 35, en el tratamiento del escleroderma.
39. Muteína según la reivindicación 35, en el tratamiento de úlceras en la piel, heridas, quemaduras y tratamiento post-operatorio.
40. Muteína según la reivindicación 35, en el tratamiento del envejecimiento natural o precoz de los tejidos cutáneos. 45
41. Muteína según la reivindicación 35, en el tratamiento de la pérdida natural o patológica de pelo.
42. Composición farmacéutica que contiene la muteína según la reivindicación 5 ó 6, y un excipiente farmacológicamente aceptable.
43. Composición farmacéutica según la reivindicación 42, adecuada para la utilización parenteral, tópica, oral, nasal o en implante.
44. Composición cosmética que contiene la muteína según la reivindicación 5 ó 6, y un excipiente cosméticamente aceptable.
45. Método para la preparación de una composición farmacéutica según la reivindicación 42 o de la 5 composición cosmética según la reivindicación 44, en el que la muteína PLGF-1 se asocia a un excipiente farmacológica o cosméticamente aceptable y con otros aditivos habituales.
Patentes similares o relacionadas:
Proteínas de fusión citolíticas humanas, del 7 de Agosto de 2019, de UNIVERSITY OF CAPE TOWN: Una proteína de fusión citolítica humana (hCFP) recombinante adecuada para inducir apoptosis en células diana humanas que comprende un componente de unión específico […]
Anticuerpo monoclonal para antagonizar e inhibir la unión de factor de crecimiento celular endotelial vascular y su receptor, y secuencia de codificación y uso de este, del 9 de Enero de 2019, de Suzhou Stainwei Biotech Inc: Un anticuerpo monoclonal murino que inhibe de manera antagonista la unión del factor de crecimiento endotelial vascular al receptor de este, caracterizado […]
VNAR CON ACTIVIDAD ANTI-ANGIOGÉNICA EN TUMORES SÓLIDOS DE ANIMALES DE COMPAÑÍA, del 25 de Octubre de 2018, de CENTRO DE INVESTIGACIÓN CIENTÍFICA Y DE EDUCACIÓN SUPERIOR DE ENSENADA, BAJA CALIFORNIA: La presente invención se refiere a una novedosa proteína vNAR de SEQ ID No:1 capaz de inhibir la actividad del VEGF en mamíferos carnívoros de los […]
Proteína de unión a VEGF para el bloqueo de la angiogénesis, del 8 de Noviembre de 2017, de CHILDREN'S MEDICAL CENTER CORPORATION: Una proteína quimérica de unión a VEGF, que comprende una secuencia de aminoácidos de SEQ ID NO: 3.
Péptidos VEGF quiméricos, del 4 de Enero de 2017, de THE OHIO STATE UNIVERSITY RESEARCH FOUNDATION: Péptido quimérico que comprende: (a) al menos un epítopo de VEGF humano constituido por KCECRPKKDRARQENPCG; (b) un epítopo de células […]
Inhibición del PlGF para el tratamiento de la leucemia positiva para el cromosoma Filadelfia, del 22 de Junio de 2016, de VIB VZW: Un anticuerpo o un fragmento del mismo que se une específicamente al factor de crecimiento placentario, y la inhibición de la unión del factor de crecimiento placentario al […]
Péptidos VEGF quiméricos, del 29 de Abril de 2015, de THE OHIO STATE UNIVERSITY RESEARCH FOUNDATION: Péptido quimérico que comprende: a) al menos un epítopo de VEGF humano formado por la secuencia de aminoácidos ITMQIMRIKPHQGQHIGEMSF; b) un epítopo de […]
Polipéptido novedoso que tiene actividad de inducción de la angiogénesis y una actividad antibacteriana y uso del mismo para propósitos médicos, del 16 de Abril de 2014, de ANGES MG, INC.: Un polipéptido cuya secuencia de aminoácidos se muestra en cualquiera de SEQ ID NOs: 1 a 6.