Productos medicinales de inhalación de polvo seco que presentan propiedades de control de la humedad y procedimientos de administración de los mismos.
Un producto medicinal, que comprende:
un dispositivo de inhalación de polvo seco que contiene una o más composiciones farmacéuticas presentes en el mismo,
en el que las una o más composiciones farmacéuticas comprenden los ingredientes activos (I) 4-{(1R)-2-[(6-{2-[(2,6-diclorobencil)oxi]etoxi}hexil)amino]-1-hidroxietil}-2-(hidroximetil)fenol, o una sal del mismo y (II) 2-furancarboxilato de (6α, 11ß, 16α, 17α)-6,9-difluoro-17-{[(fluorometil)tio]carbonil}-11-hidroxi 16-metil-3-oxoandrosta-1,4-dien-17-ilo, o un solvato del mismo;
un material higroscópico; y un envase que engloba el dispositivo de inhalación de polvo seco y el material higroscópico, definiendo un volumen encerrado en el mismo; en el que están presentes cada uno de los ingredientes activos (I) y (II) en las mismas o en diferentes composiciones farmacéuticas, y en el que el volumen encerrado dentro del envase presenta una humedad relativa de desde, en un extremo inferior, cualesquiera de los valores 15, 16, 17, 18 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 o 40 % de HR hasta, en un extremo superior, cualesquiera de los valores 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, o 40 % de HR.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2011/065056.
Solicitante: GlaxoSmithKline Intellectual Property Development Limited.
Nacionalidad solicitante: Reino Unido.
Dirección: 980 GREAT WEST ROAD BRENTFORD, MIDDLESEX TW8 9GS REINO UNIDO.
Inventor/es: ASWANIA,OSAMA, JIANG,ZHONG, ROCHE,TREVOR CHARLES, WHITAKER,MARK.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/133 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen grupos hidroxilo,p. ej. esfingosina.
- A61K31/137 A61K 31/00 […] › Arilalquilaminas, p. ej. Anfetamina, epinefrina, salbutamol, efedrina.
- A61K31/58 A61K 31/00 […] › que contienen heterociclos, p. ej. aldosterona, danazol, estanozolol, pancuronium, digitogenina (digitoxina A61K 31/704).
- A61K9/14 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61P11/06 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 11/00 Medicamentos para el tratamiento de trastornos del aparato respiratorio. › Antiasmáticos.
PDF original: ES-2546422_T3.pdf




Fragmento de la descripción:
Productos medicinales de inhalación de polvo seco que presentan propiedades de control de la humedad y procedimientos de administración de los mismos
Referencia cruzada a solicitudes relacionadas
La presente solicitud hace referencia a la solicitud provisional de EE. UU. con n.° de serie 61/378,49 titulada "Productos medicinales de inhalación de polvo seco que presentan propiedades de control de la humedad y procedimientos de administración de los mismos" ( expediente de agente n.° PR64313), presentada el 31 de agosto de 21.
La presente solicitud reivindica prioridad frente a la solicitud provisional de EE. UU. con n.° de serie: 61/378,412, presentada el 31 de agosto de 21.
Campo de la invención
La invención se refiere, en general, a productos medicinales de inhalación y procedimientos de fabricación de los mismos.
Antecedentes de la invención.
Los inhaladores son dispositivos portátiles de mano que suministran medicación directamente a los pulmones. Una clase de inhaladores son los inhaladores de polvo seco ("IPS") pasivos. Un IPS pasivo es un dispositivo accionado por el paciente en el que la acción de aspiración a través del dispositivo conduce la formulación en polvo hacia el aparato respiratorio. El IPS está bien reconocido como procedimiento de suministro de fármaco al pulmón para el tratamiento de enfermedades pulmonares y sistémicas.
Una formulación de IPS generalmente es una combinación en polvo de ingredientes activos y un diluyente sólido en masa, tal como lactosa. El tamaño de partícula inhalado de los ingredientes activos se debe optimizar para suministrar en profundidad el fármaco en el pulmón para lograr la eficacia. Este tamaño de partícula eficaz, o masa de partículas finas ("MPF"), típicamente se encuentra entre 1-5 pm, mientras que las partículas más grandes que este, 5-1 pm, tienden a depositarse en las vías respiratorias altas sin alcanzar el sitio de acción y las partículas mucho más pequeñas, o masa de partículas muy finas ("MPmF"), <1 pm, como resultado se pueden exhalar, por lo tanto, típicamente no se logran los niveles terapéuticos deseados. La Administración de Medicamentos y Alimentos ha reconocido que la MPF de partículas en un dispositivo IPS puede verse afectada por las condiciones ambientales, la humedad, en particular, y ha sugerido que los fabricantes de dichos dispositivos evalúen el efecto de diferentes condiciones ambientales sobre diversas fuerzas interactivas dentro del dispositivo IPS, que conjuntamente afectan a la fluidización y el comportamiento de aerosolización de la formulación y, por ende, al rendimiento (véase FDA Guidance, Metered Dose Inhaler (MDI) and Dry Powder Inhaler (DPI) Drug Products Chemistry, Manufacturing, and Controls Documentation).
Es deseable controlar la humedad dentro de un dispositivo IPS, y, por ende, la MPF. Un planteamiento de esto implica el uso de un sistema desecante dentro del IPS, tal como se muestras en la publicación W284841 (Lab Pharma Ltd, presentada el 12 de septiembre de 27). Este planteamiento usa un sistema desecante que comprende un recipiente estanco que contiene un desecante seco, y una cámara de fármaco que contiene el polvo de inhalación donde el recipiente estanco está dispuesto en el interior de la cámara de fármaco o en su proximidad con el desecante pudiendo mantener un punto fijo de humedad como una solución saturada de al menos una sal. El sistema está destinado a mantener la humedad relativa máxima alrededor de la formulación en polvo dentro de un intervalo específico durante un periodo prolongado. De forma similar, los inhaladores de polvo seco de dosis múltiples basados en depósitos (p.ej., Turbuhaler®, disponible comercialmente de Astra Zeneca de Wilmington, Delaware (véase, p.ej., Wetterlim (Pharm. Res 5, 56-58, 1988)) contienen un desecante almacenado en dichos inhaladores.
Un planteamiento alternativo para controlar la absorción de humedad por productos en polvo seco se muestra en la publicación US2863719 (Vectura Limited, presentada el 29 de abril de 25). Este planteamiento muestra una formulación en polvo seco inhalable de glicopirronio con una estabilidad de al menos 1 año en condiciones normales mediante su almacenamiento en un envasado realizado a partir de un material que por sí tiene un contenido en humedad de menos de un 1 %, preferentemente menos de un 5 % y más preferentemente menos de un 3 %. Se ha encontrado que el glicopirronio tiene un grave problema con respecto a la estabilidad, en especial, inmediatamente después del procedimiento de micronización convencional. Las dosis de cápsulas individuales de glicopirronio para una técnica de preparación adecuada se usan con las cápsulas realizadas de hipromelosa, gelatina plastificada, almidón, quitosano, plástico sintético o termoplásticos. Estos materiales fueron seleccionados como cápsulas, ya que pueden mantener el glicopirronio con un intervalo de humedad adecuado para el suministro de aerosol.
A pesar de cualquier progreso potencial que se ha realizado en relación con el control de la humedad dentro del dispositivo IPS, el intervalo de humedad aceptable para mezclas y principios activos específicos no se entiende bien y es difícil, si no imposible, de predecir.
Sumario de la invención
En un primer aspecto, la invención proporciona un producto medicinal. El producto medicinal comprende un dispositivo de inhalación de polvo seco que contiene una o más composiciones farmacéuticas en el mismo, en el que las una o más composiciones farmacéuticas comprenden los ingredientes activos (I) 4-{(1f?)-2-[(6-{2-[(2,6-diclorobenc¡l)oxi]etoxi}hexil)amino]-1-hidroxiet¡l}-2-(h¡drox¡met¡l)fenol, o una sal del mismo y (II)
2-furancarboxilato de (6a, 1113, 16a, 17a)-6,9-difluoro-17-{[(fluorometil)
tio]carbonil}-11 -hidroxi-16-metil-3-oxoandrosta-1,4-dien-17-ilo, o un solvato del mismo; un material higroscópico, un envase que engloba el dispositivo de inhalación de polvo seco y el material higroscópico, definiendo un volumen encerrado en el mismo, en el que están presentes cada uno de los ingredientes activos (I) y (II) en las mismas o en diferentes composiciones farmacéuticas, y en el que el volumen encerrado dentro del envase presenta una humedad relativa de desde un 2 % a un 4 %.
En virtud de la invención, más en particular, mediante la sensata selección de valores de humedad relativa, y como se expone con mayor detalle en el presente documento, el producto medicinal ventajosamente puede presentar un periodo de validez mejorado y masa de partículas finas más estable como resultado de que la humedad relativa con el volumen encerrado del envase está controlada dentro de un intervalo específico.
En otro aspecto, la invención proporciona un procedimiento de tratamiento de un trastorno respiratorio. El procedimiento comprende administrar a un paciente mediante inhalación oral (I) 4-{(1f?)-2-[(6-{2-[(2,6-diclorobencil)oxi]etoxi}hexil)amino]-1-hidroxiet¡l}-2-(hidrox¡met¡l)fenol, o una sal del mismo y (II) 2-furancarboxilato de (6a, 1113, 16a, 17a)-6,9-difluoro-17-{[(fluorometil)tio]carbonil}-11 -hidroxi-16-metil
-3-oxoandrosta-1,4-dien-17-ilo, o un solvato del mismo usando un producto medicinal como se describe en el primer aspecto en el presente documento.
En otro aspecto, la invención proporciona un procedimiento de producción de un producto medicinal que comprende someter un material higroscópico a una exposición de humedad suficiente para conseguir una humedad relativa predeterminada; combinar el material higroscópico con un dispositivo de inhalación que contiene una o más composiciones farmacéuticas en el mismo, en el que las una o más composiciones farmacéuticas comprenden los ingredientes activos (I) 4-{(1R)-2-[(6-{2-[(2,6-d¡clorobencil)oxi]etoxi}hexil)am¡no]-1-h¡drox¡etil}-2-(hidroximetil)fenol, o una sal del mismo, y (II) 2-furancarboxilato de (a, 11(3, 16a,
17a)-6,9-difluoro-17-{[(fluorometil)tio]carbonil}-11 -hidroxi-16-metil- 3-oxoandrosta-1,4-dien-17-ilo, o un solvato del mismo; en el que están presentes cada uno de los ingredientes activos (I) y (II) en las mismas o en diferentes composiciones farmacéuticas, y en lo sucesivo encerrar el dispositivo de inhalación de polvo seco y el material higroscópico dentro de un envase para definir un volumen encerrado en el mismo que forma un producto medicinal y en el que el nivel de hidratación del material higroscópico es tal que el volumen encerrado tiene una humedad relativa de desde un 2 % a un 4 %. Las etapas de someter y combinar pueden tener lugar conjuntamente o por separado.
Estos y otros aspectos se proporcionan mediante la invención como se describe en el presente documento.
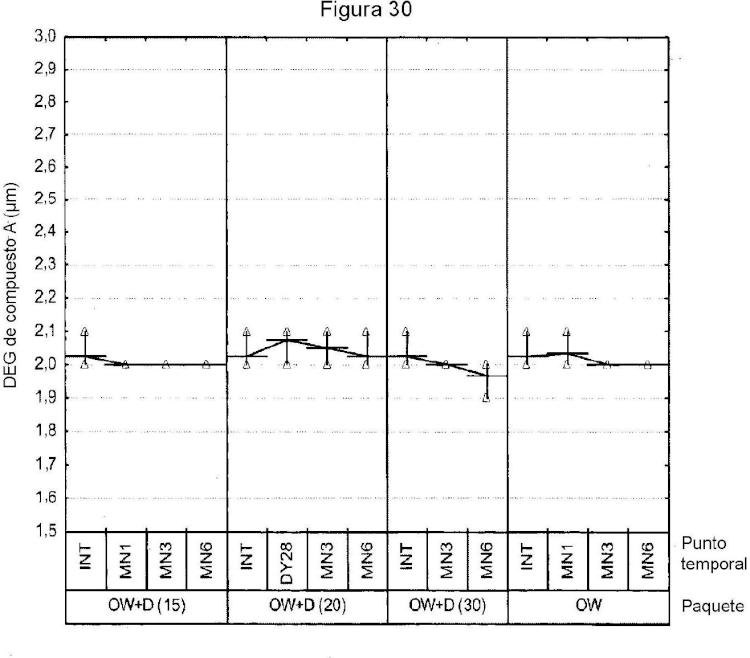
Breve descripción de las figuras
... [Seguir leyendo]
Reivindicaciones:
1. Un producto medicinal, que comprende:
un dispositivo de inhalación de polvo seco que contiene una o más composiciones farmacéuticas presentes en el mismo, en el que las una o más composiciones farmacéuticas comprenden los ingredientes activos (I) 4-{(1R)-2-[(6-[2-[(2,6-diclorobencil)oxi]etoxi}hexil)amino]-1-hidroxietil}-2-(hidroximetil)fenol, o una sal del mismo y (II) 2-furancarboxilato de (6a, 11IÍ, 16a, 17a)-6,9-difluoro-17-{[(fluorometil)tio]carbonil}-11-hidroxi-
16-metil-3-oxoandrosta-1,4-dien-17-ilo, o un solvato del mismo; un material higroscópico; y un envase que engloba el dispositivo de inhalación de polvo seco y el material higroscópico, definiendo un volumen encerrado en el mismo;
en el que están presentes cada uno de los ingredientes activos (I) y (II) en las mismas o en diferentes composiciones farmacéuticas, y en el que el volumen encerrado dentro del envase presenta una humedad relativa de desde, en un extremo inferior, cualesquiera de los valores 15, 16, 17, 18 19, 2, 21, 22, 23, 24, 25, 26, 27, 28, 29, 3, 31, 32, 33, 34, 35, 36, 37, 38, 39 o 4 % de HR hasta, en un extremo superior, cualesquiera de los valores 17, 18, 19, 2, 21, 22, 23, 24, 25, 26, 27, 28, 29, 3, 31, 32, 33, 34, 35, 36, 37, 38, 39, o 4 % de HR.
2. Un producto medicinal de acuerdo con la reivindicación 1, que comprende:
un dispositivo de inhalación de polvo seco que contiene dos composiciones farmacéuticas presentes en el mismo, en el que una de dichas dos composiciones farmacéuticas comprende el ingrediente activo (I) 4-{(1R)-2-[(6-(2-[(2,6-diclorobencil)oxi]etoxi}hexil)amino]-1-hidroxietil}-2-(hidroximetil)fenol, o una sal del mismo, y la otra de dichas dos composiciones farmacéuticas comprende el ingrediente activo (II) 2-furancarboxilato de (6a, 11 (3., 16a, 17a)-6,9-difluoro-17-{[(fluorometil)tio]carbonil}-11-hidroxi-16-metil-3-oxoandrosta-1,4-dien-17-ilo, o un solvato del mismo; un material higroscópico; y un envase que engloba el dispositivo de inhalación de polvo seco y el material higroscópico, definiendo un volumen encerrado en el mismo; en el que el volumen encerrado dentro del envase presenta una humedad relativa de desde un 2 % a un 4 %.
3. El producto medicinal de acuerdo con la reivindicación 1 o la reivindicación 2, en el que el compuesto de (I) es
trifenilacetato de 4-{(1R)-2-[(6-{2-[(2,6-diclorobencil)oxi]etoxi}hexil)amino]-1-hidroxietil} -2-(hidroximetil)fenol y el compuesto de (II) es 2-furancarboxilato de (6a, 11B, 16a, 17)-6,9-difluoro-17-
{[(fluorometil)tio]carbonil}-11-hidroxi-16-metil-3-oxoandrosta-1,4-dien-17-ilo.
4. El producto medicinal de acuerdo con cualquiera de las reivindicaciones 1 a 3, en el que dicha una o más composiciones farmacéuticas comprende al menos un excipiente.
5. El producto medicinal de acuerdo con la reivindicación 4, en el que dicho al menos un excipiente es lactosa.
6. El producto medicinal de acuerdo con cualquiera de las reivindicaciones 1 a 5, en el que dicho material higroscópico comprende gel de sílice.
7. El producto medicinal de acuerdo con la reivindicación 6, en el que el gel de sílice está presente dentro de una bolsa.
8. El producto medicinal de acuerdo con cualquiera de las reivindicaciones 1 a 7, en el que la bolsa está suelta dentro del producto medicinal.
9. El producto medicinal de acuerdo con cualquiera de las reivindicaciones 1 a 7, en el que la bolsa está fija con respecto al dispositivo de inhalación.
1. El producto medicinal de acuerdo con cualquiera de las reivindicaciones 1 a 9, en el que el dispositivo de inhalación de polvo seco es un dispositivo de dosis unitaria.
11. El producto medicinal de acuerdo con cualquiera de las reivindicaciones 1 a 9, en el que el dispositivo de inhalación de polvo seco es un dispositivo de dosis múltiples.
12. El producto medicinal de acuerdo con la reivindicación 11, en el que el dispositivo de inhalación de polvo seco es un dispositivo inhalador que tiene dos tiras de blíster desprendióles, conteniendo cada tira dosis dosificadas previamente en cavidades de blíster dispuestas a lo largo de su longitud, en el que una tira de blíster tiene múltiples blísteres de composición que contiene el compuesto de fórmula (I) y la otra tira de blíster tiene múltiples blísteres de otra composición que contiene el compuesto de fórmula (II).
13. El producto medicinal de acuerdo con cualquiera de las reivindicaciones 6 a 12, en el que el material higroscópico está en forma de una bolsa desecante de gel de sílice.
14. El producto medicinal de acuerdo con cualquiera de las reivindicaciones 1 a 13, en el que el envase se presenta como una bandeja preformada y una tapa, en el que la tapa está sellada a la bandeja.
15. El producto medicinal de acuerdo con la reivindicación 14, en el que la bandeja se presenta como un laminado de aluminio y polipropileno y la tapa es un laminado de aluminio y polímero.
16. El producto medicinal de acuerdo con la reivindicación 15, en el que, con respecto a la bandeja, el aluminio está
presente en un espesor que oscila entre 11-16 micrómetros y el polipropileno en un espesor de
micrómetros.
17. El producto medicinal de acuerdo con cualquiera de las reivindicaciones 15 o 16, en el que, con respecto a la
tapa, la capa de aluminio tiene un espesor de 6 micrómetros y el polímero de 25 g/m2
18. Un producto medicinal de acuerdo con cualquiera de las reivindicaciones 1 a 17 para su uso en el tratamiento de un trastorno respiratorio.
19. Un procedimiento de producción de un producto medicinal, que comprende:
someter un material higroscópico a una exposición de humedad suficiente para conseguir una humedad relativa predeterminada;
combinar el material higroscópico con un dispositivo de inhalación que contiene una o más composiciones farmacéuticas en el mismo, en el que las una o más composiciones farmacéuticas comprenden los ingredientes 15 activos (I) 4-[(1R)-2-[(6-{2-[(2,6-diclorobencil)oxi]etoxi}hexil)amino]-1-hidroxietil}-2-(hidroximetil)fenol, o una sal
del mismo, y (II) 2-furancarboxilato de (6a, 11B, 16a, 17a)-6,9-difluoro-17-{[(fluorometil)tio]carbonil} -11-hidroxi-16-metil-3-oxoandrosta-1,4-dien-17-ilo, o un solvato del mismo; en el que están presentes cada uno de los ingredientes activos (I) y (II) en la misma o en diferentes composiciones farmacéuticas, y
encerrar el dispositivo de inhalación de polvo seco y material higroscópico dentro de un envase para definir un 2 volumen encerrado en el mismo que forma un producto medicinal y en el que el nivel de hidratación del material
higroscópico es tal que el volumen encerrado tiene una humedad relativa de desde un 2 % a un 4 %.
2. Un producto medicinal producido de acuerdo con el procedimiento de la reivindicación 19.
Patentes similares o relacionadas:
Derivados de 5-[2-(piridin-2-ilamino)-1,3-tiazol-5-il]-2,3-dihidro-1H-isoindol-1-ona y su uso como inhibidores dobles de fosfatidilinositol··3-cinasa delta y gamma, del 15 de Julio de 2020, de ASTRAZENECA AB: Compuesto de formula (I) **(Ver fórmula)** donde X es C(O) o SO2; Y es SO2NHR5 o SO2R6; R1 se selecciona de alquilo C1-4, […]
Composiciones farmacéuticas para uso tópico basadas en ácido hialurónico sulfatado como promotor de absorción de la piel, del 1 de Julio de 2020, de FIDIA FARMACEUTICI S.P.A.: Una composición farmacéutica para uso tópico que contiene ácido hialurónico sulfatado como promotor de absorción de la piel de diclofenaco, ketoprofeno, ibuprofeno […]
Compuestos de diaminopirimidilo sustituidos, composiciones de los mismos y procedimientos de tratamiento con ellos, del 17 de Junio de 2020, de SIGNAL PHARMACEUTICALS LLC: Un compuesto de fórmula (I): **(Ver fórmula)** o una sal, un tautómero, un isotopólogo o un estereoisómero farmacéuticamente aceptable […]
Cadena alfa del receptor de IgE de alta afinidad de fusión Fc, del 13 de Mayo de 2020, de KISSEI PHARMACEUTICAL CO., LTD.: Una proteína de fusión Fc que comprende: (i) una cadena α del receptor de IgE de alta afinidad; y (ii) la región Fc de IgG1, en donde la región del fragmento […]
Derivados de piperidin-4-IL azetidina como inhibidores de JAK1, del 6 de Mayo de 2020, de Incyte Holdings Corporation: Un compuesto, que es {1-{1-[3-Fluoro-2-(trifluorometil)isonicotinoil]piperidin-4-il}-3-[4-(7H-pirrolo[2,3-d]pirimidin-4-il)-1H-pirazol-1-il]azetidin-3-il}acetonitrilo,…
Compuestos heterocíclicos tricíclicos sustituidos, del 22 de Abril de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de fórmula (I) **(Ver fórmula)** o un estereoisómero, un tautómero, una sal farmacéuticamente aceptable o un solvato del mismo, […]
Compuestos heterocíclicos útiles como inhibidores de TNF, del 22 de Abril de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de fórmula (I) **(Ver fórmula)** o un estereoisómero, un tautómero, una sal farmacéuticamente aceptable o un solvato del mismo, […]
Compuestos heterocíclicos tricíclicos útiles como inhibidores de TNF, del 22 de Abril de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de fórmula (I) **(Ver fórmula)** o un estereoisómero, un tautómero, una sal farmacéuticamente aceptable o un solvato del mismo, en donde: X […]