Polipéptidos de cetorreductasa para la producción de acetidinona.
Un polipéptido de cetorreductasa capaz de convertir el sustrato,
metil-2-benzamidometil-3-oxobutirato, al producto, 2S, 3R-metil-2-benzamidometil-3-hidroxibutirato, con un exceso estereomérico porcentual de por lo menos 60%, lo que comprende una secuencia de aminoácidos:
(i) que es por lo menos 85% idéntica a la secuencia referencial que se basa en la IDENTIFICACIÓN SECUENCIAL NÚMERO: 2, 4 o 86 teniendo las siguientes características: el residuo correspondiente a X 94 es treonina; el residuo correspondiente a X 199 es histidina y el residuo correspondiente a X 202 es valina o leucina; y
(ii) en la cual el residuo correspondiente a X 94 es alanina o treonina; el residuo correspondiente a X 199 es alanina, histidina o asparagina; y el residuo correspondiente a X 202 es valina o leucina.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/078513.
Solicitante: Codexis, Inc.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 200 Penobscot Drive Redwood City, CA 94063 ESTADOS UNIDOS DE AMERICA.
Inventor/es: MUNDORFF,EMILY, CAMPAPIANO,ONORATO, BORUP,BIRTHE, VOLADRI,RAMA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N9/04 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › actúan sobre grupos CHOH como dadores, p. ej. glucosa oxidasa de glucosa, deshidrogenasa láctica (1.1).
- C12P13/00 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › Preparación de compuestos orgánicos que contienen nitrógeno.
- C12P17/00 C12P […] › Preparación de compuestos heterocíclicos que contienen O, N, S, Se o Te como únicos heteroátomos del ciclo (C12P 13/04 - C12P 13/24 tienen prioridad).
- C12P17/10 C12P […] › C12P 17/00 Preparación de compuestos heterocíclicos que contienen O, N, S, Se o Te como únicos heteroátomos del ciclo (C12P 13/04 - C12P 13/24 tienen prioridad). › nitrógeno como único heteroátomo del ciclo.
PDF original: ES-2547528_T3.pdf
Fragmento de la descripción:
ANTECEDENTES
Las enzimas que pertenecen a la clase cetorreductasa (KRED) o carbonilo reductasa (EC1.1.1.184) son útiles para la síntesis de alcoholes ópticamente activos del sustrato correspondiente, cetona proestereoisomérica o los sustratos correspondientes aldehido racémicos. Los KREDs comúnmente convierten las cetonas y los sustratos aldehidos a sus correspondientes productos alcohólicos, pero también pueden catalizar la reacción reversa, la oxidación de un sustrato alcohólico al producto correspondiente de cetona/aldehído. La reducción de cetonas y aldehidos y la oxidación de alcoholes por enzimas tales como KRED requiere un cofactor, más comúnmente nicotinamida adenina dinucleótida reducida (NADH) o nicotidamina adenina dinucleótida fosfato reducida (NADPH), y nicotinamida adenina dinucleótida (NAD) o nicotinamida adenina dinucleótida fosfato (NADP) para la reacción de oxidación. NADH y NADPH sirve como donantes de electrones, mientras que NAD y NADP sirven como receptores de electrones. Se ha observado frecuentemente que las cetorreductasas y las deshidrogenasas de alcohol aceptan el cofactor no fosforilado (en su estado oxidado y reducido).
Las enzimas KRED pueden encontrarse en una variedad amplia de bacterias y levaduras (para mediciones: Kraus y Waldman, Enzyme catalysis in organic synthesis (Catálisis enzimática en síntesis orgánica) Vols. L y 2.VCH Weinheim 1995; Faber, K., Biotransformations in organic chemistry (Transformaciones biológicas en química orgánica), 4ta Ed. Springer, Berlín Heidelberg New York. 2000; Hummel y Kula, 1989, Eur. J. Biochem. (Bioquímica) 184:1-13). Varios genes KRED y secuencias enzimáticas han sido reportadas, por ejemplo, Candida magnoliae (Cuenta del Banco Genético Númeo. JC7338; Gl:11360538) Candida parapsilosis (Cuenta del Banco Genético Númeo BAA24528.1; GL2815409), Sporobolomyces salmonicolor (Cuenta del Banco Genético Númeo AF160799; GL6539734).
Para esquivar cualquier procedimiento sintético químico para la producción de compuestos clave, las cetorreductasas están siendo utilizadas más y más para la conversión enzimática de diferentes sustratos ceto y aldehidos para productos alcohólicos quirales. Estas aplicaciones pueden utilizar células enteras que expresan la cetorreductasa para reducciones cetonas biocatalíticas, o enzimas purificadas en aquellas instancias donde la presencia de varias cetorreductasas en células enteras que afectarían adversamente la estéreo - pureza y produciría el producto deseado. Para aplicaciones in - vitro, una enzima regeneradora y cofactor (NADH o NADPH) tal como la glucosa deshidrogenasa (GDH), formiato deshidrogenasa, etc. es utilizado en conjunto con la cetorreductasa. Ejemplos de usos de cetorreductasas para generar compuestos químicos útiles incluyen la reducción asimétrica de ésteres 4-cloroacetoacetatos (Zhou, J. Ant. Chem. Soc. 1983 105:5925-5926; Santaniello, J. Chem. Res. (S) 1984:132-133; Patente de Estados Unidos número. 5,559,030; Patente de Estados Unidos número. 5,700,670 y patente de Estados Unidos número 5,891,685), reducción de ácidos dicarboxílicos (por ejemplo, patente de Estados Unidos número. 6,399,339), reducción de tere - butil (S) cloro-5-hidroxi-3-oxohexanoato (por ejemplo, patente de Estados Unidos número 6,645,746 y WO 01/40450), reducción de compuestos que se basan en la pirrolotriacina (por ejemplo, la aplicación de Estados Unidos número 2006/0286646); la reducción de acetofenonas sustituidas (por ejemplo, la patente de Estados Unidos número 6,800,477); y la reducción cetotiolanos (WO 2005/054491).
Es deseable identificar otras enzimas cetorreductasas que pueden ser utilizadas para ejecutar conversiones de varios sustratos cetos a sus productos correspondientes alcohólicos quirales. Weckbecker et al. 2006 y Dau pmann et al. 2006 presenta enzimas cetorreductasas de lactobacilo. W02005/017135 presenta métodos de mutagénesis.
RESUMEN
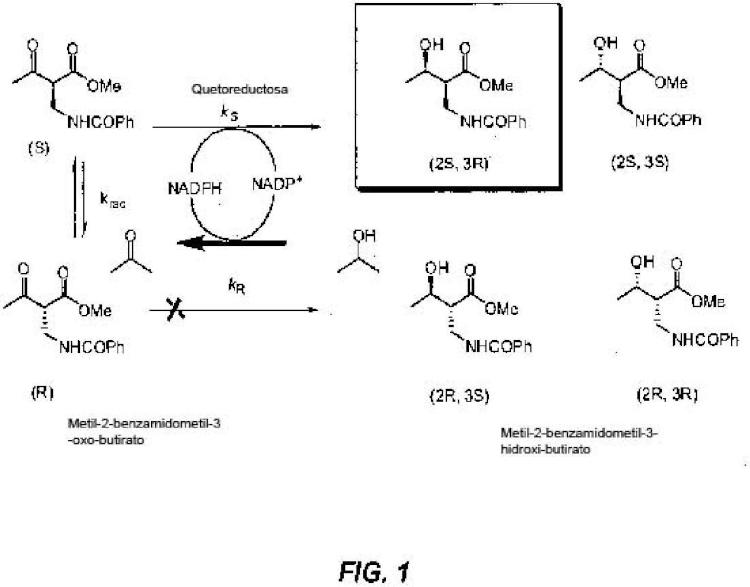
Esta presentación suministra polipéptidos cetorreductasas que tienen la habilidad de reducir una mezcla racémica de metil-2-benzamidometil-3-oxobutirato ("el sustrato") a 2S,3R-metil-2-benzamidometil-3-hidroxibutirato ("el producto"), la codificación de polinucleótidos tales como polipéptidos, y métodos para usar los polipéptidos. El compuesto 2S, 3R-metil-2-benzamidometil-3-hidroxibutirato es un intermediador de la síntesis de acetato de (2R, 3R)-3-((R)-1-(terc- butildimetilsililoxi)etil)-4-oxoacetidin-2-ilo ("acetidinona; acetioxiacetidininona"; registro CAS 76855-69-1), que es un intermediador (penúltimo intermediador) utilizado en la fabricación de varios antibióticos carbapenem. Los antibióticos carbapenem que pueden ser sintetizados de 2S,3R-metil-2-benzamidometil-3-hidroxibutirato incluyen, pero no se limitan a imipenem, meropenem, doripenem, ertapenem, biopenem, panipenem, y otros compuestos similares a la tienamicina. Los polipéptidos de cetorreductasa de esta presentación tienen una propiedad mejorada para reducir o convertir el sustrato especificado del producto alcohólico quiral correspondiente en comparación a las enzimas de cetorreductasa de tipo silvestre que ocurren naturalmente obtenidas del Lactobacilo kéfir ("L. kéfir"; IDENTIFICACIÓN SECUENCIAL NÚMERO: 4), Lactobacilo brevis ("L. brevis"; IDENTIFICACIÓN SECUENCIAL NÚMERO: 2), o Lactobacilo minor ("L. minor"; IDENTIFICACIÓN SECUENCIAL NÚMERO: 86). En algunas secciones, los polipéptidos de cetorreductasa diseñados tienen una propiedad mejorada en comparación con otros polipéptidos de cetorreductasa diseñados, tales como IDENTIFICACION SECUENCIAL NÚMERO: 48.
El invento suministra un polipéptido de cetorreductasa capaz de convertir el sustrato metil-2-benzamidometil-3- oxobutirato, al producto, 2S, 3R-metil-2-benzamidometil-3-hidroxibutirato, con un porcentaje de exceso estereomérico de por lo menos un 60%, que incluye una secuencia de aminoácidos que es por lo menos un 85% idéntica a una secuencia de referencia que se basa en la IDENTIFICACIÓN SECUENCIAL NÚMERO: 2, 4 u 86 que tiene las siguientes características: el residuo correspondiente a X94 es treonina; el residuo correspondiente a X199 es histidina y el residuo correspondiente a X202 es valina o leucina; con la condición que el polipéptido de cetorreductasa tenga una secuencia de aminoácidos en la cual el residuo correspondiente a X 94 es alanina o treonina; el residuo correspondiente a X 199 es alanina, histidina o asparagina; y el residuo correspondiente a X 202 es valina o leucina.
Este invento también suministra un polinucleótido que codifica a un polipéptido del invento.
El invento también suministra un vector de expresión que incluye el polinucleótido del invento vinculado en forma operacional a secuencias de control adecuadas para dirigir la expresión en una célula anfitriona.
El invento también suministra una célula anfitriona que incluye el vector de expresión del invento.
El invento suministra un compuesto que incluye una cetorreductasa del invento y el compuesto metil-2- benzamidometil-3-oxobutirato de la fórmula (I) o el compuesto 2S,3R-metil-2-benzamidometil-3-hidroxibutirato de la fórmula (II).
El invento también suministra un método para reducir el sustrato de la fórmula (I), metil-2-benzamidometil-3- oxobutirato, al producto de la fórmula (II), 2S,3R-metil-2-benzamidometil-3-hidroxibutirato, que se comprende de contactar o incubar el sustrato con un polipéptido de cetorreductasa del invento bajo condiciones de reacción adecuadas para reducir el sustrato del producto de la fórmula (II), y en el cual el producto está opclonalmente presente con un exceso estereomérico mayor que un 99%.
El invento también suministra un método para la síntesis del intermediador de la fórmula (IVa),
Donde R1 es H o un grupo protector del hidroxilo, y R10 es un halógeno, u -Oac, donde Ac es acetato,
Donde un paso en el método incluye contactar o reaccionar el sustrato de la fórmula (I) con las cetorreductasas del invento bajo condiciones de reacción adecuadas para reducir o convertir el sustrato del producto de la fórmula (II).
El invento también suministra un método para la síntesis del intermediador de la fórmula estructural (IX),
R10
**(Ver fórmula)**r1 o
(IVa)
**(Ver fórmula)**co2r4
Donde R2 es H o un alquilo C1-C4 (por ejemplo, -CH3); R3 es H, o un grupo protector del hidroxilo;
R4 es H, un grupo protector del carboxi, un grupo de amoníaco, un metal alcalino, o un metal alcalinotérreo; y X es OH o un grupo que abandona,
Donde un paso en el método incluye el contactar o reaccionar el sustrato de la fórmula (I) con las cetorreductasas del invento bajo condiciones de reacción adecuadas para reducir o convertir el sustrato al producto de... [Seguir leyendo]
Reivindicaciones:
1. Un polipéptido de cetorreductasa capaz de convertir el sustrato, metil-2-benzamidometil-3-oxobutirato, al producto, 2S, 3R-metil-2-benzamidometil-3-hidroxibutirato, con un exceso estereomérico porcentual de por lo menos 60%, lo que comprende una secuencia de aminoácidos:
(i) que es por lo menos 85% idéntica a la secuencia referencial que se basa en la IDENTIFICACIÓN SECUENCIA!. NÚMERO: 2, 4 o 86 teniendo las siguientes características: el residuo correspondiente a X 94 es treonina; el residuo correspondiente a X 199 es histidina y el residuo correspondiente a X 202 es valina o leucina; y
(ii) en la cual el residuo correspondiente a X 94 es alanina o treonina; el residuo correspondiente a X 199 es alanina, histidina o asparagina; y el residuo correspondiente a X 202 es valina o leucina.
2. El polipéptido de la declaración 1 en el cual el residuo correspondiente a X 94 es treonina.
3. El polipéptido de la declaración 1 o 2 en el cual la secuencia de aminoácidos de cetorreductasas tiene adicionalmente una o más de las siguientes características:
el residuo correspondiente a X2 es alanina; el residuo correspondiente a X4 es cisteína; el residuo correspondiente a X 11 es fenilalanina; el residuo correspondiente a X 40 es arginina; el residuo correspondiente a X 80 es treonina; el residuo correspondiente a X 86 es isoleucina; el residuo correspondiente a X 96 es valina o fenilalanina; el residuo correspondiente a X 105 es glicina; el residuo correspondiente a X 129 es treonina; el residuo correspondiente a X 147 es metionina o leucina; el residuo correspondiente a X 153 es alanina o serina; el residuo correspondiente a X 190 es histidina o prolina; el residuo correspondiente a X 195 es valina; el residuo correspondiente a X 196 es leucina; el residuo correspondiente a X 206 es fenilalanina; el residuo correspondiente a X 226 es valina; el residuo correspondiente a X 248 es lisina o arginina; el residuo correspondiente a X 249 es triptófano;
donde opcionalmente la secuencia de aminoácidos tiene uno o más diferencias de residuos en otras posiciones residuales de aminoácidos en comparación de la secuencia referencial.
4. El polipéptido de la declaración 1, que comprende una secuencia de aminoácidos correspondiente de las IDENTIFICACIONES SECUENCIALES NÚMEROS: 6, 8, 10, 12, 20, 22, 24, 30, 32, 34, 36, 38, 40, 42, 50, 56, y 58.
5. El polipéptido de la declaración 1, que es:
a) capaz de convertir el sustrato al producto con un exceso estereomérico porcentual de por lo menos 90%, y que opcionalmente comprende una secuencia de aminoácidos correspondiente a la IDENTIFICACIÓN SECUENCIAL NÚMERO: 6, 8, 10, 12, 20, 22, 24, 30, 32, 34, 36, 40, 42, 50, 56, o 58;
b) Capaz de convertir el sustrato al producto con un exceso estereomérico porcentual de por lo menos 95%, y que opcionalmente comprende una secuencia de aminoácidos correspondiente a la IDENTIFICACIÓN SECUENCIAL NÚMERO: 6, 8, 10, 12, 20, 22, 24, 30, 32, 34, 42, 50, 56, o 58; o
c) Capaz de convertir el sustrato al producto to con un exceso estereomérico porcentual de por lo menos el 99%, y que opcionalmente comprende una secuencia de aminoácidos correspondiente a la IDENTIFICACIÓN SECUENCIAL NÚMERO: 6, 8, 10, 12, 20, 22, 24, 30, 32, o 34.
6. El polipéptido de la declaración uno, que es;
a) capaz de convertir el sustrato al producto to a una tasa que es por lo menos 15 veces mayor que el polipéptido referencial de la IDENTIFICACIÓN SECUENCIAL NÚMERO: 48, y que opcionalmente comprende una secuencia de aminoácidos correspondiente a la IDENTIFICACIÓN SECUENCIAL NÚMERO: 6, 8, 10, 12, 20, 22, 24, 30, 32, 34, o 50; o
b) capaz de convertir el sustrato al producto a una tasa que es por lo menos 30 veces mayor que la del péptido referencial de la IDENTIFICACIÓN SECUENCIAL NÚMERO: 48, y que opcionalmente comprende una secuencia de aminoácidos correspondiente a la IDENTIFICACIÓN SECUENCIAL NÚMERO: 6, 8, 10, 12, 20, 22, 24, 30, o 34; o
c) Capaz de convertir el sustrato al producto a una tasa que es por lo menos 40 veces mayor que la
del polipéptido referencial de la IDENTIFICACIÓN SECUENCIAL NÚMERO: 48, y que opcionalmente
comprende una secuencia de aminoácidos correspondiente a las IDENTIFICACIONES SECUENCIALES NÚMERO: 6, 8, 10, 12, y 22; o
d) Capaz de convertir el sustrato al producto a una tasa que es por lo menos 50 veces mayor que la
del polipéptido referencial de la IDENTIFICACIÓN SECUENCIAL NÚMERO: 48, y que opcionalmente
comprende una secuencia de aminoácidos correspondiente a las IDENTIFICACIONES SECUENCIALES NÚMEROS: 6, 8, 10, y 12.
7. Un polinucleótido que codifica a un polipéptido de acuerdo a cualquiera de las declaraciones 1 - 6, y que opcionalmente tiene una secuencia correspondiente a la IDENTIFICACIÓN SECUENCIAL NÚMERO: 5, 7, 9, 11, 19, 21,23, 29, 31,33, 35, 37, 39, 41,49, 55 o 57.
8. Un vector de expresión que comprende el polinucleótido de la declaración 7 vinculado operacionalmente a secuencias de control adecuadas para dirigir la expresión en una célula anfitriona.
9. Una célula anfitriona que contiene el vector de expresión de la declaración 8.
10. Una composición que comprende una cetorreductasa de cualquiera de las declaraciones 1 - 6 y el compuesto metil-2-benzamidometil-3-oxobutirato de la fórmula (I) o el compuesto 2S,3R-metil-2-benzamidometil-3- hidroxibutirato de la fórmula (II).
11. La composición de la declaración 10 en la cual el sustrato es el compuesto de la fórmula (I) y el compuesto de la fórmula (II).
12. Un método para reducir el sustrato de la fórmula (I), metil-2-benzamidometil-3-oxobutirato, al producto de la fórmula (II), 2S,3R-metil-2-benzamidometil-3-hidroxibutirato, que comprende el contactar o incubar el sustrato con un polipéptido de cetorreductasa de cualquiera de las declaraciones 1 - 6 bajo condiciones de reacción adecuadas para reducir el sustrato al producto de la fórmula (II), y donde el producto está opcionalmente presente de con un exceso estereomérico mayor que un 99%.
13. Un método para la síntesis del intermediador de la fórmula (IVa).
R10
**(Ver fórmula)**(IVa)
Dónde R1 es H o un grupo protector de hidroxilos, y R 10 es un halógeno, u -Oac, donde Ac es acetato, donde un paso del método comprende contactar o reaccionar el sustrato de la fórmula (I) con las cetorreductasas de cualquiera de las declaraciones 1 - 6 bajo condiciones de reacción apropiadas para reducir o convertir el sustrato al producto de la fórmula (II).
14. Un método para la síntesis del intermediador de la fórmula estructural (IX),
**(Ver fórmula)**(IX)
Donde R2 es H o alquilo C1-C4 (por ejemplo, -CH3); R3 es H, o un grupo protector de hidroxilos; R4 es H, un grupo protector de carboxis, un grupo amoníaco, un metal alcalino o un metal alcalinotérreo,
Donde un paso en el método incluye contactar o reaccionar el sustrato de la fórmula (I) con las cetorreductasas de cualquiera de las declaraciones 1-6 bajo condiciones de reacción apropiadas para reducir o convertir el sustrato al producto de la fórmula (II).
Un método para la síntesis de un carbapenem de la fórmula estructural (V):
**(Ver fórmula)**(V)
O sus solvatos, hidratos, sales y pro - medicamentos, donde R2 es H o -CH3; R5 es seleccionado de un alquilo sustituido o no sustituido, un arilo sustituido o no sustituido, un heteroalquilo sustituido o no sustituido, un heterocicloalquilo sustituido o no sustituido, un heteroariloalquilo sustituido o no sustituido; y R6 es H o un progrupo,
donde un paso en el método incluye el contactar o reaccionar el sustrato de la fórmula (I) con las cetorreductasas de cualquiera de las declaraciones 1 - 6 bajo condiciones de reacción apropiadas para reducir o convertir el sustrato al producto de la fórmula (II).
El método de la declaración 15 donde:
a) El carbapenem tiene la fórmula estructural (X):
**(Ver fórmula)**(X);o
b) El carbapenem tiene la fórmula estructural (XI):
**(Ver fórmula)**c) El carbapenem tiene la fórmula estructural (XII):
**(Ver fórmula)**d) El carbapenem tiene la fórmula estructural (XIII):
**(Ver fórmula)**
Patentes similares o relacionadas:
Método para la síntesis de pentostatina, del 4 de Septiembre de 2019, de Synbias Pharma AG: Método para la síntesis estéreo-selectiva de pentostatina, que comprende: (i) hacer reaccionar 6,7-dihidroimidazo-[4,5-d]-[1,3]diazepin-8(3H)-ona […]
Uso de fosfocetolasa y fosfotransacetilasa para la producción de compuestos derivados de acetil-coenzima A, del 30 de Enero de 2019, de Amyris, Inc: Una célula huésped de levadura modificada genéticamente que comprende: (a) un ácido nucleico heterólogo que codifica una fosfocetolasa (PK; EC 4.1.2.9); (b) un ácido […]
Enzima de fosforilación de un fármaco, del 25 de Febrero de 2013, de DAIICHI SANKYO COMPANY, LIMITED: Un procedimiento de detección selectiva de una sustancia fosforilada por la FN3KRP humana y/o la FN3Khumana, que comprende las etapas siguientes a : […]
DERIVADOS DE MACROLACTONA, del 13 de Julio de 2011, de SANOFI-AVENTIS: Compuesto de la fórmula (I) **Fórmula** en la que X e Y, independientes uno del otro, son OH, O-(C1-C6)-alquilo, NH2 o NH-(C1-C6)-alquilo, o X e Y forman juntos […]
PROCEDIMIENTO PARA LA OBTENCIÓN DE (1S)-3-CLORO-1-(2-TIENIL)-PROPAN-1-OL ÓPTICAMENTE ACTIVO, del 3 de Febrero de 2011, de BASF SE: Procedimiento para la obtención de (1S)-3-cloro-1-(2-tienil)-propan-1-ol ópticamente activo de la fórmula I **Fórmula** llevándose a cabo la reducción de la 3-cloro-1-(2-tienil)-propan-1-ona […]
NUEVAS DESHIDROGENASAS, Y UN METODO PARA LA PRODUCCION DE ALCANOLES OPTICAMENTE ACTIVOS, del 13 de Septiembre de 2010, de BASF SE: Método para la producción microbiológica de alcanoles sustituidos de la fórmula I
METODO PARA LA PRODUCCION DE ALCOHOLES OPTICAMENTE ACTIVOS A PARTIR DE ALCANONAS MEDIANTE EL EMPLEO DE UNA DESHIDROGENASA DE AZOARCUS, del 11 de Noviembre de 2009, de BASF SE: Método para la producción de alcanoles ópticamente activos de la fórmula I ** ver fórmula** donde n representa un valor numérico entero de 0 a 5; Cyc representa […]
 PROCESO PARA LA PREPARACION DE FORMAS ENANTIOMERICAS DE DERIVADOS DEL ACIDO CIS-3-HIDROXICICLOHEXANOCARBOXILICO MEDIANTE LA UTILIZACION DE HIDROLASAS, del 20 de Agosto de 2009, de SANOFI-AVENTIS DEUTSCHLAND GMBH: Procedimiento para preparar compuestos quirales no racémicos de fórmulas (Ia) y (Ib) ** ver fórmula** con R1 ** ver fórmula** en donde significan: R 3 H, alquilo […]
PROCESO PARA LA PREPARACION DE FORMAS ENANTIOMERICAS DE DERIVADOS DEL ACIDO CIS-3-HIDROXICICLOHEXANOCARBOXILICO MEDIANTE LA UTILIZACION DE HIDROLASAS, del 20 de Agosto de 2009, de SANOFI-AVENTIS DEUTSCHLAND GMBH: Procedimiento para preparar compuestos quirales no racémicos de fórmulas (Ia) y (Ib) ** ver fórmula** con R1 ** ver fórmula** en donde significan: R 3 H, alquilo […]