Antígenos asociados a endometriosis.
Una molécula de anticuerpo que se une a la isoforma ED-A de la fibronectina para su uso en un método de diagnóstico de la endometriosis,
en donde el método de diagnóstico de la endometriosis comprende las etapas de:
(a) administrar la molécula de anticuerpo al ser humano o animal, y
(b) determinar la presencia o ausencia de la molécula de anticuerpo en los sitios de la endometriosis del cuerpo humano o animal;
en donde la localización de la molécula de anticuerpo en los sitios de la endometriosis indica la presencia de endometriosis.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2009/009282.
Solicitante: PHILOGEN S.P.A..
Nacionalidad solicitante: Italia.
Dirección: PIAZZA LA LIZZA, 7 53100 SIENA ITALIA.
Inventor/es: SCHWAGER,KATHRIN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K47/48
- C07K16/18 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra materiales animales o humanos.
PDF original: ES-2549362_T3.pdf

Fragmento de la descripción:
Antígenos asociados a endometriosis La presente invención se refiere a la detección y tratamiento de la endometriosis. La invención implica el uso de una molécula de anticuerpo que se une a la isoforma ED-A de la fibronectina, especialmente una molécula de anticuerpo que se une al dominio ED-A de la fibronectina, o una molécula de anticuerpo que se une a la tenascina-C, especialmente al dominio A1, A2, A3, A4 y / o B dominio D de tenascina C (la "forma larga" de la tenascina-C) .
La mayoría de los productos farmacéuticos convencionales en uso actualmente para el tratamiento de enfermedades relacionadas con la angiogénesis (tales como cáncer, artritis, etc.) no se acumulan selectivamente en el sitio de la enfermedad [Bosslet et al., 58, 1195-1201 Cancer Res. (1998) ]. Por ejemplo, los fármacos administrados por vía intravenosa se distribuyen uniformemente dentro de los diferentes órganos y tejidos del cuerpo, en lugar de acumularse selectivamente en el sitio de la enfermedad.
Un enfoque para eludir las desventajas de las terapias farmacológicas convencionales implica la liberación preferente de un agente bioactivo en el sitio del tumor por medio de una molécula de unión específica de un marcador asociado a una patología [Neri & Bicknell (2005) Nature Rev. Cancer]. La focalización selectiva del fármaco hacia el tejido enfermo tiene como resultado, en última instancia, un aumento de la concentración local en su sitio de acción, evitando a los órganos normales los efectos tóxicos del agente bioactivo utilizado para conferir un beneficio farmacológico (por ejemplo, un fármaco citotóxico, una citocina, un radionúclido, un fotosensibilizador) . En la mayoría de los casos, esto dará lugar a un índice terapéutico mejorado del producto farmacéutico liberado, es decir, una mayor eficacia con efectos secundarios minimizados. De hecho, el perfil de toxicidad favorable de las terapéuticas específicas del lugar puede abrir nuevas vías en la terapia de las enfermedades relacionadas con la angiogénesis, lo que permite la administración sistémica de agentes altamente potentes y prometedores, que actualmente se administran a dosis subóptimas o cuya aplicación clínica ha estado, hasta la fecha, dificultada por toxicidades inaceptables cuando se aplica en una forma no modificada.
Las estrategias de liberación farmacológica basada en ligandos fundamentalmente se basan en la identificación de marcadores de buena calidad de la patología, lo que permite una discriminación clara entre tejidos enfermos y órganos sanos. Los anticuerpos monoclonales y sus fragmentos representan los agentes preferidos para aplicaciones de liberación farmacológica [Rybak et al. 2, 22-40 Chem. Med. Chem (2007) ; Shrama et al., 5, 147-159 Nat. Rev. Drug Discover y (2006) ], a pesar de que los mutantes de la proteína globular [Binz y Plückthun, 23, 12571268 Nature Biotechnology (2005) ], péptidos [Sergeeva et al., 58, 1622-1654, Adv. Drug. Deliv. Rev. (2006) ] e incluso pequeños ligandos orgánicos [Low et al., 41, 120-129, Acc. Chem. Res. (2008) ] se utilizan cada vez más. La mayoría de los esfuerzos en el campo de la focalización hacia la enfermedad se han realizado utilizando marcadores específicos expresados en la superficie de las células enfermas (por ejemplo, en la superficie de las células tumorales en el cáncer) . Sin embargo, dirigir los antígenos a las mismas células enfermas es una tarea compleja para los agentes de transmisión sanguínea, frente a una serie de barreras físicas y cinéticas, que pueden impedir una liberación de fármacos eficiente. Estas barreras incluyen la presión intersticial en el sitio de la enfermedad, las distancias de difusión relativamente largos dentro del intersticio, la heterogeneidad de los antígenos en los sitios de la enfermedad, así como la denominada "barrera antígeno" [Dennis et al., 67, 254-261, Cancer Res. (2007) ]. Todos estos factores perjudican significativamente la penetración en las zonas profundas del tejido.
Las proteínas que se expresan alrededor de los vasos sanguíneos patológicos en los sitios de la enfermedad, pero que están ausentes o presentes en niveles reducidos en el tejido normal, representan objetivos particularmente atractivo para el desarrollo de estrategias de liberación de fármacos selectivas y eficientes [Rybak et al. (2007) ChemMedChem; Trachsel et al., 9, R9, Arthritis Res. Ther. (2007) ]. Las dianas vasculares son a menudo más fácilmente accesible desde el torrente sanguíneo a los agentes administrados por vía sistémica, superando el problema de acceso y permitiendo una liberación eficaz del compuesto en el lugar de la enfermedad. Además, el mismo agente vascular dirigido podría ser útil no sólo para la liberación de agentes terapéuticos, sino también para aplicaciones de imágenes moleculares.
Tal como se utiliza en el presente documento, el término "reconocimiento vascular" no se utiliza para indicar la inhibición de la molécula diana en una vía de señalización (por ejemplo, la inhibición de la señalización de VEGF por bevacizumab o por la inhibición de la quinasa BCR / ABL por imatinib) . En su lugar, la molécula diana expresada en la vasculatura en los sitios de las enfermedades relacionadas con la angiogénesis se utiliza como un sitio de unión de fácil acceso para ligandos específicos, explotando la vasculatura como un armazón para lograr una localización específica del sitio de las moléculas efectoras en el tejido tumoral. Esta diferencia conceptual fundamental queda clara por el hecho de que, mientras que algunas moléculas marcadoras vasculares han demostrado ser muy adecuadas para aplicaciones de reconocimiento tumores dirigidos por ligandos, su papel fisiopatológico es todavía en gran parte desconocido (por ejemplo, el dominio adicional B de la fibronectina; véase más adelante) .
Los presentes inventores han realizado previamente una amplia labor en la focalización basada en anticuerpos de marcadores de la angiogénesis tumoral, tal como el dominio adicional B de la fibronectina (ED-B) [Schliemann y Neri, 1776, 175-192, Biochim Biophys Acta (2008]. El ED-B es prácticamente indetectable en los tejidos adultos
normales, con excepción del endometrio en la fase proliferativa, pero se sobreexpresa en afecciones que afectan a la remodelación tisular, con un patrón de tinción perivascular prominente. Tres derivados de del anticuerpo anti-EDB humano L19 [Pini et al. (1998) J. Biol. Chem.] Se están investigando actualmente en ensayos clínicos en fase I y en fase II para el tratamiento del cáncer (el producto radiomarcado L19-131I y las inmunocitocinas L19-IL2 y L19-TNF) . La capacidad de L19 para localizar selectivamente en los sitios angiogénicos en enfermedades no tumorales se ha estudiado en modelos animales de neovascularización ocular [Birchler et al. 17, 984-988, Nature Biotechnology (1999) ], artritis reumatoide [Trachsel et al., 9, R9, Arthritis Res. Ther. (2007) ], psoriasis [Trachsel et al., 127, 881-886,
J. Inv. Dermatol. (2007) ] y aterosclerosis [Matter et al., 95, 1225-1233 Circulation Res. (2004) ].
Más recientemente, los presentes inventores han estudiado otros dominios de corte y empalme alternativamente de componentes de la matriz extracelular, cuyos patrones de expresión no están tan bien caracterizados y que hasta el momento se han utilizado principalmente como dianas vasculares para aplicaciones dirigidas a tumores: el dominio ED-A de la fibronectina [Rybak et al., 67, 10948-10957 (2007) Cancer Res.] y el dominio A1 de la tenascina-C [Brack et al., 12, 3200-3208, (2006) Clin. Cancer Res.]. ED-A es reconocido específicamente por el anticuerpo monoclonal humano F8 [Villa et al., 122, 2405-2413 (2008) Int. J. Cancer], mientras que el anticuerpo monoclonal humano F16 se une el dominio A1 de LA tenascina-C [Brack et al. (2006) Clin. Cancer Res.].
El patrón de expresión de los dominios adicionales A1, A2, A3, A4, B y D de la tenascina-C son similares, siendo casi indetectables en los tejidos adultos normales, pero están fuertemente regulados por aumento en una multitud de diferentes tumores [Brack et al. (2006) Clin. Farrell, y col., Cancer Res. (2008) Lung Cancer, en prensa; Berndt et al., 132, 537-546, J Cancer Res Clin Oncol (2006) ; Balza et al., 261, 175-178, FEBS Lett. (1990) ]. La expresión "isoforma grande de la tenascina A" se utiliza a menudo para indicar la forma de la tenascina C que contiene los dominios adicionales A1, A2, A3, A4, B y D [Borsi et al., 270, 6243-6245 (1995) J. Biol. Chem.; Borsi et al., 66, 632635 (1996) Int. J. Cancer; Carnemolla et al., 154, 1345-1352 (1999) Am. J. Pathol.]. Por el contrario, la expresión del dominio adicional C de la tenascina-C está más restringida, siendo indetectable en los tejidos adultos normales y se... [Seguir leyendo]
Reivindicaciones:
1. Una molécula de anticuerpo que se une a la isoforma ED-A de la fibronectina para su uso en un método de diagnóstico de la endometriosis, en donde el método de diagnóstico de la endometriosis comprende las etapas de:
(a) administrar la molécula de anticuerpo al ser humano o animal, y
(b) determinar la presencia o ausencia de la molécula de anticuerpo en los sitios de la endometriosis del cuerpo humano o animal; en donde la localización de la molécula de anticuerpo en los sitios de la endometriosis indica la presencia de endometriosis.
2. Una molécula de anticuerpo que se une a la isoforma ED-A de la fibronectina para su uso en un método de formación de imágenes del tejido endometrial, en donde el método comprende las etapas de:
(a) administrar la molécula de anticuerpo al ser humano o animal, y
(b) detectar la unión de la molécula de anticuerpo a tejido endometrial en el cuerpo humano o animal.
3. Una molécula de anticuerpo que se une la isoforma del dominio extra-A (ED-A) de la fibronectina para su uso en un método de tratamiento de la endometriosis.
4. Una molécula de anticuerpo que se une a la isoforma de ED-A de la fibronectina para su uso en un método de proporcionar a la neovasculatura de tejido endometrial una molécula conjugada con la molécula de anticuerpo, en donde el método comprende administrar el conjugado al ser humano o animal.
5. La molécula de anticuerpo para su uso de acuerdo con las reivindicaciones 3 o 4, en donde la molécula de anticuerpo está conjugada a una molécula bioactiva, tal como una citocina, una hormona, un radioisótopo terapéutico o un fármaco citotóxico, y en donde la molécula bioactiva está opcionalmente conjugada con la molécula de anticuerpo mediante un enlazador escindible.
6. La molécula de anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones anteriores, en donde molécula de anticuerpo se une a la ED-A de la fibronectina.
7. La molécula de anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones 1 a 4 o 6, en donde la molécula de anticuerpo está conjugada con un marcador detectable.
8. La molécula de anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones 1 a 4 o 6, en donde la molécula de anticuerpo está conjugada con un radioisótopo.
9. La molécula de anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones anteriores, en donde la molécula de anticuerpo comprende un dominio VH que comprende un marco y un conjunto de regiones de determinantes de complementariedad HCDR1, HCDR2 y HCDR3, en donde HCDR1 tiene una secuencia de aminoácidos de SEC ID Nº 42, HCDR2 tiene una secuencia de aminoácidos de SEC ID Nº 56, HCDR3 tiene una secuencia de aminoácidos de SEC ID Nº 60;
o en donde el dominio VH comprende un conjunto de regiones determinantes de la complementariedad que tienen diez o menos sustituciones de aminoácidos dentro de las regiones determinantes de complementariedad HCDR1, HCDR2 y HCDR3.
10. La molécula de anticuerpo para su uso de acuerdo con la reivindicación 9, en donde el marco del dominio VH es un marco de la línea germinal humana, y en donde el dominio VH tiene opcionalmente una secuencia de aminoácidos SEC ID Nº 14 o 16.
11. La molécula de anticuerpo para su uso de acuerdo con las reivindicaciones 9 o 10, en donde la molécula de anticuerpo comprende además un dominio VL que comprende un conjunto de regiones determinantes de complementariedad LCDR1, LCDR2 y LCDR3 y un marco.
12. La molécula de anticuerpo para su uso de acuerdo con la reivindicación 11, en donde LCDR1 tiene una secuencia de aminoácidos de SEC ID Nº 102, LCDR2 tiene una secuencia de aminoácidos de SEC ID Nº 114, y LCDR3 tiene una secuencia de aminoácidos de SEC ID Nº 118;
o en donde el dominio VL comprende un conjunto de regiones determinantes de la complementariedad que tienen diez o menos sustituciones de aminoácidos dentro de las regiones determinantes de complementariedad LCDR1, LCDR2 y LCDR3.
13. La molécula de anticuerpo para su uso de acuerdo con las reivindicaciones 11 o 12, en donde el marco del dominio VL es un marco de la línea germinal humana, y en donde el dominio VL tiene opcionalmente una secuencia
de aminoácidos SEC ID Nº 76 o 78.
14. La molécula de anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones 11-13, en donde la molécula de anticuerpo comprende un Fv de cadena sencilla, y en donde la molécula de anticuerpo es opcionalmente una inmunoproteína (SIP) pequeña.
15. La molécula de anticuerpo para su uso de acuerdo con una cualquiera de las reivindicaciones 11-13, en donde la molécula de anticuerpo es un diacuerpo.
Figura 1
Figura 2
Figura 3
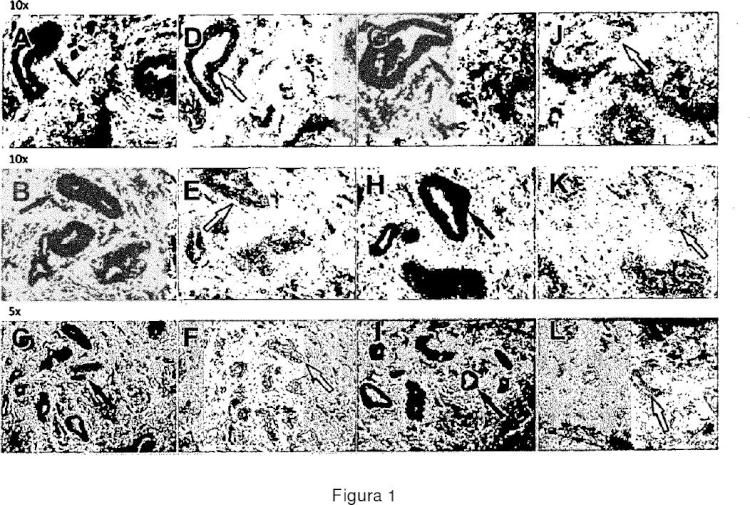
Figura 4
Figura 5
Figura 10 Figura 11
Patentes similares o relacionadas:
Anticuerpos anti-alfa-sinucleína y procedimientos de uso, del 29 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un anticuerpo anti-alfa-sinucleína humana que comprende (a) HVR-H1 que comprende la secuencia de aminoácidos de SEQ ID NO: 21; (b) HVR-H2 que […]
Terapia basada en anticuerpos de la amiloidosis por transtiretina (TTR) y anticuerpos de origen humano para ese propósito, del 22 de Julio de 2020, de Neurimmune Holding AG: Un anticuerpo anti-transtiretina (TTR) de origen humano o un fragmento de unión a antígeno del mismo, que es capaz de unirse a especies de TTR mutadas, mal plegadas, […]
Polipéptidos biparatópicos antagonistas de la señalización WNT en células tumorales, del 15 de Julio de 2020, de Boehringer Ingelheim International GmbH & Co. KG: Un polipéptido que se une específicamente a LRP5 o LRP6, que comprende - un primer dominio variable individual de inmunoglobulina seleccionado del grupo de dominios […]
PTPRS y proteoglicanos en enfermedad autoinmune, del 15 de Julio de 2020, de LA JOLLA INSTITUTE FOR ALLERGY AND IMMUNOLOGY: Una proteína recombinante no enzimática que comprende una secuencia de aminoácidos de un dominio extracelular de PTPRS, donde la proteína comprende tanto el dominio 1 (Ig1) […]
Redirectores de células T específicas de antígenos, del 1 de Julio de 2020, de THE JOHNS HOPKINS UNIVERSITY: Una nanoparticula que comprende en su superficie: (A) un anticuerpo que se une especificamente a un antigeno de celula diana o epitopo del mismo; y (B) un resto […]
Anticuerpos scFv que pasan las capas epitelial y/o endotelial, del 1 de Julio de 2020, de ESBATech, an Alcon Biomedical Research Unit LLC: Un anticuerpo monocatenario (scFv) que comprende: (a) un dominio variable de la cadena ligera (VL) que tiene tres regiones CDR de VL no […]
Terapia de combinación para tratamiento de enfermedad, del 24 de Junio de 2020, de Mereo BioPharma 5, Inc: Un anticuerpo antagonista del ligando 4 tipo delta (DLL4) para su uso en un procedimiento para tratar el cáncer, inhibir el crecimiento tumoral, mejorar […]
Formulación anti-IFNAR1 estable, del 24 de Junio de 2020, de ASTRAZENECA AB: Una formulacion de anticuerpo que comprende: a. De 100 mg/ml a 200 mg/ml de anifrolumab; b. Lisina HCl 40 mM a 60 mM; c. Trehalosa […]