Regiones de escisión KEX2 de proteínas de fusión recombinantes.
Un constructo de ADN de fusión que codifica un polipéptido de fusión que comprende en unión operable desde el extremo 5' de dicho constructo,
un promotor;
una primera molécula de ADN que codifica una secuencia señal funcional como una secuencia secretora en una célula fúngica filamentosa; una segunda molécula de ADN que codifica una proteína portadora, donde la proteína portadora es un polipéptido fúngico secretado de manera natural o una porción funcional del mismo;
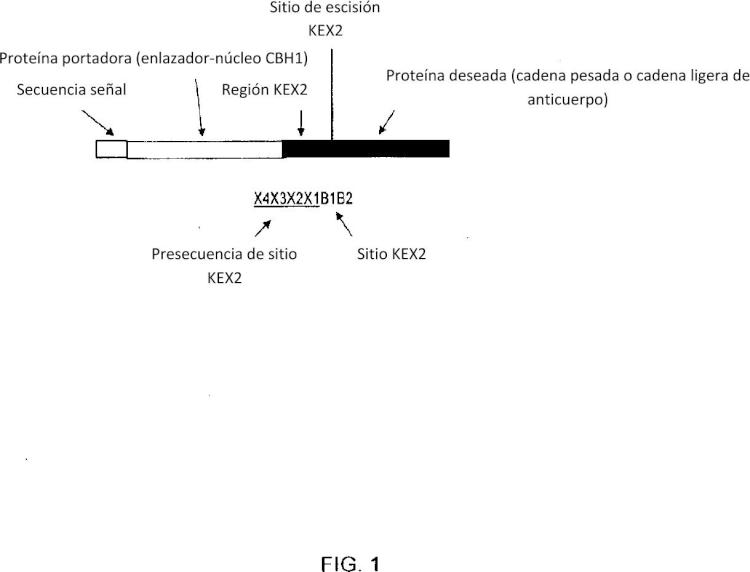
una tercera molécula de ADN que codifica una región KEX2, donde la región KEX2 es VAVEKR; y
una cuarta molécula de ADN que codifica una proteína deseada.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/014476.
Solicitante: DANISCO US INC.
Inventor/es: WARD, MICHAEL, WANG,HUAMING.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N15/09 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Tecnología del ADN recombinante.
PDF original: ES-2523898_T3.pdf

Fragmento de la descripción:
Regiones de escisión KEX2 de proteínas de fusión recombinantes
DECLARACIÓN SOBRE LOS DERECHOS DE LAS INVENCIONES REALIZADAS BAJO INVESTIGACIÓN Y DESARROLLO PATROCINADOS POR EL GOBIERNO FEDERAL
[1] Partes de este trabajo han sido financiadas mediante el Contrato n° W911NF-5-C-72 por la Agencia para Proyectos de Investigación Avanzada en Defensa (DARPA) de los Estados Unidos. Por consiguiente, el Gobierno de los Estados Unidos puede gozar de ciertos derechos en esta invención.
CAMPO DE LA INVENCIÓN
[2] La presente invención hace referencia a una secreción y escisión aumentada de proteínas deseadas, como proteínas de anticuerpos funcionales y enzimas industriales a partir de hongos filamentosos. La invención revela constructos de ADN de fusión, vectores y polipéptidos de fusión que incorporan regiones KEX2 para la escisión de proteínas y métodos de producción de las proteínas deseadas.
ANTECENDENTES
[3] Durante la secreción de proteínas en una célula fúngica, determinadas proteínas se escinden mediante KEX2, un miembro de la familia KEX2 o familia "kexina" de serina peptidasa (EC 3.4.21.61). KEX2 es una endopeptidasa calcio-dependiente altamente específica que escinde el enlace peptídico que es inmediatamente C-terminal con respecto a un par de aminoácidos básicos (es decir, el "sitio KEX2") en un sustrato de proteínas durante la secreción de esa proteína. Las proteínas KEX2 contienen generalmente un residuo de cisteína cerca del residuo de histidina de su sitio activo y son inhibidas mediante p-mercuribenzoato. El miembro fundador de este grupo, la peptidasa KEX2 de S. cerevisiae (Fuller et al., 1989, Proc. Nati. Acad. Sc¡. USA 86:1434-1438), escinde los precursores de toxina killer y feromona factor a durante su secreción.
[4] Se ha informado de la producción de polipéptidos de fusión en varios organismos que incluyen E. coli, levadura y hongos filamentosos. Por ejemplo, se ha producido quimosina bovina en Aspergillus niger como una fusión a glucoamllasa de longitud completa (GAI) (Ward et al., (199) Bio/technology 8:435 - 44; USP 6.265.24 y USP 6.59.78); se ha producido ¡nterleucina 6 humana (hlL6) en Aspergillus nidulans como una fusión a glucoamllasa de A. niger de longitud completa (GAI) (Contreras et al., (1991) Biotechnology 9:378 - 381); lisozlma de clara de huevo de gallina (Jeenes et al., (1993) FEMS Microbiol. Lett. 17:267 - 273) y lactoferrina humana (Ward et al., (1995) Blo/Technology 13:498 -53) se han producido en Aspergillus niger como una fusión a los residuos 1 - 498 de glucoamllasa; y se ha producido quimosina bovina en Aspergillus niger como una fusión con alfa-amllasa nativa de longitud completa (Korman et al., (199) Curr. Genet. 17: 23-212) y en Aspergillus oryzae como una fusión con formas truncadas de glucoamllasa de A. oryzae (Tsuchiya et al., (1994) Bioscl. Blotech. Blochem. 58: 895 - 899). Se hace referencia también a Shoemaker et al., 1981 Bio/Technology 1: 691 -696; Nunberg et al, (1984) Mol. Cell. Biol. 4:236 - 2315 y Boel et al, (1984) EMBO J. 3:197 - 112. En algunas de estas proteínas de fusión, se inserta un sitio de reconocimiento de proteasa KEX2 (Lys-Arg) entre una glucoamllasa y una proteína deseada (p.ej, Contreras et al., 1991 y Ward et al, 1995). Los inventores de la presente Invención han descubierto que la secreción de proteína y/o escisión de proteína puede mejorarse en una proteína de fusión cuando el sitio de reconocimiento KEX2 ha sido manipulado para incluir una presecuencia de sitio KEX2 de aminoácidos.
[5] La literatura específica de Interés incluye: Ward et al, (24) Appl. Envlron. Microbiol. 7:2567-2576; Goller et al,(1998) Appl. Envlron. Microbiol. 64:322-328; La Grange et al, (1996) Appl. Environ. Microbiol. 62:136-144; Bergquist et al, (22) Biochem. Biotechnol. 1:165-176; Spencer et al, (1998) Eur. J. Biochem. 258:17-112; Jalvlng et al, (2) Appl. Environ. Microbiol. 66:363 - 368); Brenner y Fuller (1992) Proc. Nati. Acad. Sel. 89:922-926; Durand et al, (1999) Appl. Microbiol. Biotechnol. 52: 28-214; Ahn et al, (24) Appl. Microbiol. Biotechnol. 64:833-839; Gouka et al, (1997) Appl Microbiol Biotechnol. 47:1-11 Broekhuijsen et al, (1993) J. Biotechnol. 31:135-145; MacKenzie et al, (1998) J. Biotechnol. 63:137 - 146 y las solicitudes de patente publicadas 2418573 y 25158825. También USP 4.816.567 y USP 6.331.415 revelan procesos para producir moléculas de inmunoglobulina en células huésped recomblnantes. WO 1/18218 describe el uso de la señal de secreción de xilanasa II para aumentar la expresión y secreción de una proteína de interés. WO 9/175 describe la expresión de polipéptidos de fusión en levadura. Mlkosch et al. (Journal of Biotechnology 52 (1996) 97-16) revela la secreción de inhibidor de protelnasa de la mucosa humana activa mediante Aspergillus nigerias el procesamiento similar a KEX2 de una proteína de fusión de ¡nhlbldor-glucoamilasa.
Aunque hay numerosos métodos disponibles para la producción de enzimas industriales y proteínas terapéuticas, continúa existiendo una necesidad de métodos alternativos para la producción de proteínas y específicamente para la producción de proteínas terapéuticas, como producción de anticuerpos, lo que resultará en un tiempo de aumento de escala relativamente rápido y altos niveles de proteína producida con riesgo limitado de contaminación mediante agentes virales u otros agentes extraños. La presente invención responde a
esta necesidad.
SUMARIO DE LA INVENCIÓN
[6] Se proporcionan un constructo de ADN de fusión, vectores, un polipéptido de fusión, una célula que comprende el constructo de ADN de fusión, y métodos para mejorar la secreción y/o escisión de una proteína deseada desde una célula. Más específicamente, una región KEX2 abarcada por la invención ha sido incluida en un polipéptido de fusión para proporcionar la escisión de una proteína deseada desde el polipéptido de fusión. Por lo tanto, la invención pertenece a una región KEX2 para la escisión de proteína. Por ello, en un primer aspecto, la presente invención proporciona un constructo de ADN de fusión que codifica un polipéptido de fusión que comprende en enlace operable desde el extremo 5' de dicho constructo,
un promotor;
una primera molécula de ADN que codifica una secuencia señal funcional como una secuencia secretora en una célula fúngica filamentosa;
una segunda molécula de ADN que codifica una proteína portadora, donde la proteína portadora es un
polipéptido fúngico secretado de manera natural o una porción funcional del mismo;
una tercera molécula de ADN que codifica una región KEX2, donde la región KEX2 es VAVEKR; y
una cuarta molécula de ADN que codifica una proteína deseada.
[7] En otros aspectos, la presente invención proporciona un vector que comprende el constructo de ADN de fusión de la presente invención y una célula huésped que comprende el vector.
[8] En otro aspecto adicional, la presente invención proporciona un proceso para producir una proteína deseada en una célula fúngica filamentosa que comprende:
(a) obtener una célula huésped fúngica filamentosa que comprende un constructo de ADN de fusión de la presente Invención;
(b) cultivar la célula huésped en condiciones adecuadas que permitan la expresión y producción de la proteína deseada; y
(c) recuperar la proteína deseada.
[9] En otro aspecto adicional, la presente invención proporciona un proceso para aumentar la producción de un anticuerpo a partir de una célula fúngica filamentosa que comprende obtener una célula fúngica filamentosa que comprende un constructo de ADN de fusión de la presente invención, cultivar la célula fúngica en condiciones adecuadas para la expresión del polipéptido de fusión y permitir la secreción del polipéptido de fusión, donde la secreción de la proteína deseada es aumentada en comparación con la secreción de un polipéptido de fusión equivalente que no Incluye una presecuencia KEX2.
[1] En otro aspecto adicional, la presente invención proporciona un polipéptido de fusión que comprende a partir de un extremo amino-terminal de dicho polipéptido de fusión una primera secuencia de aminoácidos que comprende:
(a) una secuencia señal funcional como secuencia secretora en una célula fúngica filamentosa;
(b) una segunda secuencia de aminoácidos que comprende una proteína portadora, donde la proteína portadora es un polipéptido fúngico secretado de manera natural;
(c) una tercera secuencia de aminoácidos que comprende una región KEX2, donde dicha región es
VAVEKR; y
(d) una cuarta secuencia de aminoácidos que comprende una proteína deseada.
BREVE... [Seguir leyendo]
Reivindicaciones:
1. Un constructo de ADN de fusión que codifica un polipéptido de fusión que comprende en unión operable desde el extremo 5' de dicho constructo,
un promotor;
una primera molécula de ADN que codifica una secuencia señal funcional como una secuencia secretora en una célula fúnglca filamentosa;
una segunda molécula de ADN que codifica una proteína portadora, donde la proteína portadora es un
polipéptido fúnglco secretado de manera natural o una porción funcional del mismo;
una tercera molécula de ADN que codifica una reglón KEX2, donde la reglón KEX2 es VAVEKR; y
una cuarta molécula de ADN que codifica una proteína deseada.
2. El constructo de ADN de fusión de la reivindicación 1, donde:
(a) la primera molécula de ADN y la segunda molécula de ADN codifican una secuencia señal de CBH1 de Trichoderma y proteína portadora o una secuencia señal de endoglucanasa de Trichoderma y proteína portadora; o
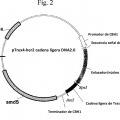
(b) la primera molécula de ADN y la segunda molécula de ADN codifican una secuencia señal de glucoamilasa y proteína portadora o una secuencia señal de alfa-amilasa y proteína portadora.
3. El constructo de ADN de fusión de la reivindicación 1, donde la proteína deseada es una enzima o la proteína deseada es una proteína terapéutica.
4. El constructo de ADN de fusión de la reivindicación 3, donde la proteína terapéutica es un anticuerpo o es un anticuerpo monoclonal de cadena pesada o cadena ligera.
5. El constructo de ADN de fusión de la reivindicación 1, donde:
(a) la primera molécula de ADN y segunda molécula de ADN codifican una secuencia señal de CBH1 y proteína portadora y la cuarta molécula de ADN codifica una cadena ligera de anticuerpo o fragmento
de la misma; o
(b) la primera molécula de ADN y segunda molécula de ADN codifican una secuencia señal de glucoamilasa y proteína portadora y la cuarta molécula de ADN codifica una cadena ligera de anticuerpo o fragmento de la misma.
6. La proteína de fusión codificada por el constructo de ADN de fusión de cualquiera de las reivindicaciones precedentes.
7. Un vector que comprende el constructo de ADN de fusión de cualquiera de las reivindicaciones de la 1 a la
8. Una célula huésped que comprende el vector de la reivindicación 7.
9. La célula huésped de la reivindicación 8, donde la célula huésped es una célula huésped de Trichoderma.
1. La célula huésped de la reivindicación 9, donde la célula de Trichoderma es una célula de T. reesei.
11. Un proceso para producir una proteína deseada en una célula fúnglca filamentosa que comprende:
(a) obtener una célula huésped fúnglca filamentosa que comprende un constructo de ADN de fusión según cualquiera de las reivindicaciones de la 1 a la 5;
(b) cultivar la célula huésped en condiciones adecuadas que permitan la expresión y producción de la proteína deseada; y
(c) recuperar la proteína deseada.
12. Un proceso para escindir una proteína deseada de un polipéptido de fusión recomblnante que comprende expresar en una célula fúngica filamentosa un polipéptido de fusión codificado por un constructo de ADN de fusión según cualquiera de las reivindicaciones de la 1 a la 5, donde dicha reglón KEX2 proporciona un sitio de escisión de proteína y obtener una proteína deseada que se escinde del polipéptido de fusión expresado.
13. El proceso según la reivindicación 12, donde la escisión de la proteína deseada se aumenta en comparación con la escisión de dicha proteína deseada de un polipéptido de fusión equivalente que carece de la presecuencla de sitio KEX2.
14. Un proceso para aumentar la producción de un anticuerpo a partir de una célula fúngica filamentosa que comprende obtener una célula fúngica filamentosa que comprende un constructo de ADN de fusión de cualquiera de las reivindicaciones de la 1 a la 5, cultivar la célula fúngica en condiciones adecuadas para la expresión del pollpéptido de fusión y permitir la secreción del pollpéptido de fusión, donde la secreción de la proteína deseada
se aumenta en comparación con la secreción de un pollpéptido de fusión equivalente que no incluye una presecuencia KEX2.
15. El proceso de la reivindicación 14, donde la secreción de la proteína deseada es aumentada en al menos un 3% en comparación con la secreción de la proteína deseada a partir del pollpéptido de fusión equivalente.
16. El proceso de cualquiera de las reivindicaciones de la 11 a la 15, donde:
(a) la proteína deseada es una proteína terapéutica, una ¡nmunoglobulina, un anticuerpo monoclonal;
y/o
(b) un anticuerpo monoclonal de cadena ligera o cadena pesada o fragmento del mismo.
17. Un pollpéptido de fusión que comprende a partir de un extremo amlno terminal de dicho pollpéptido de fusión 15 una primera secuencia de aminoácidos que comprende:
(a) una secuencia señal funcional como secuencia secretora en una célula fúngica filamentosa;
(b) una segunda secuencia de aminoácidos que comprende una proteína portadora, donde la proteína portadora es un pollpéptido fúnglco secretado de manera natural;
(c) una tercera secuencia de aminoácidos que comprende una reglón KEX2, donde dicha región es
VAVEKR; y
(d) una cuarta secuencia de aminoácidos que comprende una proteína deseada.
Patentes similares o relacionadas:
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
Anticuerpo anti-FGF23 y composición farmacéutica que comprende el mismo, del 15 de Julio de 2020, de Kyowa Kirin Co., Ltd: Anticuerpo o fragmento funcional del mismo que se une a la totalidad o a una parte del epítopo de FGF23 humano, al que se une un anticuerpo producido […]
Biblioteca de péptidos y su uso, del 8 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Una biblioteca de péptidos que comprende una pluralidad de péptidos diferentes en la que los péptidos comprenden cada uno una secuencia de aminoácidos […]
Producción de vectores de expresión y selección de células de alta capacidad de procesamiento, del 8 de Julio de 2020, de Kymab Limited: Un método para producir células que codifican un repertorio de anticuerpos que comprende cadenas pesadas y cadenas ligeras de anticuerpo cognadas, comprendiendo dicho […]
Anticuerpo anti-Notch 4 humano, del 1 de Julio de 2020, de EISAI R&D MANAGEMENT CO., LTD: Un anticuerpo anti-Notch4 o un fragmento de unión a Notch4 de este, donde dicho anticuerpo o un fragmento de unión a Notch4 de este comprende cadenas pesadas y ligeras y […]
Vacuna de ADN contra pseudotuberculosis en peces marinos, del 1 de Julio de 2020, de NATIONAL UNIVERSITY CORPORATION TOKYO UNIVERSITY OF MARINE SCIENCE AND TECHNOLOGY: Una vacuna de ADN para peces, caracterizada por: - impartir inmunidad contra la pseudotuberculosis causada por Photobacterium damselae subsp. piscicida - que comprende, […]
Vacuna de ADN que contiene un epítopo específico de VEGF y/o un epítopo específico de angiopoyetina-2, del 1 de Julio de 2020, de OSAKA UNIVERSITY: Un vector de expresión que codifica un polipéptido del antígeno del núcleo del virus de la hepatitis B quimérico con una inserción para uso en el tratamiento o la profilaxis […]