Purificación de los polipéptidos del Factor VII mediante cromatografía de interacción hidrofóbica.
Proceso para reducir la presencia de las formas del Factor VII carentes de uno o varios glicano(s) N-enlazados en una sustancia medicamentosa de un polipéptido del Factor VII activado creado por recombinación,
dicho proceso incluye los pasos:
(a) contactar la sustancia medicamentosa con un material de cromatografía de interacción hidrofóbica bajo condiciones que facilitan la unión de una parte de dicha sustancia medicamentosa a dicho material de cromatografía de interacción hidrofóbica; dicha sustancia medicamentosa contiene una sal seleccionada de la lista de: acetato amónico, sulfato amónico, cloruro amónico, cloruro sódico, acetato sódico, sulfato sódico, acetato potásico, cloruro potásico y sulfato potásico, y/o unos iones híbridos seleccionados de la lista de: glicina, alanina, beta-alanina, leucina, e isoleucina, en una concentración en el rango entre 0.0-0.1 M o en el rango de 0.5 M a 85% de la concentración de saturación para la sal respectiva a la temperatura en la que dicho paso (a) se lleva a cabo;
(b) opcionalmente lavar dicho material de cromatografía de interacción hidrofóbica con un tampón de lavado; y
(c) eluir dicho material de cromatografía de interacción hidrofóbica con un tampón de elución, y recolectar una sustancia medicamentosa purificada del polipéptido del Factor VII activado como eluato;
donde la presencia de las formas del polipéptido del Factor VII carente de uno o varios glicanos(s) N-enlazados en la sustancia medicamentosa purificada recogida en el paso (c), como viene determinado por los métodos definidos aquí, se reduce con al menos el 50% (p/p) en comparación con la sustancia medicamentosa aplicada en el paso (a).
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2006/065930.
Solicitante: NOVO NORDISK HEALTH CARE AG.
Nacionalidad solicitante: Suiza.
Dirección: Thurgauerstrasse 36/38 8050 Zürich SUIZA.
Inventor/es: KRARUP,JANUS.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K14/745 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Factores de coagulación sanguínea o de fibrinolisis.
- C12N9/64 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › que provienen de tejido animal, p. ej. renina.
PDF original: ES-2515915_T3.pdf





Fragmento de la descripción:
Purificación de los polipéptidos del Factor VII mediante cromatografía de interacción hidrofóbica Campo de la invención [0001] La presente invención se refiere a un procedimiento para el proceso de purificación de polipéptidos del Factor VII mediante cromatografía de interacción hidrofóbica (HIC) .
Antecedentes de la invención [0002] Las proteínas implicadas en la cascada de coagulación, incluyendo, por ejemplo, el Factor VII, Factor VIII, Factor IX, Factor X, y la proteína C, demuestran ser útiles agentes terapéuticos para tratar varias enfermedades patológicas. Por consiguiente, hay una creciente necesidad de formulaciones que contienen estas proteínas, que son farmacéuticamente aceptables y muestran una eficacia clínica uniforme y predeterminada. El proceso total a escala industrial de purificación de sustancias medicamentosas de un polipéptido del Factor VII puede sufrir en ciertos casos el inconveniente de que la sustancia medicamentosa contenga una cantidad considerable de impurezas relacionadas con el producto (relacionadas con el Factor VII) , como por ejemplo impurezas contenidas en los picos de elución tardía (incluyendo glico-variantes con diferentes niveles de glicosilación N-enlazada ("formas des-N-glicanadas") , formas oxidadas, formas proteolíticamente degradadas (formas de cadena pesada divididas) , o agregados con un peso molecular superior al del polipéptido de interés del Factor VII. Esto es, por supuesto, indeseable y en algunos casos también inaceptable.
El artículo "Secuencia de aminoácidos y modificaciones postransacionales del Factor VIIa humano de plasma y transfección de células renales de hámsters recién nacido", Biochemistr y , 4 de octubre de 1988, 27 (20) :7785-93, expone que algunos productos de degradación de cadena pesada co-purifican con el Factor VII intacto activado.
El artículo "Derivados de FVIIa obtenidos por degradación autolítica y controlada mediada por catepsina G" FEBS Lett. 15 de febrero de 1993, 317 (3) :245-9, afirma que las formas de cadena pesada del Factor VII divididas no se pueden aislar del Factor VII bajo condiciones no desnaturalizantes.
US 6, 777, 390 (Baxter) trata sobre la purificación del Factor VII de criosobrenadante por AIEX y sobre la posterior cromatografía hidrofóbica de la sefarosa de fenilo. Los preparados farmacéuticos del Factor VII descritos contienen menos del 5% de Factor VII activado (Factor VIIa) .
Soenderkaer et al. describe los efectos de la sacarosa en la agregación de rFVIIa y la oxidación de metionina; se describen ensayos para analizar la presencia de agregados y formas oxidadas.
Bolt et al. expone que la N-glicosilación postraduccional tiene lugar durante el procesamiento normal del factor de coagulación VII humano.
Bjoern et al. se refiere a la caracterización de la O-glicosilación de plasma y FVIIa recombinante en los residuos 52 y 60 de serina y los efectos de la mutagénesis de sitio dirigido de serina-52 a alanina.
Según saben los inventores, el problema de la eliminación de impurezas relacionadas con el producto en una sustancia medicamentosa de un polipéptido del FVII en procesos a escala industrial no ha sido tratado en el estado de la técnica.
Breve descripción de la invención [0010] La presente invención proporciona un proceso para reducir la presencia de formas del Factor VII carentes de uno
(a) contactar la sustancia medicamentosa con un material de cromatografía de interacción hidrofóbica bajo condiciones que facilitan la unión de una parte de dicha sustancia medicamentosa a dicho material de cromatografía de interacción hidrofóbica, constando dicha sustancia medicamentosa de una sal seleccionada de la lista de: acetato amónico, sulfato amónico, cloruro amónico, cloruro sódico, acetato sódico, sulfato sódico, acetato potásico, cloruro potásico, y sulfato potásico, y/o un ión híbrido seleccionado de la lista de: glicina, alanina, beta-alanina, leucina, e isoleucina, en una concentración dentro del rango 0.0-0.1 M o dentro del rango 0.5 M a 85% de la concentración de saturación para la respectiva sal a la temperatura en la que se lleva a cabo el paso (a) ;
(b) lavar opcionalmente dicho material de cromatografía de interacción hidrofóbica con un tampón de lavado; y
(c) eluir dicho material de cromatografía de interacción hidrofóbica con un tampón de elución, y recolectar una sustancia medicamentosa purificada del polipéptido del Factor VII activado como un eluato;
donde la presencia de las formas del polipéptido del Factor VII carentes de uno o varios glicano (s) N-enlazados en la sustancia medicamentosa purificada recogida en el paso (c) , como viene determinado por los métodos definidos aquí, se reduce en al menos el 50% (p/p) en comparación con la presencia contenida en la sustancia medicamentosa aplicada en el paso (a) .
Breve descripción de las figuras [0011]
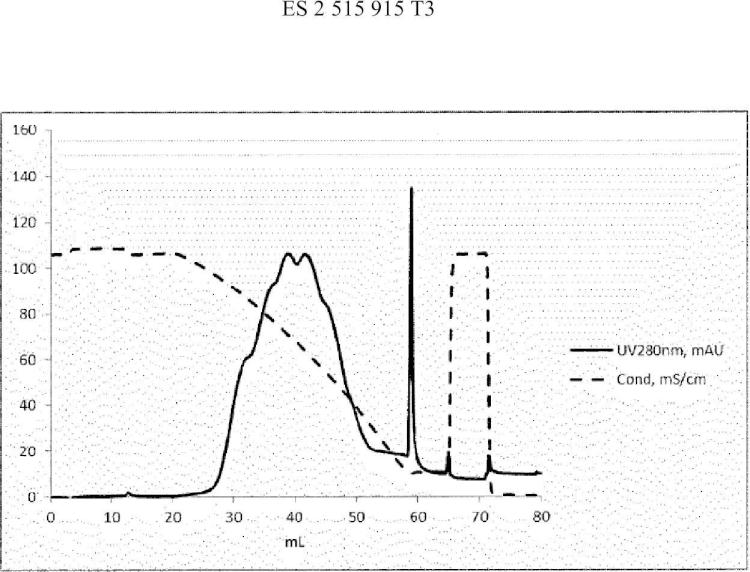
La figura 1 es un cromatograma de la separación del factor de coagulación VII humano en la TSKgel Phenyl-5PW, cf. ejemplo 1.
La figura 2 es un cromatograma de la separación análoga en el fenilo 5PW de la TSKgel Phenyl-5PW, cf. ejemplo 3.
La figura 3 ilustra la elución de impurezas a lo largo del valor máximo de producto, cf. ejemplo 3.
La figura 4 ilustra un SDS-PAGE de carga de la cromatografía de interacción hidrofóbica que muestra compuestos de alto peso molecular a 185, 140 y 90 kDa.
La figura 5 ilustra un SDS-PAGE de una agrupación de cromatografía de interacción hidrofóbica que muestra que los compuestos de alto peso molecular a 185, 140 y 90 kDa han sido casi eliminados.
La figura 6 es un cromatograma de la separación del factor de coagulación VII humano en la TSKgel Phenyl-5PW, cf. ejemplo 6.
La figura 7 es un gel SDS-PAGE que ilustra la eliminación parcial de GD-Factor VII. Calle 1: peso molecular (PM) estándar, calle 2: muestra de carga, calle 3: borde delantero, calle 4: valor máximo principal, calle 5: borde de salida, cf. ejemplo 6.
La figura 8 ilustra un cromatograma HPLC del FVII y sus impurezas relacionadas con el producto.
Descripción detallada de la invención [0012] Los presentes inventores han descubierto ahora que siguiendo un procedimiento de cromatografía de interacción hidrofóbica particular en el que se usan una sal particular y/o un ión híbrido, es posible reducir, o prácticamente eliminar, la presencia de impurezas tales como los "picos de elución tardía" compuestos por N-glicovariantes sin N-glicanos en las posiciones Asn145 y/o Asn322 (de FVII humano) .
La presente invención proporciona un proceso para reducir la presencia de formas de Factor VII carentes de uno o varios glicanos N-enlazados en una sustancia medicamentosa de un polipéptido del Factor VII activado creado por recombinación, usando cromatografía de interacción hidrofóbica, cf. reivindicación 1.
El proceso es, por consiguiente, particularmente relevante para sustancias medicamentosas de polipéptidos del Factor VII que inicialmente tienen un contenido considerable de picos de elución tardía, es decir una agrupación de picos de elución tardía de al menos 2% (p/p) de la cantidad total de polipéptidos del Factor VII. Se debe entender que, en algunos casos, las sustancias medicamentosas a escala industrial de polipéptidos del Factor VII pueden incluir incluso cantidades más altas de picos de elución tardía, por ejemplo al menos 3%, así como al menos 4%, o al menos 5%, algunas veces hasta aproximadamente 10-12% de picos de elución tardía, y que el proceso de la presente invención es incluso más relevante para este tipo de sustancias medicamentosas. Tales sustancias medicamentosas se pueden obtener directamente de procesos de fermentación, pero se obtienen más normalmente como resultado de la purificación de producto bruto inicial.
El proceso es además relevante para sustancias medicamentosas de polipéptidos del Factor VII que inicialmente tienen un contenido considerable de formas oxidadas, formas proteolíticamente degradadas, y/o agregados con un peso molecular mayor que el polipéptido del Factor VII de interés, es decir una agrupación de formas proteolíticamente degradadas de al menos 2% (p/p) de la cantidad total de polipéptidos del Factor VII y/o formas oxidadas de al menos 1% (p/p) de la cantidad total de polipéptidos del Factor VII.
Cuando se usa conjuntamente con polipéptidos del Factor VII, el porcentaje (%) de impurezas relacionadas con el producto (por ejemplo, picos de elución tardía) se declara... [Seguir leyendo]
Reivindicaciones:
1. Proceso para reducir la presencia de las formas del Factor VII carentes de uno o varios glicano (s) N-enlazados en una sustancia medicamentosa de un polipéptido del Factor VII activado creado por recombinación, dicho proceso incluye los pasos:
(a) contactar la sustancia medicamentosa con un material de cromatografía de interacción hidrofóbica bajo condiciones que facilitan la unión de una parte de dicha sustancia medicamentosa a dicho material de cromatografía de interacción hidrofóbica; dicha sustancia medicamentosa contiene una sal seleccionada de la lista de: acetato amónico, sulfato amónico, cloruro amónico, cloruro sódico, acetato sódico, sulfato sódico, acetato potásico, cloruro potásico y sulfato potásico, y/o unos iones híbridos seleccionados de la lista de: glicina, alanina, beta-alanina, leucina, e isoleucina, en una concentración en el rango entre 0.0-0.1 M o en el rango de 0.5 M a 85% de la concentración de saturación para la sal respectiva a la temperatura en la que dicho paso (a) se lleva a cabo;
(b) opcionalmente lavar dicho material de cromatografía de interacción hidrofóbica con un tampón de lavado; y
(c) eluir dicho material de cromatografía de interacción hidrofóbica con un tampón de elución, y recolectar una sustancia medicamentosa purificada del polipéptido del Factor VII activado como eluato;
donde la presencia de las formas del polipéptido del Factor VII carente de uno o varios glicanos (s) N-enlazados en la sustancia medicamentosa purificada recogida en el paso (c) , como viene determinado por los métodos definidos aquí, se reduce con al menos el 50% (p/p) en comparación con la sustancia medicamentosa aplicada en el paso (a) .
2. Proceso según la reivindicación 1, donde el material de cromatografía de interacción hidrofóbica se selecciona del grupo consistente en resinas sustituidas con ligandos de butilo y/o ligandos de fenilo.
3. Proceso según cualquiera de las reivindicaciones precedentes, donde la carga de la sustancia medicamentosa en el paso (a) se encuentra en el rango de al menos 250 mg de polipéptido del Factor VII por Resina L.
4. Proceso según cualquiera de las reivindicaciones precedentes, donde la sustancia medicamentosa en el paso (a) está en forma líquida y tiene una fuerza iónica de al menos 50 mS/cm.
5. Proceso según cualquiera de las reivindicaciones precedentes, donde la sustancia medicamentosa en el paso (a) contiene una sal en una concentración en el rango de 0.5 M a 85% de la concentración de saturación, o entre 0.7-2.2 M.
6. Proceso según cualquiera de las reivindicaciones precedentes, donde el tampón de lavado en el paso (b) contiene una sal seleccionada de la lista de: acetato amónico, sulfato amónico, cloruro amónico, cloruro sódico, acetato sódico, sulfato sódico, acetato potásico, cloruro potásico y sulfato potásico, y/o unos iones híbridos seleccionados de la lista de: glicina, alanina, beta-alanina, leucina, e isoleucina, en una concentración en el rango entre 0.0-0.1 M o en el rango entre 0.5 M a 85% de la concentración de saturación para la sal respectiva a la temperatura en la que el paso (b) se lleva a cabo.
7. Proceso según cualquiera de las reivindicaciones precedentes, donde el tampón de lavado en el paso (b) contiene una sal en una concentración en el rango entre 0.7-2.2 M.
8. Proceso según cualquiera de las reivindicaciones precedentes, donde el tampón de elución en el paso (c) contiene una sal en una concentración inicial en el rango entre 0.7-2.2 M.
9. Proceso según cualquiera de las reivindicaciones precedentes, donde el tampón de elución en el paso (c) es un tampón de gradiente con respecto a la sal.
10. Proceso según la reivindicación 9, donde la concentración inicial de la sal del tampón de gradiente está en el rango entre 1.7-2.2 M, y la concentración final de la sal del tampón de gradiente se encuentra en el rango entre 0.0-1.6 M.
11. Proceso según cualquiera de las reivindicaciones precedentes, donde la sal se selecciona del grupo consistente en acetato amónico, sulfato amónico, cloruro sódico, y acetato sódico.
Patentes similares o relacionadas:
Cadena ligera de enteroquinasa modificada, del 22 de Julio de 2020, de NOVO NORDISK A/S: Un análogo de la cadena ligera de la enteroquinasa bovina que comprende una secuencia de aminoácidos establecida en la SEQ ID NO: 1, en donde dicho análogo comprende […]
Formulaciones liofilizadas para antídoto del factor Xa, del 1 de Julio de 2020, de PORTOLA PHARMACEUTICALS, INC.: Una formulación acuosa, que comprende de 10 mM a 55 mM de arginina, de 1% a 3% de sacarosa (p/v), de 2% a 8% de manitol (p/v), y al menos 5 mg/ml de un polipéptido […]
Antídotos para inhibidores del factor Xa y procedimientos de uso de los mismos, del 24 de Junio de 2020, de PORTOLA PHARMACEUTICALS, INC.: Una composición farmacéutica que comprende un transportador y un polipéptido para uso en terapia donde el polipéptido comprende una secuencia de aminoácidos que tiene […]
Métodos y composiciones para ingeniería genómica, del 3 de Junio de 2020, de Sangamo Therapeutics, Inc: Una pareja de nucleasas de dedo de zinc (ZFN) que comprende una ZFN izquierda y una ZFN derecha, comprendiendo cada ZFN un dominio de escisión […]
Proteínas prohemostáticas para el tratamiento del sangrado, del 3 de Junio de 2020, de ACADEMISCH ZIEKENHUIS LEIDEN: Una proteína recombinante que comprende un polipéptido del factor Xa de coagulación de mamífero, teniendo dicho polipéptido una alteración en la región de los […]
Ratones ADAM6, del 22 de Abril de 2020, de REGENERON PHARMACEUTICALS, INC.: Un ratón que ha experimentado reordenación de secuencia génica de inmunoglobulina de modo que exprese un linfocito B que comprende una secuencia de inmunoglobulina reordenada […]
Procedimiento de purificación de polipéptidos, del 22 de Abril de 2020, de CSL LIMITED: Procedimiento de purificación de un polipéptido de interés por cromatografía de intercambio catiónico en el que un compuesto químico se añade en una concentración de al menos […]
Proteínas de fusión recombinantes para la prevención o el tratamiento de adherencias en tejidos u órganos, del 8 de Abril de 2020, de Akesion GmbH: Proteína de fusión recombinante que incluye una enzima fibrinogenolítica con una secuencia de aminoácidos, que está unida en el extremo C y/o en el extremo […]