Nanodispersión.
Una nanodispersión que comprende nanopartículas que tienen un tamaño promedio menor que 300 nm dispersa en un vehículo que comprende un solvente soluble en agua y agua,
dichas nanopartículas comprenden un derivado de taxano seleccionado de paclitaxel o docetaxel; un polímero soluble en agua, y un surfactante que comprende una mezcla de ácido caprílico y sulfato de colesterilo.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IN2008/000857.
Solicitante: SUN PHARMA ADVANCED RESEARCH COMPANY LIMITED.
Nacionalidad solicitante: India.
Dirección: 17/B Mahal Industrial Estate OFF Mahakali Caves Road Andheri (East) Mumbai 400 093 INDIA.
Inventor/es: KHOPADE,AJAY JAYSINGH, BHOWMICK,SUBHAS BALARAM, ARULSUDAR,N.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/337 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen ciclos de cuatro eslabones, p. ej. taxol.
- A61K9/10 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Dispersiones; Emulsiones.
- A61K9/51 A61K 9/00 […] › Nanocápsulas.
PDF original: ES-2509490_T3.pdf
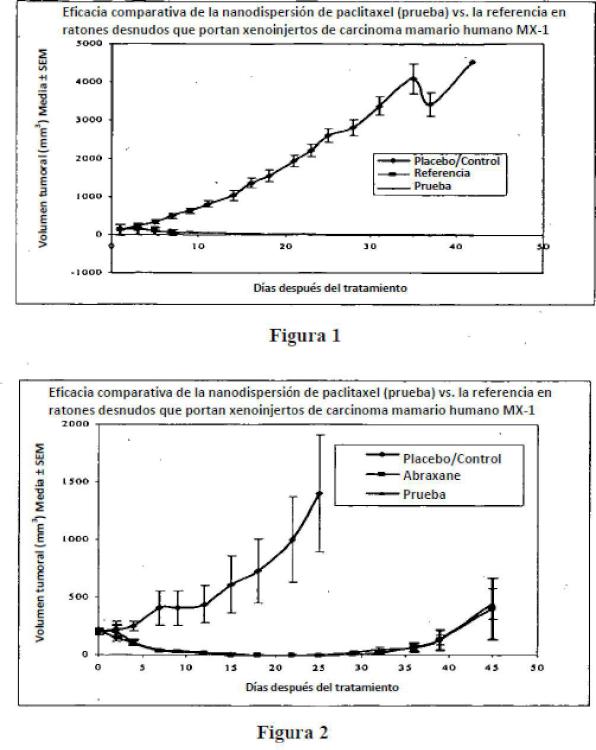
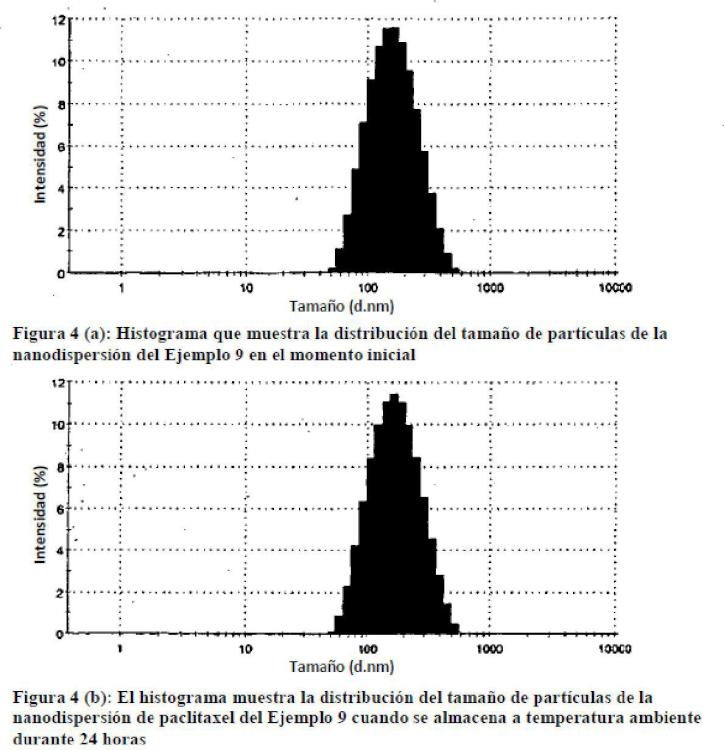
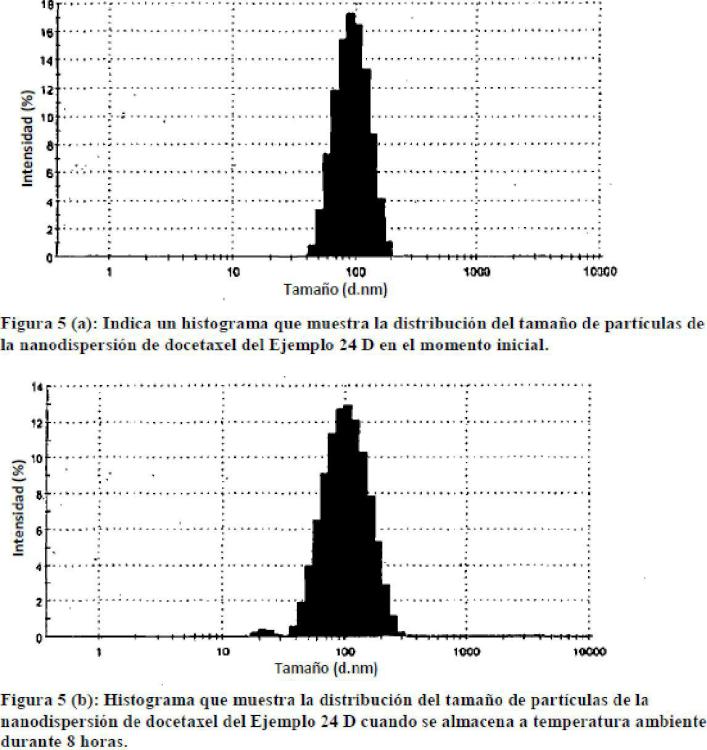
Fragmento de la descripción:
Nanodispersión
La presente invención se relaciona con una 'nanodispersión' de un derivado de taxano y proceso para su preparación. Antecedentes de la invención
Hay una serie de fármacos que son poco solubles o insolubles en soluciones acuosas. Tales fármacos son desafíos en términos de tener una pobre biodisponibilidad oral o en términos de formularlos para el suministro de fármacos especialmente a través de la vía intravenosa. Si un fármaco se administra por vía intravenosa, las partículas deben ser lo suficientemente pequeñas para pasar a través de los capilares de manera segura sin causar embolias. Para la administración intravenosa, se reconoce como seguro el hecho de administrar fármacos en forma de solución, emulsión, liposomas, nanodispersiones y similares. Otro requisito que debe cumplirse al formular un sistema de suministro de fármacos, especialmente para fármacos hidrófobos es que la formulación debe ser físicamente estable sin agregación o cristalización sustancial del fármaco o cambio en la apariencia de la formulación en el almacenamiento a temperatura ambiente durante un periodo de tiempo deseado.
Un ejemplo de un fármaco poco soluble incluye los derivados del taxano, que se conocen bien por su actividad contra el cáncer. Un derivado de taxano o un taxoide es un producto natural diterpenoide complejo derivado principalmente a partir de la corteza de Tejo Occidental, Taxus brevifolia y esencialmente tiene un esqueleto de taxano. Los taxanos se han usado para producir varios fármacos quimioterapéuticos. Actualmente dos derivados de taxanos paclitaxel y docetaxel están disponibles comercialmente como potentes agentes anti-tumorales.
Los derivados de taxano exhiben una solubilidad muy baja en agua y en la mayoría de los solventes farmacéuticamente aceptables limitando así su administración a los pacientes. Debido a esta propiedad Intrínseca desfavorable, la inyección de TAXOL, inyección de paclitaxel comercializada comercialmente se formula como una solución no acuosa en Cremophor TM EL (un aceite de ricino polletoxllado) y alcohol deshidratado. Sin embargo, el uso de un solubilizante como Cremophor TM EL en grandes cantidades conduce a diversos efectos adversos, tales como reacciones hipersensibles e hipertensas serias o fatales, bradiarritmia, anemia, neutropenia y/o neuropatía periférica. Por lo tanto todos los pacientes que reciben paclitaxel son premedicados con esteroides, antihistamínicos y antagonistas del receptor H2 y después el paclitaxel se infunde sólo muy lentamente durante un período de al menos 3 horas o más.
En vista de estos problemas asociados con las formulaciones de Taxol, los investigadores han tratado de preparar formulaciones de taxol sin usar Cremophor EL.
La patente de Estados Unidos núm. 6537579 describe composiciones de agentes farmacológicamente activos sustancialmente insolubles en agua tal como el paclitaxel, en que el agente farmacológicamente activo existe en la forma de partículas suspendidas recubiertas con proteína (que actúa como un agente estabilizante). En particular, las proteínas y el agente farmacológicamente activo en un medio dispersante biocompatible se someten a alto cizallamiento, en ausencia de cualquiera de los surfactantes convencionales, y además en ausencia de cualquier material de núcleo polimérico para las partículas. El procedimiento produce partículas con un diámetro de menos de aproximadamente 1 miera. El sistema de partículas producido de acuerdo con la invención puede convertirse en un polvo seco redispersable que comprende nanopartículas del fármaco insoluble en agua recubierto con una proteína, y proteína libre a las que se unen moléculas del agente farmacológico.
La patente de Estados Unidos núm.617948 se refiere a una composición que comprende paclitaxel en la forma de una solución de paclitaxel en un solvente no acuoso, miscible en agua, farmacéuticamente aceptable (como N-metil pirrolidona) y que además comprende un solubilizante farmacéuticamente aceptable (tal como triacetina), con la disposición de que el aceite de ricino polietoxilado (Cremophor) se excluye de la composición. En modalidades preferidas, una gran cantidad de solvente por ejemplo 4 mg de NMP (ejemplo 1) o combinación de 2 mg de NMP y 2 mg de etanol (ejemplo 2) se usaron para solubilizar 1 mg de paclitaxel bajo agitación moderada. Si una cantidad terapéuticamente eficaz de fármaco se suministra a través de tales composiciones, esto se asociará con la entrada de cantidades excesivas de etanol, solventes no acuosos o solubilizantes en el cuerpo.
La patente de Estados Unidos núm.64623 se refiere a una formulación estable para inyección que contiene paclitaxel y dos solubilizantes - oleato de oxietileno sorbitol y monoéster de ácido graso (oxietilen glicol)i5-2o junto con componentes adicionales tales como povidona y polietilenglicol. El solubilizante principal usado en la formulación poliéster oleico de sorbitol polietoxilado, que es un producto de adición del óxido de etileno de ácido oleico derivado de la oleína de palma, tiene una propiedad inherente de solidificar a temperaturas inferiores a 1°C, lo que es inadecuado para solubilizar el
paclitaxel cuando se usa solo. Sin embargo cuando se combina con un solubilizante auxiliar mono éster de ácido graso de polietilenglicol, los dos solubilizantes juntos presentan una buena solubilidad en agua y en alcohol anhidro y se mantienen en fase fluida incluso a bajas temperaturas. Por tanto, el uso de dos solubilizantes juntos es obligatorio. Además es un criterio esencial que el valor HLB de los solubilizantes que cumplen las características deseadas debe ser tan alto como 15 pero no menor que 13. La formulación resultante es una solución.
La solicitud del PCT núm. WO 26/13351 describe una formulación farmacéutica líquida para administración parenteral que comprende docetaxel o una sal farmacéuticamente aceptable de este; uno o más glicoles y un sistema solvente no acuoso farmacéuticamente aceptable, en donde la formulación tiene una lectura del pH metro en el Intervalo de 2.5 a 7.. Las modalidades de la Invención Implican el uso de una cantidad muy alta de surfactantes (aproximadamente 25% v/v de pollsorbato 8 o 3% v/v de Cremophor) que a su vez puede conducir a efectos secundarlos tóxicos. La solicitud no describe el perfil de eficacia y toxicidad de las formulaciones. Además la formulación descrita por la solicitud '51 es una solución de un fármaco en un sistema solvente no acuoso que en mezcla con un dlluyente de Infusión (NaCI al.9% o solución de dextrosa al 5%) produce una solución de infusión. En ninguna parte del proceso se forma un sistema de administración de fármacos o nanodlspersión novedoso. Además la estabilidad de las soluciones de la formulación después de diluirlas con dlluyente de Infusión es de muy corto período de aproximadamente 4 a 6 horas lo que puede limitar su eficacia de administración.
La solicitud de patente de Estados Unidos US22/586 (de aquí en lo adelante denominada como la solicitud de patente '6) describe liposomas que contienen sustancias hidrófobas y dos fosfolípidos con diferentes temperaturas de transición de fase y materiales que forman liposomas como el colesterol y lípidos modificados con polímeros hidrófilos. La relación del fármaco con respecto a los fosfolípidos y los materiales que forman liposomas varía para obtener diferentes formulaciones liposomales. La solicitud de patente '6 indica varios intentos de formular liposomas de taxanos que tienen una elevada relación fármacolípido, mediante el uso de dos clases de fosfolípidos especificadas, de manera que se reduce la cantidad total de lípido usada, ya que la inyección de una cantidad excesiva de lípidos en el cuerpo conduce a cierto grado de toxicidad.
La solicitud de patente de Estados Unidos US 26/188566 describe el docetaxel en nanopartículas o composiciones análogas de este. Las composiciones, que comprenden un docetaxel en nanopartículas o un análogo de este y al menos un estabilizador de superficie, pueden usarse en el tratamiento del cáncer.
Así es evidente a partir de la materia anterior que el problema principal asociado con la formulación de una composición de taxano es la hidrofobicidad de los taxanos, que
(a) hace que sea difícil formular una composición que contenga la forma solubilizada del fármaco y que sea estable, sin ninguna agregación o cristalización sustancial del fármaco o cambio de la apariencia de la formulación hasta un período de tiempo deseado.
(b) requiere el uso de gran cantidad de solubilizantes, fosfolípidos y surfactantes.
Además, los estudios de toxicidad del TAXOL (solución comercializada de paclitaxel en Cremophor y Alcohol)... [Seguir leyendo]
Reivindicaciones:
1. Una nanodispersión que comprende nanopartículas que tienen un tamaño promedio menor que 3 nm dispersa en un vehículo que comprende un solvente soluble en agua y agua, dichas nanopartículas comprenden un derivado de taxano seleccionado de paclitaxel o docetaxel; un polímero soluble en agua, y un surfactante que comprende una mezcla de ácido caprílico y sulfato de colesterilo.
2. Una nanodispersión como se reivindica en la reivindicación 1 en donde la relación de surfactante a derivado de taxano es aproximadamente 1: 5 a 1: 1.
3. Una nanodispersión como se reivindica en la reivindicación 1 en donde la relación de surfactante a paclitaxel es aproximadamente 1: 5 a aproximadamente 1:1.
4. Una nanodispersión como se reivindica en la reivindicación 2 en donde la relación de surfactante a docetaxel es aproximadamente 1:1.
5. Una nanodispersión como se reivindica en la reivindicación 1, en donde el tamaño promedio de las nanopartículas está en el intervalo de aproximadamente 1 nm a aproximadamente 2 nm.
6. Una nanodispersión como se reivindica en la reivindicación 1, en donde el solvente soluble en agua se selecciona de alcoholes, glicoles y sus derivados, polialquilenglicoles y sus derivados, glicerina, glicofurol y combinaciones de estos.
7. Una nanodispersión como se reivindica en la reivindicación 6, en donde el solvente soluble en agua es seleccionado del grupo que consiste en alcohol y polietilenglicol (PEG).
8. Una nanodispersión como se reivindica en la reivindicación 1, en donde el polímero soluble en agua es polivinilpirrolidona con un peso molecular en el intervalo de 1 a aproximadamente 5, y se usa en la cantidad en el intervalo de.1 % p/v a 1 % p/v.
9. Una nanodispersión como se reivindica en la reivindicación 1, en donde el surfactante se usa en una cantidad en el intervalo de aproximadamente. 1 % p/v a aproximadamente 5. % p/v.
1. Una solución que comprende un derivado de taxano seleccionado de paclitaxel o docetaxel; un polímero soluble en agua y un surfactante que comprende una mezcla de ácido caprílico y sulfato de colesterilo en un solvente soluble en agua, el cual en dilución con un vehículo líquido acuoso da una nanodispersión que comprende nanopartículas con un tamaño promedio menor que 3 nm.
11. Nanopartículas con un tamaño medio de partícula menor que 3 nms que comprenden un derivado de taxano seleccionado de paclitaxel o docetaxel, un polímero soluble en agua y un surfactante que comprende una mezcla de ácido caprílico y sulfato de colesterilo.
12. Una nanodispersión como se reivindica en la reivindicación 1, una solución como se reivindica en la reivindicación 1 o nanopartículas como se reivindican en la reivindicación 11, en donde el polímero soluble en agua se selecciona de polivinilpirrolidona, poloxómero, polietilenglicol, alcohol polivinílico, alginato sódico, hialuronato de sodio, goma gelana , carragenina, goma xantano, sulfato de dextrano, sulfato de condroitina, pectinatos, heparinas, ácido metacrílico copolímeros, sulfato de dermatan, polímeros celulósicos, por ejemplo, carboximetil celulosa de sodio, hidroxietil celulosa, hidroxipropilmetilcelulosa, y mezclas de estos.
13. Una nanodispersión como se reivindica en la reivindicación 1, una solución como se reivindica en la reivindicación 1 o nanopartículas como se reivindica en la reivindicación 11, en donde el polímero soluble en agua se selecciona del grupo que consiste en polivinilpirrolidona y polietilenglicol.
Patentes similares o relacionadas:
Composición para el tratamiento de enfermedades isquémicas o trastornos inflamatorios neurogénicos, que contienen el secretoma de células progenitoras neurales como ingrediente activo, del 22 de Julio de 2020, de S-BIOMEDICS: Una composición para uso en el tratamiento de enfermedad cerebrovascular isquémica, cardiopatía isquémica, infarto de miocardio, enfermedad de Alzheimer, enfermedad […]
Cápsulas blandas entéricas de liberación controlada de ésteres de fumarato, del 1 de Julio de 2020, de Banner Life Sciences LLC: Una composición farmacéutica oral que comprende una cápsula blanda entérica que encapsula fumarato de monometilo suspendido en una matriz líquida […]
Método para tratar enfermedades recurrentes de la piel y la membrana mucosa provocadas por HSV-1 y HSV-2, del 24 de Junio de 2020, de Tets, Viktor Veniaminovich: Una preparación que incluye una base que contiene 0.5% ó 1% de sal de (2,6-diclorofenil)amida del ácido carbopentoxisulfanílico de fórmula general: **(Ver […]
Métodos para el tratamiento de la enfermedad ocular en sujetos humanos, del 10 de Junio de 2020, de Clearside Biomedical, Inc: Una formulación farmacéutica que comprende un fármaco para su uso en un método de tratamiento de un trastorno ocular posterior en un sujeto humano que […]
Formulaciones de ganaxolona y procedimientos para la preparación y uso de las mismas, del 3 de Junio de 2020, de Marinus Pharmaceuticals, Inc: Una composición que comprende partículas que comprenden ganaxolona; un polímero hidrófilo; un agente humectante; y un agente complejante, en la que el diámetro medio ponderado […]
Formulaciones de rifaximina y sus usos, del 6 de Mayo de 2020, de SALIX PHARMACEUTICALS, INC.: Una forma de dispersión sólida de rifaximina que comprende rifaximina y un polímero seleccionado de: succinato de acetato de hidroxipropilmetilcelulosa (HPMC-AS) […]
Agente terapéutico para la disfunción meibomiana, del 6 de Mayo de 2020, de SANTEN PHARMACEUTICAL CO., LTD.: Una composición farmacéutica que comprende sirolimus a una concentración de 0,01 a 0,5% (p/v) como único ingrediente activo para uso en la supresión de la obstrucción de […]
Régimen de dosificación para dosis olvidadas para ésteres de paliperidona inyectables de acción prolongada, del 22 de Abril de 2020, de Janssen Pharmaceuticals, Inc: Un depósito de palmitato de paliperidona inyectable para su uso en el tratamiento de un paciente con necesidad de tratamiento psiquiátrico seleccionado […]