Métodos para la predicción del resultado clínico para inhibidores del receptor del factor de crecimiento epidérmico para pacientes de cáncer.
Un procedimiento para obtener una puntuación de expresión correlacionada con un aumento del número de copias del gen EGFR que predice la respuesta de una persona a una terapia de inhibidor del EGFR,
en un especimen tisular obtenido de una persona que tiene o se sospecha que tiene cáncer, que comprende:
a) determinar por inmunohistoquímica una puntuación de fracción, donde la puntuación de fracción corresponde al porcentaje de células en el especimen tisular que tienen una tinción positiva para una puntuación de la proteína de EGFR y se expresa como un número entre 0 y 100 que corresponde al porcentaje de células en la muestra de células tumorales que tiene una tinción positiva para la proteína entre el 0 % y el 100 %;
b) determinar una puntuación de intensidad que corresponde a la intensidad de tinción del biomarcador en la muestra de células tumorales y se expresa en un número de al menos 1 y no más de 4 correspondiente a la intensidad de la tinción de la proteína en la muestra de células tumorales;
c) calcular una puntuación de expresión que es el producto de la puntuación de fracción y la puntuación de intensidad y se expresa en un número entero entre 0 y 400;
d) seleccionar a la persona como predestinada a responder a la administración terapéutica de un inhibidor de EGFR, si la puntuación de expresión es igual a o mayor de 200; o
e) seleccionar a la persona como predestinada a no responder a la administración terapéutica de un inhibidor de EGFR, si la puntuación de expresión es menor de 200.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E12005855.
Solicitante: THE REGENTS OF THE UNIVERSITY OF COLORADO.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 201 Regent Administrative Center, 3 SYS Boulder, CO 80309 ESTADOS UNIDOS DE AMERICA.
Inventor/es: GARCIA,MARILEILA VARELLA, BUNN,PAUL A. JR, CAPPUZZO,FEDERICO, FRANKLIN,WILBUR A, HIRSCH,FRED R.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07H21/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 21/00 Compuestos que contienen al menos dos unidades mononucleótido que tienen cada una grupos fosfato o polifosfato distintos unidos a los radicales sacárido de los grupos nucleósido, p. ej. ácidos nucleicos. › con desoxirribosilo como radical sacárido.
- C12Q1/68 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
PDF original: ES-2537631_T3.pdf






Fragmento de la descripción:
Métodos para la predicción del resultado clínico para inhibidores del receptor del factor de crecimiento epidérmico para pacientes de cáncer
Campo de la Invención
La presente invención se refiere generalmente a biomarcadores, métodos y kits de ensayo para la identificación de los pacientes con cáncer que se espera que puedan beneficiarse de la terapia del inhibidor del EGFR.
Antecedentes de la Invención
La neoplasia, o un proceso de proliferación celular rápida que da como resultado un crecimiento nuevo y anormal, es una característica de muchas enfermedades que pueden ser graves, y a veces, amenazantes para la vida. Típicamente, el crecimiento neoplásico de células y tejidos está caracterizado por una proliferación de células mayor de lo normal, donde las células siguen creciendo incluso después de que el factor de instigación (por ejemplo, el promotor del tumor, carcinogen, virus) no esté presente. El crecimiento celular tiende a mostrar una falta de organización estructural y/o coordinación con el tejido normal y normalmente crea una masa de tejido (por ejemplo, un tumor) que puede ser benigno o maligno. El crecimiento maligno celular, o tumores malignos (cáncer) , son una causa principal de muerte por todo el mundo, y el desarrollo de una terapia eficaz para la enfermedad neoplásica es el objeto de un gran cuerpo de investigación. Aunque se han propuesto una diversidad de enfoques innovadores de tratar y prevenir cánceres, muchos cánceres siguen causando un alto índice de mortalidad y pueden ser difíciles de tratar o ser relativamente insensibles a terapias convencionales. Además, los pacientes pueden responder de manera diferente a diversas terapias contra el cáncer, haciendo algunos enfoques útiles para algunos pacientes y no para otros. Por lo tanto, existe una necesidad continua en la técnica de identificación de factores de riesgo de cáncer adicionales y métodos para el diagnóstico temprano y terapia para cánceres, así como métodos para identificar a los pacientes que se espera que se beneficien de un tipo particular de terapia.
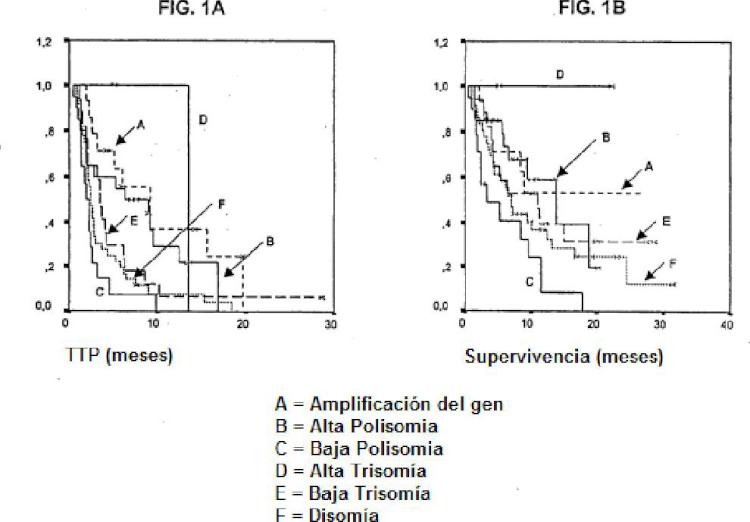
A fin de ilustrar este punto, el cáncer de pulmón de células no pequeñas (NSCLC) es la causa principal de muerte por cáncer en el mundo. Mientras la quimioterapia ha producido beneficios modestos de supervivencia en fases avanzadas, las combinaciones de dos fármacos convencionales generan una toxicidad considerable y requieren administración intravenosa (Non-small Cell Lung Cancer Collaborative Group, 1995; Schiller y col., 2002; Kelly y col., 2001) . El progreso en el campo de la biología del cáncer de pulmón condujo al desarrollo de inhibidores de moléculas pequeñas de proteínas diana implicadas en la proliferación, la apoptosis y la angiogénesis. Los agentes diana de terapia, tales como imatinib y trastuzumab produjeron un beneficio en la supervivencia coherente en leucemia mieloide crónica (Druker, 2001) , tumores estromales gastrointestinales (GIST) (Demetri 2002) y cánceres de mama que sobreexpresan las proteínas diana (Slamon 2001) . La superfamilia del receptor del factor de crecimiento epidérmico (EGFR) , incluyendo los cuatro receptores distintos EGFR/erbB-1, HER2/erbB-2, HER3/erbB3 y HER4/ERBB-4, se identificaron tempranamente como una diana terapéutica potencial en tumores sólidos. Después de la unión al ligando, estos receptores se homodimerizan y se heterodimerizan, y el dominio de la tirosina cinasa se activa, iniciando una cascada de eventos implicados en el desarrollo y la progresión de cáncer a través de efectos sobre la progresión del ciclo celular, la apoptosis, la angiogénesis y la metástasis (Salomon y col., 2001; Arteaga, 2002; Hirsch y col., 2003, Lung Cancer; Ciardello y Tortora, 2001) . Hirsch, y col., Epidermal Growth Factor Receptor in Non-Small Cell Lung Carcinomas: Correlation Between Gene Copy Number and Protein Expression and Impact on Prognosis, Journal of Clinical Oncology, 21 (20) : 3798-807 (2003) , describen estudios del papel del pronóstico de la expresión de proteína de EGFR y el número de copias del gen y descubrieron que la expresión de la proteína de EGFR correlacionada con el aumento del número de copias génicas, y que el alto número de copias génicas por célula mostró una tendencia hacia un mal pronóstico del paciente. La solicitud PCT Nº PCT/JP03/06988 (documento WO 03/101491 MITSUBISHI PHARMA CORP 11 de diciembre de 2003 describe ciertos inhibidores de Her2 y/o EGFR que se van a administrar a sujetos que muestran sobreexpresión o activación de Her2 y/o EGFR, y composiciones farmacéuticas que contienen los inhibidores. EGFR se sobreexpresa en muchas neoplasias epiteliales humanas, incluyendo NSCLC (Hirsch y col., 2003, J. Clin. Oncol.; Salomon y col., 1995) .
Dada la importancia biológica de la red molecular de EGFR en los carcinomas, se sintetizaron varias moléculas para inhibir el dominio de la tirosina cinasa de EGFR (Levitzki y Gazit, 1995; Levitt y Koty, 1999) . Entre los más prometedores de estos nuevos fármacos se encuentran gefitinib (ZD 1839, Iressa®, AstraZeneca, Reino Unido) y erlotinib (OSI 774, Tarceva®, Genntech, Estados Unidos) . Ambos son inhibidores de la tirosina cinasa de EGFR selectivos activos por vía oral (EGFR-TKI) que demostraron actividad antitumoral frente a una diversidad de líneas celulares de cáncer humano que expresan EGFR (Ciardiello y col., 2000) . De la misma manera, ambos tienen una actividad bien documentada como agentes individuales en estudios de fase I, incluyendo pacientes de NSCLC resistentes a la quimioterapia que tenían tasas de respuesta de aproximadamente el 10 % (Kris y col., 2000, Lung Cancer; Baselga y col., 2002; Herbst y col., 2002; Ranson y col., 2002; Hidalgo y col., 2001) . La actividad se confirmó en estudios de fase II grandes que mostraban tasas de respuesta del 19-26 % en pacientes con NSCLC avanzado no tratados previamente, y el 12-18 % en pacientes en los que no habían tenido éxito en una o más combinaciones de quimioterapia anteriores (Fukuoka y col., 2003; Kris y col., 2003, JAMA; Perez-Soler y col., 2001; Miller y col., 2003) . Más recientemente, un estudio de fase III (BR21) que comparaba erlotinib con placebo como una terapia de segunda o tercera línea notificó un beneficio en la supervivencia para el inhibidor del EGFR (Relación de Riesgo: 0, 73) (Shepherd y col., 2004) . De forma importante, este beneficio en la supervivencia no se limitó a los respondedores objetivos, ni a un único género o histología, que hace la selección en base a características clínicas e histopatológica difíciles.
En estudios de fase II con gefitinib, no se detectó ninguna correlación entre la expresión de la proteína de EGFR y la respuesta a la terapia, aunque pocos estudios han abordado directamente esta cuestión. Los pacientes con carcinomas de células escamosas tenían tasas de respuesta inferiores en comparación con pacientes con adenocarcinoma a pesar de sus mayores tasas de expresión de EGFR (Ciardiello y col., 2000; Fukuoka y col., 2003; Kris y col., 2003, JAMA) . Informes recientes mostraron que las mutaciones de sentido erróneo y de deleción específicas en la dominio de la tirosina cinasa del gen EGFR (Lynch y col, 2004; Paez y col., 2004) están relacionados significativamente con la sensibilidad a gefitinib. Sin embargo, aunque se ha notificado una respuesta objetiva en hasta el 18 % y una mejora sintomática del 40 % de gefitinib de NSCLC tratados con gefitinib no seleccionados (Fukuoka y col., 2003; Kris y col., 2003, JAMA) , la frecuencia de estas mutaciones en pacientes estadounidenses no seleccionados es baja (Paez y col., 2004) . Estas observaciones y el hallazgo de que puede detectarse una respuesta objetiva en pacientes que llevan aparentemente un alelo de tipo salvaje del gen EGFR (Lynch y col., Pao y col., Han y col. (JCO, 23: 2493, 2005) , Mitsudomi y col., JCO 23: 2513, 2005, Kim y col., de Clinical Cancer Res, 11: 2244, 2005) sugieren que también están implicados otros mecanismos en la respuesta a gefitinib. Además, mientras estas mutaciones de activación identifican pacientes con altas tasas de respuesta, no pueden considerarse para las altas tasas de enfermedad estable, que se producen en aproximadamente el 30 % de pacientes de NSCLC tratados con gefitinib (Fukuoka y col., 2003; Kris y col., 2003, JAMA) .
En resumen, no hay ningún criterio de selección fiable para determinar que pacientes con cáncer, incluyendo pacientes de NSCLC, se beneficiarán del tratamiento con inhibidores del EGFR ilustrados por, pero sin limitación, gefitinib. Por lo tanto, es de gran interés identificar tanto pacientes que se beneficiarían de inhibidores del EGFR como pacientes que no van a beneficiarse de tal terapia, así como identificar los tratamientos que pueden mejorar la sensibilidad... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para obtener una puntuación de expresión correlacionada con un aumento del número de copias del gen EGFR que predice la respuesta de una persona a una terapia de inhibidor del EGFR, en un especimen tisular obtenido de una persona que tiene o se sospecha que tiene cáncer, que comprende:
a) determinar por inmunohistoquímica una puntuación de fracción, donde la puntuación de fracción corresponde al porcentaje de células en el especimen tisular que tienen una tinción positiva para una puntuación de la proteína de EGFR y se expresa como un número entre 0 y 100 que corresponde al porcentaje de células en la muestra de células tumorales que tiene una tinción positiva para la proteína entre el 0 % y el 100 %;
b) determinar una puntuación de intensidad que corresponde a la intensidad de tinción del biomarcador en la muestra de células tumorales y se expresa en un número de al menos 1 y no más de 4 correspondiente a la intensidad de la tinción de la proteína en la muestra de células tumorales;
c) calcular una puntuación de expresión que es el producto de la puntuación de fracción y la puntuación de intensidad y se expresa en un número entero entre 0 y 400;
d) seleccionar a la persona como predestinada a responder a la administración terapéutica de un inhibidor de EGFR, si la puntuación de expresión es igual a o mayor de 200; o e) seleccionar a la persona como predestinada a no responder a la administración terapéutica de un inhibidor de EGFR, si la puntuación de expresión es menor de 200.
2. El procedimiento de la reivindicación 1, en el que la determinación inmunohistoquímica se realiza usando un 20 anticuerpo que reconoce específicamente la proteína de EGFR.
Patentes similares o relacionadas:
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]
MÉTODOS PARA EL DIAGNÓSTICO DE ENFERMOS ATÓPICOS SENSIBLES A COMPONENTES ALERGÉNICOS DEL POLEN DE OLEA EUROPAEA (OLIVO), del 23 de Julio de 2020, de SERVICIO ANDALUZ DE SALUD: Biomarcadores y método para el diagnostico, estratificación, seguimiento y pronostico de la evolución de la enfermedad alérgica a polen del olivo, kit […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Secuenciación dirigida y filtrado de UID, del 15 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para generar una biblioteca de polinucleótidos que comprende: (a) generar una primera secuencia del complemento (CS) de un polinucleótido diana a partir […]
Métodos para la recopilación, estabilización y conservación de muestras, del 8 de Julio de 2020, de Drawbridge Health, Inc: Un método para estabilizar uno o más componentes biológicos de una muestra biológica de un sujeto, comprendiendo el método obtener un […]
Evento de maíz DP-004114-3 y métodos para la detección del mismo, del 1 de Julio de 2020, de PIONEER HI-BRED INTERNATIONAL, INC.: Un amplicón que consiste en la secuencia de ácido nucleico de la SEQ ID NO: 32 o el complemento de longitud completa del mismo.
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Aislamiento de ácidos nucleicos, del 24 de Junio de 2020, de REVOLUGEN LIMITED: Un método de aislamiento de ácidos nucleicos que comprenden ADN de material biológico, comprendiendo el método las etapas que consisten en: (i) efectuar un lisado […]