Método de marcaje de una molécula biológicamente activa con una 5-fluoro-5-desoxipentosa o una 3-fluoro-3-desoxipentosa.
Un conjugado de una molécula biológicamente activa y una 5-18fluoro-5-desoxipentosa o una 3-18fluoro-3- desoxipentosa,
en el que la molécula biológicamente activa se selecciona del grupo que consiste en proteínas, péptidos, ácidos nucleicos, oligosacáridos y polisacáridos; y la 5-18fluoro-5-desoxipentosa o 3-18fluoro-3- desoxipentosa es opcionalmente una 5-18fluoro-2,5-didesoxi-pentosa, 3-18fluoro-2,3-didesoxi-pentosa, 5-18fluoro- 2,3,5-tridesoxi-pentosa o 3-18fluoro-2,3,5-tridesoxi-pentosa, en donde las posiciones 2 de cada una de entre la 5- 18fluoro-2,5-didesoxi-pentosa, 3-18fluoro-2,3-didesoxi-pentosa, 5-18fluoro-2,3,5-tridesoxi-pentosa y 3-18fluoro-2,3,5- tridesoxi-pentosa, la posición 3 de las 5-18fluoro-2,3,5-tridesoxi-pentosas y la posición 5 de las 3-18fluoro-2,3,5- tridesoxi-pentosas tienen un sustituyente seleccionado, independientemente, del grupo que consiste en hidrógeno, halo, alquilo, alquenilo, alquinilo, amino, dialquilamino y alcoxi
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2012/000505.
Solicitante: University Court of The University of St Andrews.
Inventor/es: O\'HAGAN,DAVID, LI,XIANG-GUO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K51/08 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 51/00 Preparaciones que contienen sustancias radioactivas utilizadas para la terapia o para el examen in vivo. › Péptidos, p. ej. proteínas.
PDF original: ES-2523070_T3.pdf

Fragmento de la descripción:
Método de mareaje de una molécula biológicamente activa con una 5-fluoro-5-desoxipentosa o una 3-fluoro-3- desoxipentosa
Antecedentes
La presente invención se refiere a conjugados de compuestos biológicamente activos, tales como proteínas o péptidos, y 5-18fluoro-5-desoxipentosas o 3-18fluoro-3-desoxipentosas, a procedimientos de fabricación de los mismos y al uso de dichos conjugados que comprenden 5- F-5-desoxipentosas o 3-18F-3-desoxipentosas en la formación de imágenes, en particular, la formación de imágenes mediante tomografía por emisión de positrones.
Introducción
El isótopo de flúor-18 tiene un uso muy extendido para aplicaciones médicas de formación de imágenes por tomografía de emisión de positrones (PET). Tiene una semivida de 11 minutos y, por lo tanto, los métodos para preparar y manipular las moléculas que contienen 18F han de ser rápidos. El hidrato de carbono más comúnmente usado para la PET es la 2-18fluoro-2-desoxiglucosa (2-[18F]-FDG, comúnmente denominada FDG, es decir, de modo que el contexto implica el mareaje con 18F), lo que representa más del 9 % de todos los estudios de mareaje con flúor-18 en el campo clínico a nivel internacional. La FDG se administra más comúnmente a pacientes con cáncer para la detección y monitorización de tumores, y, por esta razón, la 2-FDG se prepara rápidamente a partir de fluoruro-18 (producido en un ciclotrón) en muchos centros de PET y hospitales de todo el mundo.
Hay una demanda creciente por el mareaje, o la ligadura, de entidades biológicamente activas, tales como péptidos y proteínas, con 18F. Los péptidos y las proteínas se pueden diseñar específicamente para que reconozcan los tipos de tejidos enfermos o de células enfermas y, si se marcan con flúor-18 y se inyectan en un paciente, se puede generar una imagen de los tipos de tejidos/células enfermos. Por lo tanto, los conjugados de proteínas que contienen 18F se pueden usar para la formación de imágenes (por ejemplo, mediante PET), permitiendo de este modo a los médicos diagnosticar o controlar la enfermedad.
Un desafío tecnológico significativo radica en lograr la unión eficaz del isótopo de flúor-18 con la proteína. En este sentido, se han usado moléculas pequeñas hidrófobas que contienen 18F, incluyendo compuestos fluoroaromáticos tales como 4-[18F]-fluorobenzaldehído. Sin embargo, es deseable añadir marcadores hidrosolubles de manera que las propiedades globales de la proteína marcada con 18F resultante no se desvíen demasiado significativamente de las de la proteína precursora.
Los hidratos de carbono pequeños ofrecen la oportunidad de abordar el problema encontrado con el uso de los compuestos fluoroaromáticos y, en dicho contexto, la FDG se ha explorado ampliamente como la molécula de mareaje (véase, por ejemplo, el documento WO 25/86612 A2 (Immunomedics, Inc.), porque se puede obtener fácilmente, debido a su uso clínico existente. La ligadura de FDG a las proteínas sigue suponiendo un reto químico, pues se han desarrollado pocos métodos de conjugación eficaces. La formación de oximas, sin embargo, es uno de los métodos más adaptables para lograr la ligadura de los azúcares (véase R. Haubner, H. J. Wester, F. Burkhart, R. Senekowitsch-Schmidtke, W. Weber, S. L. Goodman, H. Kessler y M. Schwaiger, J. Nucí. Med. 21, 42, 326-336; M. Schottelius, F. Rau, J. C. Reubi, M. Schwaiger y H-J. Wester, Bioconjugate Chem. 25, 16, 429-437; R. D. Egleton y T. P. Davis, Neurofíx, 25, 2, 44-53; y D. E. Olberg y O. K. Hjelstuen, Curr. Topics Med. Chem., 21, 1, 1669-1679).
Hasta la fecha, la FDG es, de hecho, el único azúcar fluorado que se ha usado para formar oximas con péptidos. Convenientemente, la FDG se prepara en, o se envía a, prácticamente todos los centros de PET del mundo. Sin embargo, un problema importante con las ligaduras de proteína y FDG es la baja eficacia en la formación de los conjugados deseados, por ejemplo, a través de la formación de oximas. Por consiguiente, se han de usar temperaturas de reacción altas (hasta 13 2C) y valores de pH muy bajos (tan bajos como de 1-2) para permitir la eficacia adecuada de las reacciones de conjugación. No obstante, dichas condiciones no son deseables: la alta temperatura y el bajo pH no son adecuados para la mayoría de las proteínas y los péptidos, que son susceptibles a la degradación en dichas condiciones.
Dos publicaciones recientes (de 21) han descrito el desarrollo de métodos alternativos, más elaborados, para abordar el problema de la baja eficacia de la ligadura de la FDG con proteínas.
El primero implicaba una inhibición basada en un mecanismo de la enzima glucocerebrosidasa (GCasa) por [18F]- FDG, que aseguró una molécula de [18F]-FDG en el sitio activo (C. P. Phenix, B. P. Rempel, K. Colobong, D. J. Doudet, M. J. Adam, L. A. Clarke y S. G. Withers. PNAS, 21, 17, 1842-1847). Sin embargo, dicho método se restringe a la enzima GCasa y enzimas relacionadas, y, por lo tanto, no es de aplicación general.
El segundo método descrito implica la incorporación inicial de una azida en la posición 1 de la FDG para permitir una reacción denominada de "clic" con un aminoácido que contiene acetileno diseñado por ingeniería genética en la
proteína (véase O. Boutureira, F. D'Hooge, M. Fernandez-Gonzalez, G. J. L. Bernardes, M. Sanchez-Navarro, J. R. Koeppe y B. G. Davis, Chem. Commun., 21, 46, 8142-8144; S. Maschauer y O. Prante, Carbohydr. Res. 29, 344, 753-761; S. Maschauer, J. Einsiedel, R. Flaubner, C. Flocke, M. Ocker, H. Flubner, T. Kuwert, P. Gmeiner y O. Prante, Angew. Chem. Int. Ed. 21, 49, 976-979; y O. Prante, J. Einsiedel, R. Flaubner, P. Gmeiner, H.-J. Wester, T. Kuwert y S. Maschauer, Bioconjugate Chem. 27, 18, 254-262). La necesidad de modificar la FDG con el fin de permitir la introducción de la funcionalidad azida reduce la eficacia global del proceso de conjugación, lo que no es deseable.
Por tanto, es deseable proporcionar una forma alternativa de fabricación de moléculas biológicamente activas marcadas con 18F, tales como proteínas y péptidos, para abordar una o más de las deficiencias de la técnica descrita o a la que se ha hecho alusión anteriormente.
Sumario
Habiéndose estudiado la baja eficacia de las reacciones de formación de oximas entre la FDG y las proteínas, los presentes inventores han postulado que esta se puede deber a la tendencia de la FDG a existir en una forma de piranosa de anillo cerrado en lugar de en forma de un compuesto que contiene aldehido de anillo abierto. Si bien este es un fenómeno bien conocido para las aldohexosas, los presentes inventores piensan que, con la FDG, la ubicación del átomo de flúor electronegativo en la posición 2 suprimirá la apertura del anillo en el aldehido y dirigirá el equilibrio todavía más hacia la forma de piranosa, suprimiendo así la velocidad de conjugación con una molécula que contiene aminooxi. Cuando se desea hacer reaccionar la funcionalidad aldehido con una funcionalidad aminooxi para proporcionar una oxima, los presentes inventores piensan que dicha tendencia podría explicar las bajas eficacias de ligadura en la técnica anterior.
Los presentes inventores piensan que, además de la colocación específica del flúor, un anillo de 5 miembros se abre más rápidamente que un anillo de 6 miembros.
Como consecuencia de dichas consideraciones, pero sin quedar limitados a las mismas, se ha encontrado que las 5- fluoro-5-desoxi-pentosas o las 3-fluoro-3-desoxi-pentosas, por ejemplo, las 5-18fluoro-5-desoxi-pentosas o las 3- 18fluoro-3-desoxi-pentosas, participan de manera más eficaz en las reacciones de ligadura, en particular, en las reacciones de ligadura que implican la aminación del grupo carbonita en la forma de cadena abierta de dichas desoxipentosas, que las moléculas de hidrato de carbono fluoradas, en general, y la FDG, en particular.
Por lo tanto, vista desde un primer aspecto, la invención proporciona un conjugado que comprende una molécula biológicamente activa y una 5-18fluoro-5-desoxipentosa o una 3-18fluoro-3-desoxipentosa.
Vista desde un segundo aspecto, la invención proporciona un método de fabricación de un conjugado de acuerdo con el primer aspecto de la invención que comprende la reacción de una molécula biológicamente activa con una 5- 18fluoro-5-desoxipentosa o una 3-18fluoro-3-desoxipentosa.
Vista desde un tercer aspecto, la invención proporciona una composición que comprende un conjugado del primer aspecto de la invención junto con un vehículo o diluyente farmacéuticamente aceptable.
Vista desde un cuarto aspecto, la invención proporciona un conjugado o una composición de la invención para su uso en un método de diagnóstico practicado en el cuerpo humano... [Seguir leyendo]
Reivindicaciones:
1. Un conjugado de una molécula biológicamente activa y una 5-18fluoro-5-desoxipentosa o una 3-18fluoro-3- desoxipentosa, en el que la molécula biológicamente activa se selecciona del grupo que consiste en proteínas, péptidos, ácidos nucleicos, oligosacáridos y polisacáridos; y la 5-18fluoro-5-desoxipentosa o 3- 8fluoro-3- desoxipentosa es opcionalmente una 5-18fluoro-2,5-didesoxi-pentosa, 3-18fluoro-2,3-didesoxi-pentosa, 5-18fluoro- 2,3,5-tridesoxi-pentosa o 3-18fluoro-2,3,5-tridesoxi-pentosa, en donde las posiciones 2 de cada una de entre la 5- 18fluoro-2,5-didesoxi-pentosa, 3-18fluoro-2,3-didesoxi-pentosa, 5-18fluoro-2,3,5-tridesoxi-pentosa y 3-18fluoro-2,3,5- tridesoxi-pentosa, la posición 3 de las 5-18fluoro-2,3,5-tridesoxi-pentosas y la posición 5 de las 3-18fluoro-2,3,5- tridesoxi-pentosas tienen un sustituyeme seleccionado, independientemente, del grupo que consiste en hidrógeno, halo, alquilo, alquenilo, alquinilo, amino, dialquilamino y alcoxi.
2. El conjugado de la reivindicación 1, en el que la 5-18fluoro-5-desoxipentosa o la 3-18fluoro-3-desoxipentosa es una aldodesoxipentosa y/o es una 2-desoxipentosa.
3. El conjugado de una cualquiera de las reivindicaciones anteriores, en el que la 5-18fluoro-5-desoxipentosa o la 3- 18fluoro-3-desoxipentosa es una desoxi-D-ribosa.
4. El conjugado de una cualquiera de las reivindicaciones anteriores, en el que la molécula biológicamente activa está conjugada a la desoxipentosa a través de un resto enlazador.
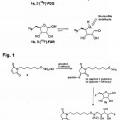
5. El conjugado de una cualquiera de las reivindicaciones anteriores, en el que la molécula biológicamente activa está conjugada a la desoxipentosa a través de un enlace de oxima, hidrazona o tiosemicarbazona, opcionalmente, en donde la molécula biológicamente activa está conjugada con la desoxipentosa a través de un enlace de oxima, por ejemplo, que tiene una de las siguientes estructuras:
Estructura 1:
Estructura 3:
**(Ver fórmula)**OH
(E/Z) OH H
**(Ver fórmula)**Estructura 2: O
**(Ver fórmula)** **(Ver fórmula)**Estructura 4:
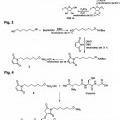
**(Ver fórmula)**Estructura 11:
Estructura 14:
OH
(E/Z) OH OH
OH OH
**(Ver fórmula)**Estructura 12:
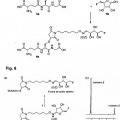
OH
Estructura 15:
OH OH
**(Ver fórmula)** **(Ver fórmula)**H
F
(i) OH OH
N
H
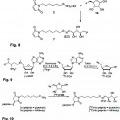
Estructura 13:
Estructura 16:
**(Ver fórmula)**H (<*/)
H
(a/p)
**(Ver fórmula)**en las que R indica la molécula biológicamente activa.
6. El conjugado de una cualquiera de las reivindicaciones anteriores, en el que la molécula biológicamente activa es una proteína o un péptido.
18fluoro-D-ribosa o 3-desoxi-3-18fluoro-D-ribosa.
8. El conjugado de una cualquiera de las reivindicaciones anteriores, en el que la 5-18fluoro-5-desoxipentosa o la 3- 18fluoro-3-desoxipentosa es una 5-18fluoro-5-desoxipentosa.
9. El conjugado de una cualquiera de las reivindicaciones anteriores, en el que la 5-18fluoro-5-desoxipentosa o la 3- 18fluoro-3-desoxipentosa es 5-desoxi-5-18fluoro-D-ribosa.
1. Un método de preparación de un conjugado según lo definido en una cualquiera de las reivindicaciones 1 a 9, que comprende hacer reaccionar una molécula biológicamente activa con una 5-18fluoro-5-desoxipentosa o una 3- 18fluoro-3-desoxipentosa; y la 5-18fluoro-5-desoxipentosa o la 3-fluoro-3-desoxipentosa es opcionalmente una 5- 18fluoro-2,5-didesoxi-pentosa, 3-18fluoro-2,3-didesoxi-pentosa, 5-18fluoro-2,3,5-tridesoxi-pentosa o 3-18fluoro-2,3,5- tridesoxi-pentosa.
11. El método de la reivindicación 1, en el que la molécula biológicamente activa que se ha hecho reaccionar se derivatiza con un resto enlazador, opcionalmente, en donde el resto enlazador muestra un resto amino nucleófilo tal como un grupo con funcionalidad amino, aminooxi, hidrazido o tiosemicarbazido, por ejemplo, en el que la molécula biológicamente activa comprende un grupo funcional aminooxi.
12. Una composición que comprende un conjugado según lo definido en una cualquiera de las reivindicaciones 1 a 9 junto con un vehículo o diluyente farmacéuticamente aceptables.
13. Un conjugado de una 18F-desoxipentosa según lo definido en una cualquiera de las reivindicaciones 1 a 9 para su uso en un método de diagnóstico practicado sobre el cuerpo humano o animal.
14. Un conjugado de una 18F-desoxipentosa según lo definido en una cualquiera de las reivindicaciones 1 a 9 o una composición según lo definido en la reivindicación 12 para su uso en un método de diagnóstico de una enfermedad o afección, en el que el conjugado o la composición se administran a un sujeto, se forman imágenes de la distribución del 18F en el sujeto y, si está presente en el sujeto, se diagnostica la enfermedad o la afección.
15. Un conjugado de una 18F-desoxipentosa según lo definido en una cualquiera de las reivindicaciones 1 a 9 o una composición según lo definido en la reivindicación 12 para su uso en un método de formación de imágenes en un sujeto, que comprende administrar por administración parenteral, por ejemplo, por inyección, un conjugado o una composición de la invención al sujeto, y la formación de imágenes de la distribución del 18F en el sujeto, normalmente, usando una PET.
**(Ver fórmula)**
Patentes similares o relacionadas:
Composiciones radiofarmacéuticas, del 20 de Mayo de 2020, de Serac Healthcare Limited: Una composición radiofarmacéutica que comprende (i) 99mTc-maraciclatida; (ii) un radioprotector seleccionado entre ácido para-aminobenzoico o una sal […]
Método de formación de imágenes con un compuesto quelante, del 13 de Mayo de 2020, de ENDOCYTE, INC.: Un método de obtención de una imagen de un cáncer, comprendiendo el método administrar a un paciente un compuesto sin marcar de acuerdo con la Fórmula I **(Ver fórmula)** […]
Agentes PD-1 de alta afinidad y procedimientos de uso, del 6 de Mayo de 2020, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Un polipéptido de muerte celular programada de alta afinidad 1 (PD-1), donde el polipéptido es una variante de la secuencia de PD-1 natural humano […]
Péptidos cíclicos de localización en NTCP y sus usos como inhibidores de entrada, del 6 de Mayo de 2020, de Ruprecht-Karls-Universität Heidelberg: Un péptido cíclico de la fórmula general Ia cyclo[(X)m-P-(Y)n] (Ia) en el que P es la secuencia de aminoácidos NPLGFXaaP (SEQ. ID NÚM.: […]
Procedimientos y kits para preparar complejos de radionúclidos, del 1 de Abril de 2020, de Theragnostics Limited: Un procedimiento de preparación de un complejo que comprende un radioisótopo de galio para su uso en radioterapia o en un procedimiento de diagnóstico por imágenes […]
Formulación liposomal novedosa para la administración hepática oral de fármacos, del 11 de Diciembre de 2019, de UNIVERSITAT HEIDELBERG: Una composición liposomal que comprende: (a) liposomas que comprenden lípidos de tetraéter (TEL), y (b) el lipopéptido Myr-HBVpreS/2-48 (Myrcludex B) como […]
Conjugados de RGD-(bacterio)clorofila para uso en el diagnóstico de tumores que comprenden dominios necróticos, del 16 de Octubre de 2019, de YEDA RESEARCH AND DEVELOPMENT COMPANY, LTD.: Un conjugado de un péptido que contiene RGD o un peptidomimético de RGD y un fotosensibilizador de clorofila o bacterioclorofila para uso en el diagnóstico de […]
Método de radiomarcaje, del 2 de Octubre de 2019, de GE HEALTHCARE LIMITED: Un método de preparación de una composición liofilizada de molécula de direccionamiento biológico funcionalizada con aminooxi que comprende: (i) purificación cromatográfica […]