Urato oxidasa sin agregados para la preparacion de conjugados poliméricos no inmunogénicos.
Un conjugado de uricasa que comprende una urato oxidasa purificada (uricasa) conjugada con poli(etilen glicol) o poli(etilen óxido),
en el que dicha uricasa contiene formas tetraméricas y octaméricas purificadas de la uricasa que se pueden preparar por eliminación de los agregados mayores que octámeros, en el que dicha uricasa no contiene más de aproximadamente 2% de agregados mayores que octámeros.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2001/040069.
Solicitante: MOUNTAIN VIEW PHARMACEUTICALS, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 3475-S EDISON WAY MENLO PARK, CA 94025-1813 ESTADOS UNIDOS DE AMERICA.
Inventor/es: WILLIAMS, L., DAVID, HERSHFIELD, MICHAEL, S., KELLY, SUSAN, J., SAIFER, MARK, G., P., SHERMAN, MERRY, R..
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- A61K38/44 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Oxidoreductasas (1).
- A61K47/48
- A61P19/06 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 19/00 Medicamentos para el tratamiento de problemas del esqueleto. › Agentes antigotosos, p.ej.agentes antihiperuricémicos o uricosúricos.
- C12N15/53 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Oxidorreductasas (1).
- C12N9/06 C12N […] › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › actúan sobre compuestos que contienen nitrógeno como dadores (1.4, 1.5, 1.7).
- C12N9/96 C12N 9/00 […] › Estabilización de una enzima por formación de un aducto o de una composición; Formación de conjugaciones de enzimas.
PDF original: ES-2343105_T3.pdf
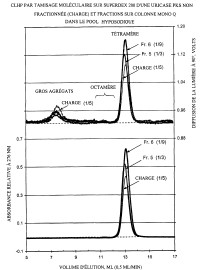
Fragmento de la descripción:
Urato oxidasa sin agregados para la preparación de conjugados poliméricos inmunogénicos.
Declaración de los derechos del gobierno en la invención
Una parte de la investigación descrita en esta solicitud se hizo con el apoyo de la U.S.-Israel Binational Industrial Research and Development Foundation. De acuerdo con esto, el Gobierno de EEUU puede tener determinados derechos en la invención.
Antecedentes de la invención
La presente invención se refiere a la purificación y modificación química de proteínas para prolongar sus vidas medias circulantes y reducir su inmunogenicidad. Más específicamente, la invención se refiere a la eliminación de agregados mayores que octámeros de urato oxidasas (uricasas) antes de la conjugación con poli(etilen glicoles) o poli(etilen óxidos). Esto elimina sustancialmente la inmunogenicidad de la uricasa sin comprometer su actividad uricolítica.
Las declaraciones contenidas en esta sección de antecedentes no constituyen una admisión de la técnica anterior, en lugar de esto reflejan los comentarios subjetivos del propio inventor sobre el estado de la técnica y las interpretaciones del estado de la técnica en el momento en el que se hizo la invención. Estas interpretaciones pueden incluir la visión personal, no descrita hasta este momento, de los inventores, cuyas visiones no eran parte en sí mismas de la técnica anterior.
Las urato oxidasas (uricasas; E.C. 1.7.3.3) son enzimas que catalizan la oxidación del ácido úrico a un producto más soluble, alantoína, un metabolito de purina que se excreta más fácilmente. Los seres humanos no producen uricasa enzimáticamente activa, como resultado de varias mutaciones en el gen de la uricasa adquiridas durante la evolución de los primates superiores. Wu, X, et al., (1992) J Mol Evol 34:78-84. Consecuentemente, en individuos susceptibles, concentraciones excesivas de ácido úrico en la sangre (hiperuricemia) y en la orina (hiperuricosuria) pueden dar lugar a artritis dolorosa (gota), depósitos de urato desfigurantes (tofos) y fallo renal. En algunos individuos afectados, los fármacos disponibles tales como allopurinol (un inhibidor de la síntesis del ácido úrico) producen efectos adversos que limitan el tratamiento o no alivian estas condiciones adecuadamente. Hande, KR, et al., (1984) Am J Med 76:47-56; Farn, AG, (1990) Baillière's Clin Rheumatol 4:177-192. Las inyecciones de uricasa pueden disminuir la hiperuricemia y la hiperuricosuria, al menos temporalmente. Como la uricasa es una proteína extraña para los seres humanos, sin embargo, incluso la primera inyección de la proteína no modificada de Aspergillus flavus indujo reacciones anafilácticas en un cierto porcentaje de pacientes tratados (Pui, C-H, et al., (1997) Leukemia 11:1813-1816), y las respuestas inmunológicas limitan su utilidad para el tratamiento crónico o intermitente. Donadio, D, et al., (1981) Nouv Presse Méd 10:711-712; Leaustic, M, et al., (1983) Rev Rhum Mal Osteoartic 50:553-554.
La Solicitud de Patente de EEUU No. de Serie 09/370.084 y la Solicitud Internacional publicada No. PCT/US99/ 17514, describen poli(etilen glicol)-urato oxidasa (PEG-uricasa) que retiene al menos aproximadamente 75% de la actividad uricolítica de la uricasa no conjugada y tiene una inmunogenicidad sustancialmente reducida. En dicha uricasa purificada, cada subunidad está unida covalentemente a una media de 2 a 10 cadenas de PEG, en la que cada molécula de PEG puede tener un peso molecular de aproximadamente 5 kDa y 100 kDa.
Se sabe que la agregación de proteínas incrementa su inmunogenicidad. Este conocimiento ha contribuido al desarrollo de métodos para agregar proteínas intencionadamente por tratamientos tales como desnaturalización térmica y entrecruzamiento por exposición a glutaraldehído antes de usarse en la preparación de vacunas o para la inmunización de animales para producir antisueros.
También se ha admitido que la agregación no intencionada de proteínas contribuye a la inmunización o sensibilización durante el uso clínico de proteínas terapéuticas, p. ej. para la gamma globulina humana (Henney et al. (1988) N. Engl. J. Med. 278:2244-2248) y para la hormona del crecimiento humana (Moore et al. (1980) J. Clin. Endocrinol. Metab. 51:691-697). La contribución de los agregados a la inmunogenicidad del interferón alfa humano se ha demostrado en ratones BALB/c (Braun et al. (1997) Pharm. Res. 14:1472-1478) y se ha desarrollado un ensayo inmunoabsorbente ligado a enzima (ELISA) para su medida (Braun et al. (1997) Pharm. Res. 14:1394-1400).
En contraste con los efectos conocidos de la agregación en la inmunogenicidad de proteínas, no hay publicaciones del efecto de la agregación en la inmunogenicidad de proteínas conjugadas con poli(alquilen glicoles) tales como PEG. Existe una necesidad de conjugados de poli(alquilen glicol)-uricasa que eliminen sustancialmente la inmunogenicidad de la uricasa sin comprometer su actividad uricolítica. La presente invención proporciona dichas composiciones.
Compendio de la invención
La conjugación de proteínas con poli(alquilen glicoles), especialmente PEG, produce conjugados con una inmunogenicidad reducida y una persistencia incrementada en la corriente sanguínea. En un intento de producir conjugados de uricasa sustancialmente no inmunogénicos que retienen sustancialmente toda la actividad uricolítica de la preparación de uricasa no modificada, se descubrió que trazas de agregados grandes de uricasa en el material de partida eran sorprendentemente eficaces para provocar tanto la formación de anticuerpos como el aclaramiento acelerado de la circulación, siendo ambos perjudiciales, después de inyecciones repetidas de los conjugados con PEG preparados a partir de uricasa que contiene dichos agregados. Sorprendentemente, los presentes inventores encontraron que la inmunogenicidad incrementada y el aclaramiento acelerado no eran debidos a la presencia de agregados bien definidos, de tamaño moderado de la subunidad de la uricasa que son mayores que el tetrámero nativo, p. ej. agregados que contienen ocho subunidades (octámeros). La forma octamérica de la uricasa está presente en concentraciones suficientemente altas en la mayoría de las preparaciones de uricasa como para ser detectable por su absorbancia de luz UV, p. ej. a 214 nm ó 276 nm, o por su contribución al índice de refracción u otras medidas de la concentración de proteínas. No obstante, se encontró que los octámeros en sí mismos contribuyen mínimamente a la inmunogenicidad y aclaramiento acelerado de los conjugados PEG-uricasa, en contraste con las cantidades mucho menores de los agregados mucho mayores que no son detectables por absorbancia de UV en las condiciones ensayadas pero que se detectan fácilmente por dispersión de la luz estática (Raleigh) o dinámica. Por lo tanto, se encontró que la eliminación de dichas trazas de agregados muy grandes antes de la conjugación con PEG disminuía la inmunogenicidad y el aclaramiento acelerado de los conjugados PEG-uricasa resultantes en un grado sorprendente.
Una realización de la presente invención es un conjugado de uricasa que comprende una urato oxidasa (uricasa) purificada conjugada con poli(etilen glicol) o poli(etilen óxido), en el que dicha uricasa contiene formas tetraméricas y octaméricas de la uricasa purificadas que se pueden preparar por eliminación de los agregados mayores que octámeros, en el que dicha uricasa no contiene más de aproximadamente 2% de agregados mayores que octámeros. Preferiblemente, la uricasa es una uricasa de mamíferos. Más preferiblemente, la uricasa es uricasa de hígado porcino, hígado bovino o hígado ovino. En un aspecto de esta realización preferida, la uricasa es recombinante. En otro aspecto de esta realización preferida, la uricasa tiene sustancialmente la secuencia de uricasa de hígado porcino, bovino, ovino o de babuino. Ventajosamente, la uricasa es quimérica. Preferiblemente, la uricasa es uricasa PKS. En otro aspecto de esta realización preferida, la uricasa tiene sustancialmente la secuencia de la uricasa de hígado de babuino en la que la tirosina 97 se ha reemplazado por histidina. Preferiblemente, la uricasa comprende un extremo amino terminal y un extremo... [Seguir leyendo]
Reivindicaciones:
1. Un conjugado de uricasa que comprende una urato oxidasa purificada (uricasa) conjugada con poli(etilen glicol) o poli(etilen óxido), en el que dicha uricasa contiene formas tetraméricas y octaméricas purificadas de la uricasa que se pueden preparar por eliminación de los agregados mayores que octámeros, en el que dicha uricasa no contiene más de aproximadamente 2% de agregados mayores que octámeros.
2. El conjugado de uricasa de la Reivindicación 1, en el que la uricasa es uricasa de mamíferos.
3. El conjugado de uricasa de la Reivindicación 2, en el que la uricasa es uricasa de hígado porcino, de hígado bovino o de hígado ovino.
4. El conjugado de uricasa de la Reivindicación 1, en el que la uricasa es recombinante.
5. El conjugado de uricasa de la Reivindicación 4, en el que la uricasa tiene sustancialmente la secuencia de uricasa de hígado porcino, bovino, ovino o de babuino.
6. El conjugado de uricasa de la Reivindicación 1, en el que la uricasa es quimérica.
7. El conjugado de uricasa de la Reivindicación 6, en el que la uricasa quimérica contiene partes de uricasa de hígado porcino y de hígado de babuino.
8. El conjugado de uricasa de la Reivindicación 6, en el que la uricasa quimérica es uricasa porcina en la que el resto de arginina 291 de SEQ ID NO:1 se ha reemplazado por lisina (R291 K) y el resto de treonina 301 de SEQ ID NO:1 se ha reemplazado por serina (T301 S) (uricasa PKS).
9. El conjugado de uricasa de la Reivindicación 4, en el que la uricasa tiene la secuencia de uricasa de hígado de babuino que tiene SEQ ID NO:2 en la que el resto de tirosina 97 de SEQ ID NO:2 se ha reemplazado por histidina.
10. El conjugado de uricasa de la Reivindicación 4, en el que la uricasa comprende un extremo amino terminal y un extremo carboxilo terminal, y en el que la uricasa está truncada en un extremo o en ambos extremos.
11. El conjugado de uricasa de la Reivindicación 1, en el que la uricasa es una uricasa fúngica o microbiana.
12. El conjugado de uricasa de la Reivindicación 11, en el que la uricasa fúngica o microbiana se aísla de Aspergillus flavus, Arthrobacter globiformis, Bacillus sp. o Candida utilis, o es una enzima recombinante que tiene sustancialmente la secuencia de una de dichas uricasas.
13. El conjugado de uricasa de la Reivindicación 1, en el que la uricasa es una uricasa de invertebrados.
14. El conjugado de uricasa de la Reivindicación 13, en el que la uricasa de invertebrados se aísla de Drosophila melanogaster o Drosophila pseudoobscura, o es una enzima recombinante que tiene sustancialmente la secuencia de una de dichas uricasas.
15. El conjugado de uricasa de la Reivindicación 1, en el que la uricasa es una uricasa de plantas.
16. El conjugado de uricasa de la Reivindicación 15, en el que la uricasa de plantas se aísla de nódulos radiculares de Glycine max o es una enzima recombinante que tiene sustancialmente la secuencia de dicha uricasa.
17. El conjugado de uricasa de la Reivindicación 1, en el que dicho poli(etilen glicol) es monometoxi poli(etilen glicol).
18. El conjugado de uricasa de la Reivindicación 1, en el que dicha uricasa se conjuga con dicho poli(etilen glicol) o poli(etilen óxido) mediante una unión seleccionada del grupo que consiste en uretano (carbamato), amina secundaria y amida.
19. El conjugado de uricasa de la Reivindicación 1, en el que dicho poli(etilen glicol) o poli(etilen óxido) tiene un peso molecular entre aproximadamente 5 kDa y 30 kDa.
20. El conjugado de uricasa de la Reivindicación 19, en el que dicho poli(etilen glicol) o poli(etilen óxido) tiene un peso molecular entre aproximadamente 10 kDa y 20 kDa.
21. El conjugado de uricasa de la Reivindicación 1, en el que el número medio de cadenas de dicho poli(etilen glicol) o poli(etilen óxido) es entre aproximadamente 2 y 12 por subunidad de uricasa.
22. El conjugado de uricasa de la Reivindicación 21, en el que el número medio de cadenas de dicho poli(etilen glicol) o poli(etilen óxido) es entre aproximadamente 6 y 10 por subunidad de uricasa.
23. El conjugado de uricasa de la Reivindicación 22, en el que el número medio de cadenas de poli(etilen glicol) o poli(etilen óxido) es entre aproximadamente 7 y 9 por subunidad de uricasa.
24. El conjugado de uricasa de la Reivindicación 1, en el que el poli(etilen glicol) o poli(etilen óxido) es lineal.
25. El conjugado de uricasa de la Reivindicación 1, en el que el poli(etilen glicol) o poli(etilen óxido) es ramificado.
26. Una composición farmacéutica para disminuir los niveles de ácido úrico en un fluido o tejido corporal, que comprende el conjugado de la Reivindicación 1 y un vehículo farmacéuticamente aceptable.
27. La composición farmacéutica de la Reivindicación 26, en la que dicha composición se estabiliza por liofilización y se disuelve después de reconstitución para proporcionar disoluciones adecuadas para la administración parenteral.
28. Un método para purificar uricasa que tiene una inmunogenicidad reducida, que comprende la etapa de separar los agregados de uricasa mayores que octámeros en fracciones de uricasa, y excluir dichos agregados de la uricasa purificada, en el que la uricasa purificada contiene formas tetraméricas y octaméricas purificadas de la uricasa que se pueden preparar por eliminación de los agregados mayores que octámeros, en el que dicha uricasa no contiene más de aproximadamente 2% de agregados mayores que octámeros.
29. El método de la Reivindicación 28, en el que dicha etapa de separación se selecciona del grupo que consiste en cromatografía de intercambio iónico, cromatografía de exclusión por tamaño, y ultrafiltración.
30. El método de la Reivindicación 28, en el que dicha etapa de separación comprende la etapa de detectar los agregados mayores que octámeros en las fracciones de uricasa y excluir dichas fracciones que contienen dichos agregados.
31. Uricasa aislada preparada por el método de la reivindicación 28.
32. Un método para obtener un conjugado de uricasa, comprendiendo dicho método las etapas de:
aplicar una disolución de uricasa que comprende uricasa tetramérica, uricasa octamérica, y agregados de uricasa mayores que octámeros en al menos una columna de separación;
recuperar de dicha columna una o más fracciones que contienen uricasa tetramérica y octamérica aislada que se puede preparar por eliminación de los agregados mayores que octámeros, en el que dicha uricasa no contiene más de aproximadamente 2% de agregados mayores que octámeros; y
PEGilar dicha uricasa.
33. El método de la Reivindicación 32, en el que dicha columna de separación se selecciona del grupo que consiste en columna de intercambio iónico y columna de exclusión por tamaño.
34. El método de la Reivindicación 33, en el que dicha disolución de dicha uricasa se aplica en dicha columna a un pH de 10,2.
35. El método de la Reivindicación 33, que comprende además la etapa de analizar dichas fracciones para determinar al menos una propiedad seleccionada del grupo que consiste en presencia de dicha uricasa octamérica y ausencia de agregados de uricasa que son mayores que octámeros.
36. El método de la Reivindicación 35, en el que dicha etapa de análisis comprende al menos una técnica de análisis seleccionada del grupo que consiste en cromatografía, centrifugación, dispersión de la luz y electroforesis.
37. El método de la Reivindicación 36, en el que dicha cromatografía es cromatografía líquida de alta resolución.
38. Un método para purificar uricasa que tiene una inmunogenicidad reducida, que comprende: separar los agregados de uricasa mayores que octámeros en fracciones de uricasa; y recuperar una fracción, en el que dicha fracción contiene uricasa octamérica pero no contiene agregados de uricasa mayores que octámeros.
39. El conjugado de uricasa de la Reivindicación 1, en el que al menos 2,5% de dicha uricasa está en la forma octamérica.
Patentes similares o relacionadas:
Derivativos del ácido siálico para la derivatización y conjugación de proteínas, del 20 de Diciembre de 2019, de LIPOXEN TECHNOLOGIES LIMITED: Un procedimiento de producción de un derivativo aldehído de un ácido siálico en el que un material de partida que tiene una unidad de ácido siálico en el […]
GELES DE QUITOSANO(A) CONTENIENDO NANOPARTICULAS METALICAS DE COBRE, PLATA Y ANTIBIOTICOS (CIPROFLOXACINO, CEFOTAXIME, GENTAMICINA Y CLOXACILINA), del 12 de Diciembre de 2019, de CARDENAS Y CIA LTDA: En la presente invención se describen geles de quitosano (poli-beta-glucosamina) con propiedades bactericidas y fungicidas en mezcla con nanopartículas […]
Compuestos de polímero de polialquileno y usos de los mismos, del 20 de Noviembre de 2019, de Biogen MA Inc: Una composición farmacéutica que comprende un conjugado y un vehículo, adyuvante, diluyente, conservante y/o solubilizante farmacéuticamente […]
Composiciones y métodos para la liberación dirigida de fármacos in vitro e in vivo a células de mamíferos mediante minicélulas intactas derivadas de bacterias, del 23 de Octubre de 2019, de ENGENEIC MOLECULAR DELIVERY PTY LTD: Una composición que comprende: (a) una pluralidad de minicélulas intactas derivadas de bacterias que tienen paredes celulares intactas, en donde la pluralidad […]
Moléculas con semividas prolongadas, composiciones y usos de las mismas, del 16 de Octubre de 2019, de MEDIMMUNE, LLC: Una molécula modificada que comprende una proteína o agente no de proteína y un dominio constante de IgG, en la que el dominio constante de IgG comprende un dominio CH3 humano […]
Método para la preparación de oligo etilenglicol monodisperso, del 19 de Junio de 2019, de NEKTAR THERAPEUTICS: Un método para preparar un oligo (etilenglicol) monodisperso, comprendiendo dicho método: (i) hacer reaccionar un oligo (etilenglicol) terminado […]
Construcciones de moléculas MHC y sus usos para el diagnóstico y terapia, del 29 de Mayo de 2019, de DAKO DENMARK A/S: Una construcción de moléculas MHC en forma soluble en un medio de solubilización o inmovilizada en un soporte sólido o semi-sólido, comprendiendo dicha construcción de moléculas […]
Usos terapéuticos de anticuerpos monoclonales frente al receptor de la angiotensina II tipo 1, del 17 de Mayo de 2019, de QUEEN MARY AND WESTFIELD COLLEGE: Un anticuerpo monoclonal o un fragmento del mismo que se une al péptido que consiste en la secuencia EDGIKRIQDD para su uso en el tratamiento de la proliferación […]