Soportes para válvulas cardíacas artificiales y estructuras vasculares.
Soporte que comprende una malla de un copolímero de bloques biocompatible,
en donde dicho copolímero de bloques tiene al menos dos unidades de bloques que se pueden obtener mediante policondensación lineal en presencia de diisocianato, haluro de diácido o fosgeno de una primera unidad de bloques que se selecciona entre el grupo que consiste en un diol (I) y un α,ω-dihidroxi-poliéster (IV) con una segunda unidad de bloques que se selecciona entre el grupo que consiste en el mismo diol (I), un α,ω-dihidroxi-poliéster (II), un α,ω-dihidroxi-poliéter (III) y el mismo α,ω-dihidroxi-poliéster (IV),
en donde el diol (I) se puede obtener mediante transesterificación de poli-[ácido(R)-(3)-hidroxibutírico] o copolímeros del mismo con ácido 3-hidroxivalérico con etilenglicol,
en donde cada el α,ω-dihidroxi-poliéster (II) se puede obtener mediante polimerización con apertura de anillo de ésteres cíclicos que se seleccionan entre el grupo que consiste en (L-L)-dilactida, (D-D)-dilactida, (D-L)-dilactida, diglicolida o mezclas de las mismas, o lactonas que se seleccionan entre el grupo que consiste en β-(R)-butirolactona, β-(S)-butirolactona, β-(rac)-butirolactona y β-caprolactona o mezclas de las mismas,
en donde el α,ω-dihidroxi-poliéter (III) se selecciona entre el grupo que consiste en α,ω-dihidroxi-poli(oxitetrametileno), α,ω-dihidroxi-poli(oxietileno) y copolímeros de etilenglicol y propilenglicol.
en donde el α,ω-dihidroxi-poliéster (IV) se puede obtener mediante transesterificación del diol (I) con diglicolida y/o dilactida y/o caprolactona o mezclas de las mismas, caracterizado porque la malla está electrohilada y porque el soporte tiene una estructura de tipo malla formada por fibras de polímeros.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06011911.
Solicitante: EIDGENOSSISCHE TECHNISCHE HOCHSCHULE ZURICH.
Nacionalidad solicitante: Suiza.
Dirección: RAMISTRASSE 101 8092 ZÜRICH SUIZA.
Inventor/es: NEUENSCHWANDER,PETER.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61F2/24 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61F FILTROS IMPLANTABLES EN LOS VASOS SANGUINEOS; PROTESIS; DISPOSITIVOS QUE MANTIENEN LA LUZ O QUE EVITAN EL COLAPSO DE ESTRUCTURAS TUBULARES, p. ej. STENTS; DISPOSITIVOS DE ORTOPEDIA, CURA O PARA LA CONTRACEPCION; FOMENTACION; TRATAMIENTO O PROTECCION DE OJOS Y OIDOS; VENDAJES, APOSITOS O COMPRESAS ABSORBENTES; BOTIQUINES DE PRIMEROS AUXILIOS (prótesis dentales A61C). › A61F 2/00 Filtros implantables en los vasos sanguíneos; Prótesis, es decir, elementos de sustitución o de reemplazo para partes del cuerpo; Dispositivos para unirlas al cuerpo; Dispositivos para proporcionar permeabilidad o para evitar que colapsen las estructuras tubulares del cuerpo, p. ej. stents (como artículos cosméticos, ver las subclases apropiadas, p. ej. pelucas o postizos, A41G 3/00, A41G 5/00, uñas artificiales A45D 31/00; prótesis dentales A61C 13/00; materiales para prótesis A61L 27/00; riñones artificiales A61M 1/14; corazones artificiales A61M 60/00). › Válvulas para el corazón.
- A61L27/18 A61 […] › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › A61L 27/00 Materiales para prótesis o para revestimiento de prótesis (prótesis dentales A61C 13/00; forma o estructura de las prótesis A61F 2/00; empleo de preparaciones para la fabricación de dientes artificiales A61K 6/80; riñones artificiales A61M 1/14). › obtenidos de otro modo que no sea mediante reacciones en las que sólo participan enlaces insaturados carbono-carbono.
- A61L27/38 A61L 27/00 […] › Células animales (para utilizar en piel artificial A61L 27/60).
- A61L27/56 A61L 27/00 […] › Materiales porosos o celulares.
- A61L27/58 A61L 27/00 […] › Materiales al menos parcialmente reabsorbibles por el organismo.
PDF original: ES-2432558_T3.pdf
Fragmento de la descripción:
Soportes para válvulas cardíacas artificiales y estructuras vasculares La presente solicitud se refiere a soportes para válvulas cardíacas artificiales y estructuras vasculares. También se proporcionan un método para producir dichos soportes y medios para usar dicho método.
Las enfermedades vasculares y cardíacas están entre las enfermedades más prominentes en el mundo occidental. En particular, las enfermedades cardíacas son la principal causa de muerte. En los últimos años, una posibilidad para tratar las enfermedades de este tipo, que se ha hecho cada vez más popular y exitosa, utiliza el trasplante de órganos o partes estructurales, por ejemplo, válvulas cardíacas en el caso de disfunción de una válvula cardíaca. Sin embargo, los receptores potenciales superan ampliamente en número a los donantes efectivos de órganos que se necesitan. Así, la demanda creciente crea una constante necesidad de órganos y estructuras artificiales que puedan sustituir al menos temporalmente a los órganos naturales.
Actualmente, se usan implantes sintéticos o implantes naturales de origen animal para resolver la discrepancia entre el número de donantes naturales disponibles y el de potenciales receptores. Sin embargo, presentan numerosos inconvenientes.
Los implantes sintéticos pueden conducir a complicaciones tales como trombosis, un riesgo que resulta incrementado debido a los cambios en el flujo sanguíneo provocados por las válvulas cardíacas artificiales. Por este motivo, los pacientes con válvulas cardíacas artificiales necesitan permanentemente medicamentos anticoagulantes. Además, dichos pacientes son propensos a infecciones que provocan complicaciones que ponen en peligro su vida.
Los implantes de origen natural que se usan para sustitución de válvulas cardíacas se obtienen habitualmente de cerdo o vaca. El tejido de cerdo o vaca se trata con aldehído glutárico. Estos implantes biológicos tienen el inconveniente de que tienden a degenerar al cabo de doce a quince años. Por lo tanto, no son adecuados para los pacientes más jóvenes. Otro riesgo inherente a los implantes biológicos es la transmisión de agentes patógenos, en particular virus. También es posible que los implantes desencadenen reacciones inmunitarias indeseadas y a menudo fatales del sistema inmunitario del hospedador, puesto que el material puede que sea reconocido como tejido extraño.
Un inconveniente adicional de los implantes artificiales tales como las válvulas cardíacas reside en el hecho de que estas estructuras no son estructuras vivas y por lo tanto no se pueden someter a los procesos de reparación o crecimiento que necesita el hospedador. Especialmente los pacientes más jóvenes necesitan por ello operaciones quirúrgicas múltiples lo cual aumenta el propio riesgo de mortalidad.
Por lo tanto, se necesitan implantes que comprendan estructuras artificiales, por ejemplo, un soporte, que se puedan usar para cultivar células. Cultivando células sobre un soporte de este tipo se pretende preparar estructuras híbridas que puedan servir como implantes y puedan proporcionar funciones específicas. Los procesos de este tipo también se denominan ingeniería de tejidos.
La ingeniería de tejidos incluye la preparación de soportes adecuados que sean biocompatibles y preferiblemente degradables. Los implantes híbridos de este tipo deben proporcionar al menos temporalmente una estructura biomecánica que permita que las células cultivadas formen el tejido o estructura que se necesita en la medida que sea posible.
Los materiales biocompatibles empleados en la técnica anterior para los fines anteriormente descritos son poli (ácido glicólico) (PGA) , polihidrooctanoato (PHO) y polihidroxialcanoato (PHA) . Sin embargo, ninguno de estos materiales reúne todas las propiedades que se necesitan en términos de estabilidad mecánica y biocompatibilidad. Los implantes que comprenden PGA son quebradizos. Los implantes que comprenden PHA carecen de la velocidad de degradabilidad requerida y solo se degradan muy lentamente en el cuerpo del paciente.
El problema resuelto por la presente invención es el de proporcionar soportes biocompatibles que se puedan fabricar con la forma deseada y que proporcionan excelentes propiedades para las células que crecen sobre ellos o dentro de los mismos y que son adecuados para uso en implantes.
El problema se resuelve mediante un soporte según la reivindicación 1. Realizaciones preferidas adicionales son submaterias de las reivindicaciones dependientes.
Un soporte de la presente invención comprende una malla electrohilada de un copolímero de bloques que es altamente biocompatible y también biodegradable. La degradabilidad se puede controlar con precisión cambiando ligeramente la composición química del copolímero de bloques biocompatible.
El material de base del soporte es un polímero puro. No se necesitan más aditivos, por ejemplo estabilizadores, antioxidantes, o plastificantes, que podrían afectar adversamente a la excelente biocompatibildad. Propiedades ventajosas adicionales son la elasticidad al tiempo que se mantiene excelente solidez mecánica. Las propiedades mecánicas dependen fuertemente de las propiedades de los dominios cristalinos y no cristalinos de la masa del polímero.
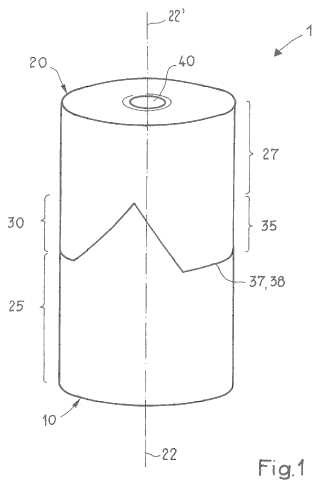
Los soportes según la presente invención tienen una estructura de tipo malla formada por fibras de polímero. La estructura de malla comprende poros abiertos que están presentes en toda la extensión de la totalidad del soporte y que están distribuidos de modo estadísticamente aleatorio por toda la extensión del soporte estructurado.
Además, el tamaño medio de poro varía solamente dentro de un intervalo. La porosidad y el tamaño de poro del soporte de la presente invención se pueden variar hasta cierto punto según las necesidades del uso que se pretende haciendo de los soportes una herramienta muy versátil. La porosidad se puede contralar por una parte mediante la concentración de la disolución del copolímero de bloques y por otra parte mediante la elección del disolvente así como mediante la elección de algunos parámetros de proceso del proceso de electrohilado. Todos los parámetros que contribuyen a la solidez de las fibras en el momento de su deposición sobre la diana, dan estructuras de malla menos densas. El enfriamiento de la diana a temperaturas bajas es por lo tanto una herramienta para controlar la densidad de malla. Las dianas se enfrían a una temperatura en el intervalo de -190ºC a 0ºC, preferiblemente en el intervalo de -65ºC a -55ºC, y lo más preferiblemente a aproximadamente -60ºC. Por ejemplo, la diana se puede enfriar por medios refrigerantes, por ejemplo aplicando gases fríos a la diana. Ejemplos preferidos de gases fríos de este tipo son la evaporación de nitrógeno líquido o CO2 frío. En general, una sección trasversal de un soporte muestra que la capa de polímero que forma el soporte comprende aproximadamente 10% de fibras que forman una malla y aproximadamente 90% de poros abiertos. Esta propiedad hace a dichos soportes un excelente sustrato para el cultivo celular.
Es posible que se difundan líquidos y (macro-) moléculas en el soporte de la presente invención o incluso que pasen a través del mismo. Esta permeabilidad, que obedece a la ecuación de Fick, es una gran ventaja, si el soporte se usa para ingeniería de tejidos. En esta técnica es muy importante que los soportes artificiales permitan el intercambio de gases, por ejemplo, oxígeno, de líquidos y compuestos, por ejemplo, nutrientes y desechos de las células. Si se garantiza dicho intercambio, las células que están en estrecho contacto con dichos soportes pueden proliferar muy bien.
La malla del copolímero de bloques biocompatible se obtiene mediante electrohilado. El método de electrohilado es particularmente adecuado para formar fibras delgadas que se depositan sobre una diana constituyendo una estructura de malla sobre la misma. La diana significa un cuerpo tallado que puede tener diferentes formas, por ejemplo una forma tubular. El soporte según la presente invención comprende fibras de aproximadamente 5 a 10 µm de diámetro y una distancia media entre fibras de aproximadamente 50 µm.
Los soportes según la presente invención comprenden un copolímero de bloques biocompatible. Copolímeros de bloques biocompatibles adecuados se describen en los documentos EP 0 696 605 y WO 2005/007210.
El documento WO2005/106090 describe un método para producir una preforma por medio de un proceso de electrohilado. También se describe el uso de la preforma como sustrato para crecimiento de tejido humano o animal.
Este copolímero de bloques tiene al menos dos unidades de bloques que se pueden obtener mediante... [Seguir leyendo]
Reivindicaciones:
1. Soporte que comprende una malla de un copolímero de bloques biocompatible, en donde dicho copolímero de bloques tiene al menos dos unidades de bloques que se pueden obtener mediante policondensación lineal en presencia de diisocianato, haluro de diácido o fosgeno de una primera unidad de bloques que se selecciona entre el grupo que consiste en un diol (I) y un α, ω-dihidroxi-poliéster (IV) con una segunda unidad de bloques que se selecciona entre el grupo que consiste en el mismo diol (I) , un α, ω-dihidroxi-poliéster (II) , un α, ωdihidroxi-poliéter (III) y el mismo α, ω-dihidroxi-poliéster (IV) ,
en donde el diol (I) se puede obtener mediante transesterificación de poli-[ácido (R) - (3) -hidroxibutírico] o copolímeros del mismo con ácido 3-hidroxivalérico con etilenglicol,
en donde cada el α, ω-dihidroxi-poliéster (II) se puede obtener mediante polimerización con apertura de anillo de ésteres cíclicos que se seleccionan entre el grupo que consiste en (L-L) -dilactida, (D-D) -dilactida, (D-L) -dilactida, diglicolida o mezclas de las mismas, o lactonas que se seleccionan entre el grupo que consiste en β- (R) butirolactona, β- (S) -butirolactona, β- (rac) -butirolactona y ε-caprolactona o mezclas de las mismas,
en donde el α, ω-dihidroxi-poliéter (III) se selecciona entre el grupo que consiste en α, ω-dihidroxipoli (oxitetrametileno) , α, ω-dihidroxi-poli (oxietileno) y copolímeros de etilenglicol y propilenglicol.
en donde el α, ω-dihidroxi-poliéster (IV) se puede obtener mediante transesterificación del diol (I) con diglicolida y/o dilactida y/o caprolactona o mezclas de las mismas, caracterizado porque la malla está electrohilada y porque el soporte tiene una estructura de tipo malla formada por fibras de polímeros.
2. Soporte según la reivindicación 1, en donde la primera unidad de bloques es el α, ω-dihidroxi-poliéster (IV) y la segunda unidad de bloques es el diol (I) .
3. Soporte según la reivindicación 1, en donde la primera unidad de bloques es el α, ω-dihidroxi-poliéster (IV) y la segunda unidad de bloques es el α, ω-dihidroxi-poliéster (II) .
4. Soporte según la reivindicación 1, en donde la primera unidad de bloques es el α, ω-dihidroxi-poliéster (IV) y la segunda unidad de bloques es el α, ω-dihidroxi-poliéter (III) .
5. Soporte según la reivindicación 1, en donde la primera unidad de bloques es el α, ω-dihidroxi-poliéster (IV) y la segunda unidad de bloques es el mismo α, ω-dihidroxi-poliéster (IV) .
6. Soporte según la reivindicación 1 a la 5, en donde el soporte se hace de dicho copolímero de bloques.
7. Soporte según la reivindicación 1 a la 6, en donde se cultivan células, preferiblemente células endoteliales y/o miofibroblastos, sobre dicho soporte.
8. Soporte según la reivindicación 1 a la 7, en donde el soporte tiene forma tubular.
9. Soporte según la reivindicación 1 a la 8, en donde el soporte tiene forma de vaso, preferiblemente de un vaso sanguíneo.
10. Soporte según la reivindicación 1 a la 7, en donde el soporte tiene forma de válvula cardíaca.
11. Soporte según la reivindicación 1 a la 10, en donde el soporte es degradable hidrolíticamente y tiene un tiempo de vida en servicio controlable y conserva su rendimiento desde 5 días hasta 2 años.
12. Método para producir un soporte para ingeniería de tejidos según la reivindicación 1 a la 11, que comprende las etapas: a) fabricar una estructura vehículo con una forma conveniente;
b) disponer una malla de polímero biocompatible sobre dicha estructura vehículo mediante electrohilado; c) retirar la estructura vehículo del soporte.
13. Método según la reivindicación 17, en donde la estructura vehículo se enfría por medios de refrigeración.
14. Método según la reivindicación 13, en donde los medios de refrigeración son gases fríos, preferiblemente nitrógeno o CO2.
15. Método según la reivindicación 12 a la 14, en donde la estructura vehículo tiene forma tubular.
16. Método según la reivindicación 12 a la 15, en donde la estructura vehículo tiene forma de vaso, preferiblemente de un vaso sanguíneo.
17. Método según la reivindicación 12 a la 14, en donde la estructura vehículo tiene forma de válvula cardíaca.
18. Uso del soporte según la reivindicación 1 a la 11 para ingeniería de tejidos.
19. El soporte según la reivindicación 1 a la 11 para uso como implante.
Patentes similares o relacionadas:
Matriz de soporte de injerto para reparación de cartílago y procedimiento de obtención de la misma, del 1 de Julio de 2020, de ETH ZURICH: Un procedimiento de proporción de una matriz de soporte de injerto para reparación de cartílagos, particularmente en un paciente humano, que comprende las etapas de: […]
Métodos y dispositivos para trasplante celular, del 10 de Junio de 2020, de Sernova Corporation: Un dispositivo para implantar células en un cuerpo huésped, que comprende: un andamio poroso que comprende al menos una cámara que tiene un extremo proximal y un extremo […]
Reparación de tejido cartilaginoso, del 27 de Mayo de 2020, de CartiRegen B.V: Un método para la separación electroforética de células a partir de un tejido, comprendiendo el método: a) seccionar un tejido para preparar fragmentos de dicho tejido, […]
Procedimientos de preparación de un hidrogel esterilizado de modo terminal que proviene de matriz extracelular, del 22 de Abril de 2020, de UNIVERSITY OF PITTSBURGH OF THE COMMONWEALTH SYSTEM OF HIGHER EDUCATION: Un procedimiento de preparación de un material digerido de matriz extracelular esterilizado de modo terminal capaz de gelificar, que comprende: (i) solubilizar la matriz […]
Estructuras para trasplante celular, del 15 de Abril de 2020, de PRESIDENT AND FELLOWS OF HARVARD COLLEGE: Un dispositivo que comprende una composición de estructura que presenta macroporos abiertos e interconectados, y que es capaz de controlar en el tiempo […]
Espumas de fibroína de seda inyectables y usos de la misma, del 1 de Abril de 2020, de TRUSTEES OF TUFTS COLLEGE: Un aplicador de inyección que comprende una composición inyectable, la composición inyectable comprende una espuma de fibroína de seda comprimida que tiene […]
 Método para producir colágeno a alta concentración para su uso como material médico, del 25 de Marzo de 2020, de Sewoncellontech Co., Ltd: Método de producción de colágeno a una concentración de 60 mg/ml o más para su uso como material médico, que comprende:
lavar tejido de un mamífero;
[…]
Método para producir colágeno a alta concentración para su uso como material médico, del 25 de Marzo de 2020, de Sewoncellontech Co., Ltd: Método de producción de colágeno a una concentración de 60 mg/ml o más para su uso como material médico, que comprende:
lavar tejido de un mamífero;
[…]
Procedimiento para la multiplicación del cabello in vivo, del 25 de Marzo de 2020, de Prostem International B.V: Procedimiento cosmético para la multiplicación del cabello in vivo, que comprende los pasos de: (a) proporcionar al menos una parte de un folículo piloso en la fase anágena, […]