Síntesis acortada usando paraformaldehído o trioxano.
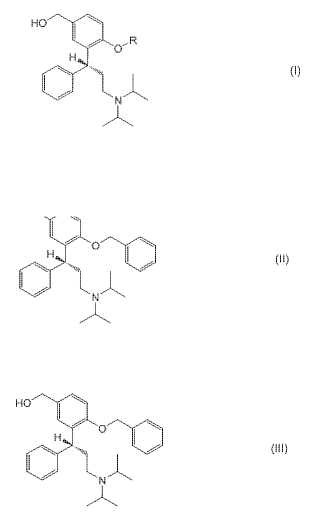
Un procedimiento para preparar un compuesto de fórmula (I)
en donde R es hidrógeno,
un grupo formilo, un grupo alquil(C1-C6)-carbonilo lineal, ramificado o cíclico, o un grupofenilcarbonilo, o una sal del mismo,
caracterizado por las etapas de
a) hacer reaccionar un compuesto de fórmula (II)
con una mezcla de Mg y un iniciador de Grignard de la fórmula R1MgX ó R1MgX/LiCl, en donde R1 representa alquiloC1-C12, alquenilo C2-C6, alquinilo C2-C6, fenilo o fenil-alquilo(C1-C6) sustituido o sin sustituir, en donde dicho feniloestá opcionalmente sustituido, preferiblemente con alquilo(C1-C6), alcoxi(C1-C6) ó CF3, y en donde X se seleccionade bromuro, cloruro y yoduro, en un disolvente para formar un reactivo de Grignard,
b) opcionalmente reducir la temperatura del reactivo de Grignard a una temperatura por debajo de la temperatura dela etapa a) y
c) hacer reaccionar el reactivo de Grignard con paraformaldehído o trioxano para obtener un compuesto de fórmula(III).
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/004976.
Solicitante: SCHWARZ PHARMA LTD.
Nacionalidad solicitante: Irlanda.
Dirección: INDUSTRIAL ESTATE SHANNON COUNTY CLARE IRLANDA.
Inventor/es: KANZLER, RALF, JOHNSON,DEAN,A, ENNIS,SETH, FUCHS,CORNELIA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07C213/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › Preparación de compuestos que contienen grupos amino e hidroxi, amino e hidroxi eterificados o amino e hidroxi esterificados unidos a la misma estructura carbonada.
- C07C213/06 C07C […] › C07C 213/00 Preparación de compuestos que contienen grupos amino e hidroxi, amino e hidroxi eterificados o amino e hidroxi esterificados unidos a la misma estructura carbonada. › a partir de hidroxiaminas por reacciones que implican la eterificación o la esterificación de grupos hidroxi.
- C07C215/54 C07C […] › C07C 215/00 Compuestos que contienen grupos amino e hidroxi unidos a la misma estructura carbonada. › unidos a través de cadenas carbonadas con al menos tres átomos de carbono entre los grupos amino y el ciclo aromático de seis miembros o el sistema cíclico condensado que contenga este ciclo.
- C07C219/28 C07C […] › C07C 219/00 Compuestos que contienen grupos amino e hidroxi esterificados unidos a la misma estructura carbonada. › con grupos amino unidos a átomos de carbono acíclicos de la estructura carbonada.
PDF original: ES-2436280_T3.pdf
Fragmento de la descripción:
Síntesis acortada usando paraformaldehído o trioxano
Campo técnico
Se describe en la presente memoria un procedimiento para preparar 2- (3-diisopropilamino-1-fenilpropil) -4 (hidroximetil) fenol que es conocido como el metabolito activo de tolterodina (denominado en lo sucesivo el "metabolito activo") y sus monoésteres fenólicos por una vía sintética acortada a través de una reacción de Grignard. Los compuestos objetivo tienen la siguiente fórmula (I) :
en donde R es hidrógeno, formilo, un grupo alquil (C1-C6) -carbonilo lineal, ramificado o cíclico, o un grupo fenilcarbonilo. Si R de la fórmula (I) es hidrógeno, la fórmula representa el metabolito activo.
Un ejemplo preferido particular de los monoésteres fenólicos de fórmula (I) es fesoterodina que puede definirse químicamente como 2- (3-diisopropilamino-1-fenilpropil) -4- (hidroximetil) fenol éster de ácido R- (+) -isobutírico. La fesoterodina se representa por la fórmula (Ia) dibujada a continuación.
Los compuestos de fórmula (I) , con inclusión del metabolito activo y sus monoésteres fenólicos de fórmula (I) , son conocidos a partir del documento WO 99/058478.
También se describe en la presente memoria un procedimiento para preparar sales de los compuestos de fórmula (I) , que incluye específicamente la preparación de sales de fesoterodina, y más particularmente la preparación de la sal de hidrogenofumarato de fesoterodina.
Se divulga además la preparación de formulaciones farmacéuticas que contienen compuestos de fórmula (I) , tales como fesoterodina, y la preparación de formulaciones farmacéuticas que contienen una sal farmacéuticamente aceptable de cualquiera de los compuestos de fórmula (I) , con inclusión de, por ejemplo, las sales de hidrogenofumarato o de hidrocloruro de fesoterodina.
Antecedentes En el hombre, en las contracciones normales de la vejiga urinaria interviene, en parte, la estimulación de receptores muscarínicos colinérgicos. Los receptores muscarínicos no sólo intervienen, en parte, en las contracciones normales de la vejiga, sino que también intervienen en la mayor parte de las contracciones de la vejiga hiperactiva, dando como resultado síntomas tales como la frecuencia urinaria, la urgencia y la incontinencia urinaria por urgencia.
Después de la administración de fesoterodina y otros monoésteres fenólicos de fórmula (I) a mamíferos, por ejemplo seres humanos, estos compuestos son escindidos por esterasas para formar el metabolito activo dentro del organismo. Se sabe que el metabolito activo es un potente y competitivo antagonista de receptores muscarínicos (documento WO 94/11337) . La fesoterodina y otros ésteres fenólicos de fórmula (I) representan así profármacos potenciales del metabolito activo. Se ha demostrado que la fesoterodina, en particular, es un fármaco eficaz para el tratamiento de la vejiga hiperactiva con síntomas de incontinencia urinaria por urgencia, urgencia y frecuencia urinaria, así como hiperactividad del detrusor (tal como se describe en los documentos US 6, 713, 464 y EP-B-1.077.912) .
En el documento US 6, 713, 464 se describe una estrategia sintética para la producción del metabolito activo y
monoésteres del grupo hidroxi fenólico del metabolito activo tales como fesoterodina de la manera siguiente: En una primera etapa, se prepara una disolución en éter a partir de R- (-) -[3- (2-benciloxi-5-bromofenil) -3-fenilpropil]diisopropilamina, bromuro de etilo y magnesio; se diluye con THF seco esta disolución y se enfría hasta -60°C.
En una segunda etapa, se añade en pequeñas porciones dióxido de carbono sólido pulverizado, y se calienta la mezcla de reacción hasta la temperatura ambiente. En una tercera etapa, se desactiva la reacción con una disolución acuosa de cloruro amónico. En una cuarta etapa, se ajusta a un pH de 0, 95 la fase acuosa de la mezcla de reacción desactivada. En una quinta etapa, se filtra la fase acuosa con pH ajustado, y del sólido se puede recuperar hidrocloruro de ácido 10 R- (-) -4-benciloxi-3- (3-diisopropilamino-1-fenilpropil) -benzoico.
En una sexta etapa, se esterifica el ácido benzoico purificado resultante para dar su correspondiente éster metílico. En una séptima etapa, se reduce el éster metílico de la sexta etapa mediante la adición de hidruro de litio y aluminio. Después de reaccionar durante 18 horas, se desactiva con agua la reacción y se seca sobre sulfato sódico la fase orgánica, se filtra y se evapora hasta sequedad para proporcionar el alcohol que gradualmente cristaliza desde un aceite. A continuación se muestra un diagrama que resume esta síntesis de varias etapas. Etapas 1 a 5:
Etapa 6: Etapa 7:
El documento US 6, 713, 464 describe además la conversión del éster metílico en el metabolito activo, y la esterificación posterior para proporcionar un monoéster fenólico, tal como fesoterodina.
El documento WO 94/11337 describe también un procedimiento en varias etapas para sintetizar el precursor del metabolito activo.
Estos métodos descritos con anterioridad para producir el metabolito activo requieren numerosas etapas, lo que da como resultado complicados procedimientos de purificación, retrasos, y una mayor posibilidad de error humano, impidiendo por tanto la consecución de una eficacia y rentabilidad óptimas. Además, el dióxido de carbono sólido utilizado en la técnica es difícil de manipular a gran escala debido a la necesidad de trabajar a muy bajas temperaturas y de añadir en porciones el hielo seco triturado, y a las dificultades para controlar la naturaleza sumamente exotérmica de la reacción. Además, la etapa de reducción con hidruro de litio y aluminio utilizado en la técnica anterior genera una cantidad significativa de residuos a gran escala, lo que resulta inconveniente tanto desde un punto de vista económico como ecológico.
La presente descripción pretende superar estos problemas e inconvenientes. Sorprendentemente, se ha hallado ahora que el empleo de paraformaldehído o trioxano en la reacción de Grignard mediante el empleo de un iniciador de Grignard en presencia de un exceso de Mg, es adecuado para obtener directamente un compuesto de fórmula (III) sin sintetizar previamente el éster correspondiente. El empleo de paraformaldehído o trioxano da como resultado una ruta sintética acortada hacia fesoterodina a través de un compuesto de fórmula (III) al eliminar la producción de 20 los intermedios de ácido benzoico y éster metílico, y proporciona un rendimiento global incrementado.
En consecuencia, el empleo de paraformaldehído o trioxano en la reacción de Grignard iniciada mediante el empleo de un iniciador de Grignard en presencia de un exceso de Mg permite una estrategia sintética directa y más rentable para obtener compuestos de fórmula (I) a través de un compuesto de fórmula (III) , eliminando así subproductos indeseados, tales como los derivados de ácido benzoico, que a menudo se forman cuando se utiliza una estrategia que discurre a través del éster correspondiente seguida de una etapa de reducción.
Sumario En la presente memoria se describe un procedimiento acortado para preparar compuestos de fórmula (I) :
en donde R es hidrógeno, un grupo formilo, un grupo alquil (C1-C6) -carbonilo lineal, ramificado o cíclico o un grupo fenilcarbonilo, con inclusión del metabolito activo y sus monoésteres fenólicos, tales como fesoterodina y sus sales, y más particularmente la sal de hidrogenofumarato de fesoterodina.
La síntesis acortada de compuestos de fórmula (I) se puede caracterizar por las etapas siguientes:
a) hacer reaccionar un compuesto de fórmula (II)
con un iniciador de Grignard y Mg, preferiblemente en un disolvente, para formar un reactivo de Grignard,
b) opcionalmente, reducir la temperatura del reactivo de Grignard a una temperatura inferior a la de la etapa a) , y
c) hacer reaccionar el reactivo de Grignard con paraformaldehído o trioxano para obtener un compuesto de fórmula (III)
y después hacer reaccionar ulteriormente el compuesto de fórmula (III) de una manera conocida para obtener un compuesto de fórmula (I) y opcionalmente formar una sal.
También se describe en la presente memoria un procedimiento acortado para preparar compuestos de fórmula (I) :
en donde R es hidrógeno, formilo, un grupo alquil (C1-C6) -carbonilo lineal, ramificado o cíclico, o un grupo fenilcarbonilo, con inclusión del metabolito activo y sus monoésteres fenólicos, tales como fesoterodina y sus sales, y más particularmente las sales de hidrogenofumarato y de hidrocloruro de fesoterodina, en donde dicho procedimiento acortado para preparar compuestos de fórmula (I)... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para preparar un compuesto de fórmula (I)
en donde R es hidrógeno, un grupo formilo, un grupo alquil (C1-C6) -carbonilo lineal, ramificado o cíclico, o un grupo fenilcarbonilo, o una sal del mismo, caracterizado por las etapas de a) hacer reaccionar un compuesto de fórmula (II)
con una mezcla de Mg y un iniciador de Grignard de la fórmula R1MgX ó R1MgX/LiCl, en donde R1 representa alquilo C1-C12, alquenilo C2-C6, alquinilo C2-C6, fenilo o fenil-alquilo (C1-C6) sustituido o sin sustituir, en donde dicho fenilo está opcionalmente sustituido, preferiblemente con alquilo (C1-C6) , alcoxi (C1-C6) ó CF3, y en donde X se selecciona de bromuro, cloruro y yoduro, en un disolvente para formar un reactivo de Grignard, b) opcionalmente reducir la temperatura del reactivo de Grignard a una temperatura por debajo de la temperatura de la etapa a) y
c) hacer reaccionar el reactivo de Grignard con paraformaldehído o trioxano para obtener un compuesto de fórmula (III)
y después hacer reaccionar ulteriormente el compuesto de fórmula (III) de una manera conocida para obtener un compuesto de fórmula (I) y opcionalmente formar una sal.
2. El procedimiento según la reivindicación 1, en donde el compuesto de fórmula (I) es fesoterodina que tiene la fórmula (Ia)
o una sal de la misma.
3. El procedimiento según la reivindicación 2 en donde la sal de fesoterodina es el hidrogenofumarato.
4. El procedimiento según una cualquiera de las reivindicaciones precedentes, en donde el iniciador de Grignard se selecciona de un grupo de compuestos de fórmula general R1MgX ó R1MgX/LiCl, en donde R1 se selecciona de alquilo C1-C6, vinilo, alilo, propenilo, etinilo, fenilo y bencilo, y es preferiblemente alquilo C1-C4, y en donde X se selecciona de bromuro, cloruro y yoduro.
5. El procedimiento según una cualquiera de las reivindicaciones precedentes, en donde el iniciador de Grignard se selecciona del grupo consistente en MeMgCl, MeMgCl/LiCl, t-BuMgCl/LiCl e iPrMgCl/LiCl.
6. El procedimiento según una cualquiera de las reivindicaciones precedentes, en donde el iniciador de Grignard es MeMgCl.
7. El procedimiento según una cualquiera de las reivindicaciones precedentes, caracterizado porque en la etapa c) se emplea paraformaldehído en un exceso molar de 1, 1 veces a 50 veces en comparación con el compuesto de fórmula (II) .
8. El procedimiento según una cualquiera de las reivindicaciones precedentes, caracterizado porque en la etapa c) se emplea un disolvente, preferiblemente THF.
9. El procedimiento según una cualquiera de las reivindicaciones precedentes, en donde la etapa c) de reacción es seguido de la desactivación de la mezcla con un reactivo adecuado.
10. El procedimiento según la reivindicación 9 en donde el reactivo es NH4Cl acuoso.
11. El procedimiento según una cualquiera de las reivindicaciones precedentes, caracterizado porque en la etapa c) se hace reaccionar paraformaldehído con el reactivo de Grignard para obtener un compuesto de fórmula (III) .
12. El procedimiento según una cualquiera de las reivindicaciones precedentes, en donde la proporción molar de dicho iniciador de Grignard con respecto a Mg se sitúa entre 1:2 y 2:1, y la proporción molar de dicho iniciador de Grignard con respecto al compuesto de fórmula (II) se sitúa entre 1:1 y 2:1.
13. El procedimiento según una cualquiera de las reivindicaciones precedentes, en donde la proporción molar de un MeMgCl con respecto a Mg se sitúa entre 1:2 y 2:1, y la proporción molar de un MeMgCl con respecto al compuesto de fórmula (II) se sitúa entre 1:1 y 2:1.
14. El procedimiento según una cualquiera de las reivindicaciones precedentes, caracterizado porque la etapa a) se lleva a cabo a1) disolviendo el compuesto de fórmula (II) en un disolvente adecuado para formar una disolución, y a2) añadiendo dicha disolución a dicho iniciador de Grignard y Mg en un disolvente adecuado.
15. El procedimiento según la reivindicación 14, en donde el disolvente de la etapa a1) utilizado para disolver el compuesto de fórmula (II) es tolueno y el disolvente de la etapa a2) es THF.
16. El procedimiento según una cualquiera de las reivindicaciones 13 a 15, en donde
- en la etapa a1) se disuelve en tolueno el compuesto de fórmula (II) ,
- en la etapa a2) se añade dicha disolución a MeMgCl y Mg en THF y se agita hasta que se completa la reacción,
- en la etapa b) se mantiene con agitación la mezcla tal como se ha obtenido en la etapa a2) ,
- en la etapa c) se añade la mezcla a paraformaldehído en THF, seguido de la adición de un reactivo desactivante adecuado, preferiblemente NH4Cl acuoso.
17. El procedimiento según una cualquiera de las reivindicaciones precedentes, caracterizado porque la temperatura de reacción de la etapa a) se sitúa entre 40 y 50°C.
18. El procedimiento según una cualquiera de las reivindicaciones precedentes, en donde la temperatura de reacción de la etapa b) se reduce a una temperatura entre 20 y 25°C.
19. El procedimiento según una cualquiera de las reivindicaciones precedentes, caracterizado porque la temperatura de reacción de la etapa c) se sitúa por debajo de 10 °C.
20. El procedimiento según una cualquiera de las reivindicaciones precedentes, caracterizado porque la etapa c) es seguido por una etapa de desbencilación para obtener un compuesto de fórmula (Ib)
21. El procedimiento según la reivindicación 20, caracterizado porque la etapa de desbencilación se lleva a cabo con Pd/C, H2 en un disolvente adecuado.
22. El procedimiento según la reivindicación 21, caracterizado porque el disolvente es metanol.
23. Un procedimiento para preparar una composición farmacéutica que contiene hidrogenofumarato de fesoterodina, que comprende las etapas de (i) preparar hidrogenofumarato de fesoterodina mediante un procedimiento según cualquiera de las reivindicaciones precedentes, y
(ii) formular el hidrogenofumarato de fesoterodina así obtenido de una manera conocida para obtener una composición farmacéutica.
Patentes similares o relacionadas:
Fosfato de tapentadol cristalino, del 13 de Noviembre de 2019, de RATIOPHARM GMBH: Fosfato de tapentadol cristalino
Modificaciones cristalinas del (1R,2R)-3-(3-dimetilamino-1-etil-2-metilpropil)fenol, del 6 de Noviembre de 2019, de GRUNENTHAL GMBH: Un medicamento para uso oral, que contiene una modificación cristalina A del (1R,2R)-3-(3- dimetilamino-1-etil-2-metilpropil)fenol que comprende una reflexión […]
Proceso para la preparación de (1R,2R)-3-(3-dimetilamino-1-etil-2-metilpropil)fenol, del 22 de Marzo de 2017, de GRUNENTHAL GMBH: Procedimiento para preparar (1R,2R)-3-(3-dimetilamino-1-etil-2-metilpropil)- fenol de fórmula (IV)**Fórmula** o una sal de adición de […]
Modificaciones cristalinas de (1R,2R)-3-(3-dimetilamino-1-etil-2-metilpropil)fenol, del 25 de Enero de 2017, de GRUNENTHAL GMBH: Modificación cristalina A de (1R,2R)-3-(3-dimetilamino-1-etil-2-metilpropil)enol que incluye un pico de difracción de rayos X a 15,58 +- 0,20 (2Θ ), adicionalmente […]
Procedimiento para la obtención de 3,3-difenilpropilaminas, del 27 de Julio de 2016, de INTERQUIM, S.A.: El procedimiento para la obtención de 3,3-difenilpropilaminas (I), donde R1 es H, alquilo, haloalquilo o alcoxialquilo, R2 es alquilo, alcoxi, halógeno, NO2, CN, CHO libre o […]
Sales de desfesoterodina, del 23 de Marzo de 2016, de RATIOPHARM GMBH: Una sal succinato de desfesoterodina.
 Nuevo proceso para la síntesis de tapentadol y productos intermedios del mismo, del 24 de Febrero de 2016, de Euticals S.P.A: Proceso para la síntesis de tapentadol que comprende la alquilación de la cetona (VII) con un haluro de etil-metal en un disolvente orgánico**Fórmula**
para […]
Nuevo proceso para la síntesis de tapentadol y productos intermedios del mismo, del 24 de Febrero de 2016, de Euticals S.P.A: Proceso para la síntesis de tapentadol que comprende la alquilación de la cetona (VII) con un haluro de etil-metal en un disolvente orgánico**Fórmula**
para […]
Desfesoterodina en forma de una sal de ácido tartárico, del 11 de Febrero de 2015, de RATIOPHARM GMBH: (R)-2-(3-Diisopropilamino-1-fenilpropil)-4-hidroximetilfenol (desfesoterodina) en forma de una sal de ácido tartárico, en el que la proporción molar de desfesoterodina con respecto […]