Receptor de células T de alta afinidad y uso del mismo.
Una molécula de ácido nucleico que codifica las regiones V(D)J de un TCR que reconoce la tirosinasay comprende la secuencia de ácido nucleico SEC ID N.
º 1 que codifica la cadena α y/o la secuencia de ácidonucleico SEC ID N.º 2 que codifica la cadena ß de dicho TCR, o
un derivado del mismo que codifica las cadenas α o ß, donde la cadena se ha alterado mediante una o másadiciones o deleciones de 1 - 15 aminoácidos, estando las adiciones o deleciones fuera de la región CDR3 de cadacadena y/o mediante sustituciones conservadoras de 1 - 15 aminoácidos, en la que las características dereconocimiento de la tirosinasa se mantienen o mejoran,
o
un fragmento de la misma que codifica una región CDR3 de un TCR que reconoce la tirosinasa y que tiene lasecuencia de ácidos nucleicos de las SEC ID N.º 3 o 4 o que codifica las secuencias de aminoácidos de las SEC IDN.º 5 o 6,
o
un derivado de dicho fragmento, en el que se ha alterado la región CDR3 mediante una o más adiciones y/odeleciones de un número total de hasta 1 - 5 aminoácidos, pero no más de 1 - 3 aminoácidos contiguos, y/osustituciones conservadores de hasta 1 - 6 aminoácidos y en la que las características de reconocimiento de latirosinasa se mantienen o mejoran.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2009/065705.
Solicitante: HELMHOLTZ ZENTRUM MUNCHEN DEUTSCHES FORSCHUNGSZENTRUM FUR GESUNDHEIT UND UMWELT (GMBH).
Nacionalidad solicitante: Alemania.
Dirección: INGOLSTÄDTER LANDSTRASSE 1 85764 NEUHERBERG ALEMANIA.
Inventor/es: SCHENDEL, DOLORES, WILDE,SUSANNE, FRANKENBERGER,BERNHARD, UCKERT,WOLFGANG.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K14/725 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › receptores de células T.
PDF original: ES-2394180_T3.pdf
Fragmento de la descripción:
Receptor de células T de alta afinidad y uso del mismo [0001] La presente invención va dirigida a un receptor de células T (TCR) de alta afinidad frente a un antígeno asociado a tumores, una molécula de ácido nucleico aislada que lo codifica, una célula T que expresa dicho TCR y una composición farmacéutica para su uso en el tratamiento de enfermedades que implican presencia de células neoplásicas que expresan dicho antígeno asociado a tumores.
ANTECEDENTES DE LA INVENCIÓN
Los TCR son miembros de la superfamilia de las inmunoglobulinas y, normalmente, constan de dos subunidades, denominadas subunidades a y º. Estas poseen un dominio variable (V) de inmunoglobulina (Ig) Nterminal, un dominio constante (C) de Ig, una región transmembrana/que abarca la membrana celular y un tallo citoplásmico corto en el extremo C terminal. Los dominios variables de ambas cadenas a y º del TCR tienen tres regiones determinantes de complementariedad (CDR) o hipervariables, mientras que la región variable de la cadena º tiene un área adicional de hipervariabilidad (HV4) que normalmente no entra en contacto con el antígeno y, por tanto, no se considera una CDR.
CDR3 es la principal CDR responsable del reconocimiento del antígeno procesado, aunque también se ha demostrado que la CDR1 de la cadena alfa interacciona con la parte N-terminal del péptido antigénico, mientras que la CDR1 de la cadena º interacciona con la parte C-terminal del péptido. Se considera que CDR2 reconoce el MHC. La CDR4 de la cadena º no parece participar en el reconocimiento del antígeno aunque se ha demostrado que interacciona con superantígenos. El dominio constante del dominio TCR consta de dos secuencias de conexión cortas en las que un resto de cisteína forma enlaces disulfuro, que forma un enlace entre las dos cadenas.
La afinidad de los TCR por un antígeno específico los hace valiosos para diversas estrategias terapéuticas. Por ejemplo, los pacientes de cáncer, como aquellos que sufren melanoma, puede ser tratados de forma eficaz usando inmunoterapia adoptiva.
La transferencia adoptiva de linfocitos en el entorno del trasplante de células madre (TCM) alogénico ha permitido demostrar la potencia del sistema inmune para erradicar las neoplasias malignas hematológicas (Kolb y col. 1995) . Parece que el TCM también funciona en la eliminación de los tumores sólidos, como los carcinomas de células renales (CCR) en algunos casos (revisado en Kolb y col. 2004 y Dudley y Rosenberg, 2003) . En los receptores de TCM, la eliminación de células malignas solo puede producirse después de varios meses y hasta un año, debido al hecho de que las células T específicas deben activarse in vivo y expandirse a continuación para adecuar los valores siguiendo el desarrollo del nuevo sistema hematopoyético en el receptor del trasplante. Alternativamente, tras un periodo de tiempo (aproximadamente 60 días) durante el cual se establece la tolerancia en el receptor del TCM, puede realizarse una transferencia de linfocitos sin cebar y sin aislar para acelerar la generación de las respuestas inmunitarias dirigidas contra las células tumorales. Una vez más, los linfocitos específicos capaces de atacar a las células tumorales deben activarse y expandirse a partir de los linfocitos precursores de baja frecuencia presentes entre la población no seleccionada de linfocitos que se transfieren. Las perfusiones de linfocitos donantes (PLD) de poblaciones de linfocitos no seleccionados tras el TCM funcionan bien en la eliminación de la leucemia mielogénica crónica (LMC) que crece lentamente, pero es menos eficaz en la erradicación de la leucemia aguda debido en parte al hecho de que el crecimiento de las células malignas supera la capacidad de expansión de las células inmunitarias. Esta misma expansión diferencial en la que las células inmunitarias se expanden más lentamente que las células tumorales, también afecta a la mala eliminación inmunitaria de los tumores sólidos de progresión rápida. Una segunda dificultad en el uso de poblaciones mixtas de linfocitos no seleccionados en la PDL es que también pueden transferirse células T que tienen la capacidad de atacar a células y tejidos normales del receptor, lo que induce la enfermedad injerto contra huésped (GVHD) , enfermedad con alta morbimortalidad.
Estudios recientes han demostrado que la transferencia adoptiva de células T seleccionadas con especificidades peptídicas definidas puede llevar a reducciones importantes de la carga del tumor en un entorno autólogo, especialmente si los pacientes han sido tratados previamente con regimenes no mieloablativos (Dudley y col. 2002, 2003) . Esto elimina la necesidad de realizar TCM en el paciente afectado por el tumor y también evita, por tanto, el problema de la GVHD.
Para extender la capacidad de utilizar la terapia celular adoptiva (TCA) para tratar a pacientes con tumores que crecen más rápidamente, el objetivo es transferir células T efectoras específicas de péptido enriquecidas (tanto células T auxiliares CD4 como linfocitos T citotóxicos) que se han seleccionado por sus especificidades por el ligando para atacar de forma eficaz a las células tumorales a la vez que se evita un ataque grave de los tejidos normales. Estas células se expanden rápidamente hasta obtener grandes cantidades ex vivo y, a continuación, se usan para TCA. Alternativamente, los receptores de células T (TCR) de estas células T específicos de ligando pueden clonarse y expresarse como transgenes de TCR en linfocitos activados, usando linfocitos de sangre periférica receptores o clones de células T activados con especificidades definidas que crecen bien y no tienen la capacidad de atacar a los tejidos normales del huésped.
Como ejemplo, un clon de células T aloespecífico expandido que es específico para una molécula de MHC no expresada por el receptor o un clon de células T expandido específico de un virus, como citomegalovirus o virus del Epstein-Barr, podrían usarse como células receptoras para el TCR transgénico. La disponibilidad de un panel de vectores transgénicos de TCR, que reconocen diferentes ligandos de MHC-péptido diferentes podrían usarse para desarrollar una cantidad grande de células T preactivadas de subtipos CD4 y CD8, permitiendo de este modo grandes cantidades de linfocitos efectores que se preparan rápidamente y se transfieren a pacientes cuyos tumores expresan los ligandos de TCR correspondientes. Esto podría ahorrar tiempo a la hora de conseguir las cantidades de células T específicas necesarias para controlar el crecimiento del tumor, lo que posiblemente llevaría a una erradicación del tumor más eficaz en tumores que progresan rápidamente.
Debido a que los determinantes que reconocen células T específicas de leucemia y de linfomas, así como células de tumores sólidos, a menudo representan péptidos propios derivados de proteínas sobreexpresadas presentadas por moléculas propias de MHC, la afinidad de sus receptores de células T (TCR) es bajo, ya que las células T portadoras de receptores de alta afinidad se han eliminado mediante el proceso de selección negativa que se aplica a los linfocitos durante su desarrollo en el timo para prevenir la autoinmunidad. Se produce un reconocimiento de más eficaz de las células tumorales si las células T se generan a partir de linfocitos que no se han seleccionado negativamente contra moléculas propias de MHC durante su desarrollo en el timo.
El documento WO 2006/031221 se refiere a receptores de células T frente a antígenos asociados a tumores, ácidos nucleicos que los codifican, vectores y células que contienen los ácidos nucleicos que codifican los receptores de células T y procedimientos para su uso. Entre otros, se describe que las subunidades de TCR tienen la capacidad de formar un TCR que confiera especificidad a células T por las células tumorales que presenten MART-I, NY-ESO-I y gp100 relacionada con melanoma.
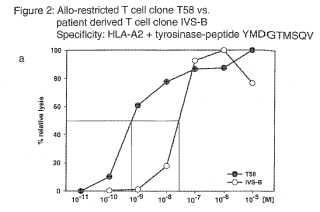
En la técnica previa, existen varios documentos científicos y patentes en las que se describen TCR capaces de reconocer y unirse a la tirosinasa. Visseren y col. (Int. J. Cancer (1997) 72, 1122 – 1128) describen la afinidad y especificidad de diversos TCR específicos de tirosinasa y sugieren el uso de estos TCR como tratamiento específico de los pacientes con melanoma.
Roszkowski y col. (J. Immunol. (2003) 170, 2582 – 2589 y Cancer Res. (2005) 65, 1570 – 1576) de forma similar caracterizan TCR específicos de tirosinasas.
El documento US 5.906.936 está dirigido a células T citotóxicas que matan a células diana no restringida por MHC y no a otras células, que comprenden secuencias de TCR específicas.
El documento WO97/32603 está dirigido a un procedimiento para producir... [Seguir leyendo]
Reivindicaciones:
1. Una molécula de ácido nucleico que codifica las regiones V (D) J de un TCR que reconoce la tirosinasa y comprende la secuencia de ácido nucleico SEC ID N.º 1 que codifica la cadena a y/o la secuencia de ácido nucleico SEC ID N.º 2 que codifica la cadena º de dicho TCR, o un derivado del mismo que codifica las cadenas a o º, donde la cadena se ha alterado mediante una o más adiciones o deleciones de 1 – 15 aminoácidos, estando las adiciones o deleciones fuera de la región CDR3 de cada cadena y/o mediante sustituciones conservadoras de 1 – 15 aminoácidos, en la que las características de reconocimiento de la tirosinasa se mantienen o mejoran, o un fragmento de la misma que codifica una región CDR3 de un TCR que reconoce la tirosinasa y que tiene la secuencia de ácidos nucleicos de las SEC ID N.º 3 o 4 o que codifica las secuencias de aminoácidos de las SEC ID N.º 5 o 6, o un derivado de dicho fragmento, en el que se ha alterado la región CDR3 mediante una o más adiciones y/o deleciones de un número total de hasta 1 – 5 aminoácidos, pero no más de 1 – 3 aminoácidos contiguos, y/o sustituciones conservadores de hasta 1 – 6 aminoácidos y en la que las características de reconocimiento de la tirosinasa se mantienen o mejoran.
2. La molécula de ácido nucleico aislada de la reivindicación 1, en la que la secuencia que codifica las cadenas a o derivan de SEC ID N.º 1 y 2 mediante optimización de codones y comprende la secuencia de ácido nucleico de SEC ID N.º 7 que codifica la cadena a y/o comprende la secuencia de ácido nucleico SEC ID N.º 8 que codifica la cadena º de dicho TCR.
3. Un TCR, preferiblemente un TCR soluble, que comprende regiones V (D) J que codifican un ácido nucleico de una o más de las reivindicaciones 1 – 2 o comprende las secuencias de aminoácidos de las SEC ID N.º 5 y/o 6.
4. Una proteína de fusión de las cadenas a y/o º de TCR funcional que comprende:
a) al menos una etiqueta epítope, y b) la secuencia de aminoácidos de una cadena a y/o º de un TCR según una o más de la reivindicaciones 1 – 3,
en la que dicha etiqueta epítope se selecciona entre
i) una etiqueta epítope añadida a los extremos N y/o C terminales de dichas cadenas a y/o º, o se añade a la secuencia de las cadenas a y/o º, pero fuera de la región CDR3, ii) una etiqueta epítope insertada en una región constante de dichas cadenas a y/o º, y iii) una etiqueta epítope que sustituye a diversos aminoácidos de la región constante de dichas cadenas a y/o .
5. Una célula T que expresa un TCR de las reivindicaciones 3 o 4, o un TCR que comprende una de las regiones CDR3 de la reivindicación 1.
6. Una molécula de inmunoglobulina, anticalina, cadena v/a del TCR que tiene una región CDR3 de la reivindicación 1 insertada.
7. Un vector, preferiblemente un plásmido, vector lanzadera, fagémido, cósmido, vector de expresión, vector retroviral, vector adenoviral o partícula y/o vector para su uso en terapia génica, que comprende uno o más de los ácidos nucleicos de las reivindicaciones 1 – 2 o un ácido nucleico que codifica un TCR según las reivindicaciones 3 o 4.
8. Una célula, preferiblemente un PBL, que se ha transformado con el vector de la reivindicación 7.
9. Una composición farmacéutica que comprende un TCR de la reivindicación 3 o 4, una célula T de la reivindicación 5, una molécula de inmunoglobulina, anticalina, cadena v/a del TCR de la reivindicación 6 o la célula de la reivindicación 8 y un vehículo farmacéuticamente aceptable, preferiblemente una perfusión o inyección.
La composición farmacéutica según la reivindicación 9 para su uso en el tratamiento de una enfermedad en pacientes mediante terapia celular adoptiva.
11. La composición farmacéutica de la reivindicación 10, en la que los pacientes son preferiblemente pacientes positivos para HLA-A2 y la enfermedad implica la aparición de células neoplásicas que expresan tirosinasa, preferiblemente melanomas, gliomas, glioblastomas y/o tumores raros de origen ectodérmico.
Patentes similares o relacionadas:
Redirectores de células T específicas de antígenos, del 1 de Julio de 2020, de THE JOHNS HOPKINS UNIVERSITY: Una nanoparticula que comprende en su superficie: (A) un anticuerpo que se une especificamente a un antigeno de celula diana o epitopo del mismo; y (B) un resto […]
Fijación eficaz como objetivo de la leucemia humana primaria utilizando células T modificadas con receptor de antígeno quimérico anti-CD123, del 3 de Junio de 2020, de NOVARTIS AG: Una molécula de ácido nucleico aislada que codifica un receptor de antígeno quimérico (CAR), en donde dicho CAR comprende un dominio de unión anti-CD123 humanizado, […]
Célula, del 6 de Mayo de 2020, de UCL Business Ltd: Células que comprende un receptor de antígeno quimérico (RAQ) y una proteína truncada que comprende un dominio SH2 de una proteína que se […]
Receptores de antígenos quiméricos (CAR) dirigidos de forma selectiva a complejos proteicos, del 15 de Abril de 2020, de BOARD OF REGENTS THE UNIVERSITY OF TEXAS SYSTEM: Un polipéptido del receptor de antígeno quimérico (CAR) que comprende un dominio de unión a antígeno; un dominio de bisagra; un dominio o dominios transmembrana […]
Moléculas de unión de alta avidez que reconocen MAGE-A1, del 8 de Abril de 2020, de Max Delbrück Centrum für Molekulare Medizin (MDC) Berlin-Buch: Una construcción de reconocimiento de antígenos que es un receptor de células T (TCR), que comprende (i) una región variable de la cadena alfa […]
Tratamiento del cáncer utilizando un receptor antigénico quimérico de CD33, del 8 de Abril de 2020, de NOVARTIS AG: Una molécula de ácido nucleico aislada que codifica un receptor antigénico quimérico (CAR) que se une específicamente a CD33, donde el CAR comprende un dominio de unión a […]
Receptores de linfocitos T, del 11 de Marzo de 2020, de Adaptimmune Limited: Un receptor de linfocitos T (TCR) que tiene la propiedad de unirse a GVYDGEEHSV (SEQ ID NO: 1) en complejo con HLA-A*0201 y GVYDGREHTV (SEQ ID NO: […]
Método de producción de citoblastos pluripotentes que tienen un gen receptor de linfocitos T específico de antígenos, del 11 de Marzo de 2020, de Kawamoto, Hiroshi: Un método in vitro de inducir linfocitos T para una inmunoterapia basada en células, que comprende las etapas de: proporcionar citoblastos pluripotentes […]