Producción de metabolitos secundarios empleando membranas capilares.
Un procedimiento de producción de metabolitos secundarios en condiciones de oxígeno limitado o de cultivo anaerobio,
cuyo procedimiento incluye:
proporcionar un sustrato poroso que tenga un primer lado y un segundo lado y que tenga una biopelícula de microorganismos unida al primer lado del mismo, estando configurado el sustrato para permitir el paso de metabolitos secundarios a su través y para evitar el paso de las células de los microorganismos a su través, y
hacer que una solución nutriente fluya a través de la biopelícula y el sustrato en una dirección desde el primer lado del mismo al segundo lado del mismo en condiciones de oxígeno limitado o de cultivo anaerobio, a una velocidad que sea lo suficientemente baja para que se establezca un gradiente de nutriente a través de la biopelícula en el que la concentración de nutriente sea relativamente elevada respecto de la del sustrato y suficientemente elevada para sostener el crecimiento primario de los microorganismos y en el que la concentración de nutriente sea relativamente baja próxima a la del sustrato, y lo suficientemente baja para inducir y sostener una fase estacionaria de los microorganismos y dar lugar por tanto a que los microorganismos produzcan al menos un metabolito secundario, transportando el flujo de la solución nutriente a través del sustrato dicho metabolito secundario a través del sustrato hasta el segundo lado del mismo en el que se puede recoger el metabolito secundario secretado, reteniéndose las células de los microorganismos procedentes de la biopelícula en el primer lado del mismo.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2006/052201.
Solicitante: Quorus Biotech (Proprietary) Limited.
Inventor/es: LEUKES,WINSTON DANIEL, FRASER,SHEENA JANET, EDWARDS,WADE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N15/09 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Tecnología del ADN recombinante.
PDF original: ES-2396654_T3.pdf
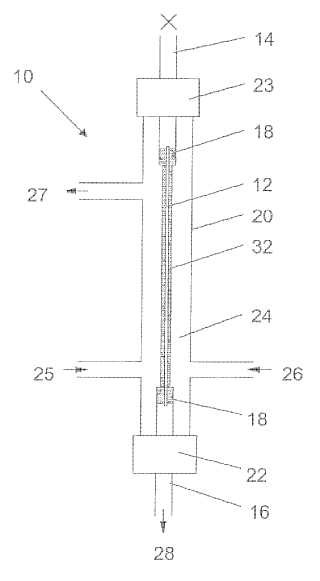
Fragmento de la descripción:
Producción de metabolitos secundarios empleando membranas capilares
Campo de la memoria Esta invención se refiere a la producción de metabolitos secundarios o productos recombinantes. En concreto, se refiere a procedimientos para producir metabolitos secundarios y/o productos recombinantes en condiciones de oxígeno limitado o condiciones anaerobias.
Antecedente de la memoria Se han descrito ampliamente los desafíos asociados con los cultivos celulares de alta densidad; en dónde el interés principal se ha puesto de forma típica en mejorar las propiedades de transferencia de material de los biorreactores mediante la integración de módulos de fibra hueca en los procesos de fermentación típicos o atípicos como una forma de concentrar las células mientras se vuelve a cargar con nutrientes y/u oxígeno el reactor de cultivo, de forma que se puedan conseguir y suspender mayores densidades celulares. A modo de ejemplo, Cracauer y col. (US4804628) describen un biorreactor de fibra hueca en el que los nutrientes se suministran desde luces capilares a las células suspendidas en el espacio extracapilar (ECS) . A su vez, el ECS está conectado a una cámara de expansión con un sistema para presurizar un gas (aire u oxígeno) , de forma que la suspensión de células se hace circular varias veces, de forma alternativa y selectiva, entre el biorreactor y la cámara de expansión, garantizando de esta forma que las células se mantienen como una suspensión homogénea, se eliminan los gradientes de nutrientes, y se recupera el oxígeno. Por el contrario, Inloes y col. (1983) describen las primeras etapas del desarrollo de un sistema biorreactor de fibra hueca como un biorreactor autocontenido, en el que células de Escherichia coli con crecimiento activo se encuentran atrapadas en el interior de la matriz de membrana microporosa, recuperándose los nutrientes por difusión desde la luz de la membrana, y con suministro de aire u oxígeno humidificado y esterilizado en la superficie capilar. Sin embargo, este sistema no consigue el confinamiento de los microorganismos inmovilizados a densidades celulares elevadas y la recogida eficaz de un producto del sistema exento de células.
Metabolitos secundarios La mayor parte de tecnologías usadas para la producción de productos naturales se han desarrollado para mejorar la transferencia de materia del oxígeno en fermentaciones aerobias. Se han aprovechado pocas fermentaciones anaerobias en su capacidad de producir metabolitos secundarios. Las fermentaciones anaerobias se han desarrollado principalmente para el tratamiento de aguas residuales y procesos biológicos tales como la producción de ácidos orgánicos o de etanol.
Los metabolitos secundarios se producen por diferenciación en cultivo en medio sólido y/o la fase estacionaria de un cultivo en medio líquido. Se producen de forma típica en un cultivo en medio líquido sumergido por lotes o en modo de lote alimentado. Los casos que se llevan a cabo de forma de cultivo en lote son:
1. Se introduce un inóculo en el biorreactor preparado. De forma típica, se produce una fase de latencia mientras el organismo o cultivo se adapta a su entorno.
2. Una vez que los organismos comienzan a crecer, de forma típica por bipartición, sigue una fase exponencial, en la que la concentración de la biomasa del cultivo aumenta rápidamente mientras se consumen los nutrientes. Se acumulan los metabolitos primarios y los productos residuales metabólicos.
3. Eventualmente, los nutrientes del cultivo se agotan y los productos residuales se acumulan de forma que el cultivo deja de aumentar su concentración de biomasa. Esta fase sin crecimiento se denomina fase estacionaria. Es en este periodo cuando se producen los metabolitos secundarios. El cultivo en lote alimentado implica la adición de nutrientes a bajo nivel y/o la dilución de productos residuales para extender la fase estacionaria.
Entre los factores que afectan la productividad volumétrica de los biorreactores en lo que respecta a la producción de metabolitos secundarios se incluyen: entorno de baja cizalladura, elevada concentración de biomasa, diferenciación del cultivo, la presencia de un sustrato sólido para inmovilizar la biomasa, una fase de producción ampliada y una buena transferencia de materia de los nutrientes. Aunque se han desarrollado sistemas para la producción mejorada de concentración de biomasa en condiciones de cultivo aerobio, la producción eficaz de concentración de biomasa en condiciones anaerobias se ha ignorado en gran medida.
La concentración de biomasa de microorganismos anaerobios tiene una importancia fundamental en las ciencias de la vida. Como los microorganismos anaerobios habitan de forma típica nichos ecológicos poco usuales, representan una fuente interesante de metabolitos con tolerancias ambientales poco usuales y metabolitos nuevos para cribado de fármacos. Además, numerosos organismos patógenos proliferan en condiciones anaerobias y los metabolitos que producen son indicadores valiosos de los mecanismos de señalización celular, factores de patogenicidad, marcadores de identificación o indicadores de dianas de fármacos potenciales. De esta forma, un procedimiento eficaz para producir metabolitos secundarios, concretamente uno que permita la formación de biopelícula y diferenciación del cultivo, tiene un valor considerable en la industria de las ciencias de la vida.
Si se produce un desarrollo significativo en las estrategias de optimización de medios para el cultivo de microorganismos en condiciones limitantes de oxígeno, es posible conseguir una elevada densidad celular. Los organismos anteriormente examinados en condiciones aerobias se pueden cribar ahora respecto de la producción de productos naturales que se pueden inducir en condiciones limitantes de oxígeno, tales como la enzima inhibidora de tumores L-asparaginasa producida por Serratia marcescens (Heinemann, 1970) o la producción mejorada de surfactina en Bacillus subtillus (Davies y col. 1999)
Productos recombinantes Algunos productos industrialmente importantes se producen mediante microorganismos, productos tanto naturales como recombinantes. El mercado de productos recombinantes tanto para la industria farmacéutica como para otras industrias ha aumentado en los últimos años. Los productos recombinantes, incluyendo pero sin limitación, enzimas, hormonas, anticuerpos, fragmentos de anticuerpos, partículas análogas a virus, péptidos, fragmentos de ADN y ARN, se producen mediante una variedad de sistemas de expresión microbianos. Los productos también pueden incluir sustancias químicas producidas por los productos de expresión de enzimas recombinantes sintéticas.
Se han diseñado mediante ingeniería genética una variedad de hospedadores de expresión para optimizar la producción, solubilidad y excreción de los productos recombinantes. Los hospedadores de expresión incluyen una gama de especies de bacterias, hongos, células vegetales, células de insecto, protozoos y células de mamífero. La mayor parte de sistemas de expresión son aerobios, lo que requiere un aporte considerable de energía para mantener una elevada transferencia de materia de oxígeno en los biorreactores de cultivo sumergido. La mayor parte de la tecnología de bioprocesos se centra en obtener concentraciones realmente muy elevadas de células en el biorreactor, de forma típica en el modo de cultivo de lote alimentado. La elevada concentración inicial del sustrato y la fluidez del cultivo son los obstáculos principales para obtener un crecimiento con alta densidad celular. De forma rutinaria, una vez aparece la suficiente biomasa, se induce al hospedador de producción a expresar el producto recombinante de interés. Esta inducción es de forma típica una molécula que se añade en el momento adecuado, o es un metabolito producido por el hospedador de producción como producto residual, un metabolito primario o secundario. La estrategia de producir proteínas recombinantes una vez el cultivo ha alcanzado la fase estacionaria es muy habitual porque:
1) Permite la producción de productos que son tóxicos para el organismo productor.
2) La productividad volumétrica mejora si la concentración de biomasa en el reactor es muy elevada.
3) Los precursores de la producción del producto son de forma típica metabolitos primarios, que se acumulan
durante la fase primaria del crecimiento.
Frecuentemente es difícil temporalizar la adición de los inductores de la proteína recombinante de una forma óptima para que los inductores se añadan cuando el cultivo alcance la fase estacionaria, y no demasiado pronto ni demasiado tarde. Esto es especialmente difícil cuando se llevan a cabo diferentes cultivos en paralelo en condiciones diferentes... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento de producción de metabolitos secundarios en condiciones de oxígeno limitado o de cultivo
anaerobio, cuyo procedimiento incluye: proporcionar un sustrato poroso que tenga un primer lado y un segundo lado y que tenga una biopelícula de microorganismos unida al primer lado del mismo, estando configurado el sustrato para permitir el paso de metabolitos secundarios a su través y para evitar el paso de las células de los microorganismos a su través, y hacer que una solución nutriente fluya a través de la biopelícula y el sustrato en una dirección desde el primer lado del mismo al segundo lado del mismo en condiciones de oxígeno limitado o de cultivo anaerobio, a una velocidad que sea lo suficientemente baja para que se establezca un gradiente de nutriente a través de la biopelícula en el que la concentración de nutriente sea relativamente elevada respecto de la del sustrato y suficientemente elevada para sostener el crecimiento primario de los microorganismos y en el que la concentración de nutriente sea relativamente baja próxima a la del sustrato, y lo suficientemente baja para inducir y sostener una fase estacionaria de los microorganismos y dar lugar por tanto a que los microorganismos produzcan al menos un metabolito secundario, transportando el flujo de la solución nutriente a través del sustrato dicho metabolito secundario a través del sustrato hasta el segundo lado del mismo en el que se puede recoger el metabolito secundario secretado, reteniéndose las células de los microorganismos procedentes de la biopelícula en el primer lado del mismo.
2. Un procedimiento de la reivindicación 1, en el que los microorganismos se seleccionan entre el grupo que consiste en Clostridium sp., Bacillus sp., Pseudomonas sp., Vibrio sp., Rhodopseudomonas sp., Desulphovibrio desulfuricans, y Candida sp.
3. Un procedimiento de la reivindicación 1 o la reivindicación 2, en el que el caudal de la solución nutriente desde el primer lado al segundo lado es de 0, 01 – 10 volúmenes de solución nutriente por volumen de biorreactor por hora.
4. Un procedimiento de una cualquiera de las reivindicaciones 1 a 3, en el que el procedimiento se lleva a cabo durante un periodo de 1 – 30 días.
5. Un procedimiento de una cualquiera de las reivindicaciones 1 a 4, en el que la biopelícula tiene un espesor de 0, 1
– 10 mm.
6. Un procedimiento de una cualquiera de las reivindicaciones 1 a 5, en el que el metabolito secundario se produce intracelularmente por los microorganismos.
7. Un procedimiento de una cualquiera de las reivindicaciones 1 a 5, en el que el metabolito secundario se produce extracelularmente por los microorganismos.
8. Un procedimiento de producción de al menos un producto recombinante en condiciones de oxígeno limitado o de cultivo anaerobio, cuyo procedimiento incluye:
proporcionar un sustrato poroso que tenga un primer lado y un segundo lado y que tenga una biopelícula de microorganismos unida al primer lado del mismo, estando configurado el sustrato para permitir el paso de producto recombinante a su través y para evitar el paso de las células de los microorganismos a su través, y
hacer que una solución nutriente fluya a través de la biopelícula y el sustrato en una dirección desde el primer lado del mismo al segundo lado del mismo en condiciones limitantes de oxígeno o de cultivo anaerobio, a una velocidad que sea lo suficientemente baja para que se establezca un gradiente de nutriente que tenga un diferencial de concentración a través de la biopelícula en el que la concentración de nutriente sea relativamente elevada respecto de la del sustrato y lo suficientemente elevada para sostener el crecimiento primario de los microorganismos y en el que la concentración de nutriente sea relativamente baja próxima a la del sustrato, y lo suficientemente baja para inducir y sostener una fase estacionaria de microorganismos y dar lugar por tanto a que los microorganismos produzcan al menos un producto recombinante, transportando el flujo de la solución nutriente a través del sustrato dicho producto recombinante a través del sustrato al segundo lado del mismo en el que se puede recoger el producto recombinante, reteniéndose las células de los microorganismos procedentes de la biopelícula en el primer lado del mismo.
9. Un procedimiento de la reivindicación 8 en el que los microorganismos se seleccionan entre Lactococcus lactis, Escherichia coli, Bacillus subtilis, Pichia sp., Candida sp., Hansenula polymorpha y Sacharomyces cerevisiae.
10. Un procedimiento de una cualquiera de las reivindicaciones 8 a 9, en el que el procedimiento se lleva a cabo durante un periodo de 1 – 30 días.
11. Un procedimiento de una cualquiera de las reivindicaciones 8 a 10, en el que el caudal de la solución nutriente desde el primer lado al segundo lado es de 0, 001 – 10 volúmenes de solución nutriente por volumen de biorreactor por hora.
12. Un procedimiento de una cualquiera de las reivindicaciones 8 a 11, en el que la biopelícula tiene un espesor de 0, 1 – 10 mm.
13. Un procedimiento de una cualquiera de las reivindicaciones 8 a 11, que incluye añadir una molécula inductora a la solución nutriente de tal manera que el flujo de la solución nutriente a través del sustrato transporta dicha
molécula inductora a través de la biopelícula desde el primer lado al segundo lado, para inducir, por tanto, la producción de dicho producto recombinante por los microorganismos.
14. Un procedimiento de la reivindicación 13, en el que el inductor se selecciona entre al menos uno de L-arabinosa,
isopropil-b-D-tiogalactósido (IPTG) y metanol. 10
15. Un procedimiento de una cualquiera de las reivindicaciones 8 a 14, en el que el metabolito secundario se produce intracelularmente por los microorganismos.
16. Un procedimiento de una cualquiera de las reivindicaciones 8 a 14, en el que el metabolito secundario se 15 produce extracelularmente por los microorganismos.
Patentes similares o relacionadas:
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
Anticuerpo anti-FGF23 y composición farmacéutica que comprende el mismo, del 15 de Julio de 2020, de Kyowa Kirin Co., Ltd: Anticuerpo o fragmento funcional del mismo que se une a la totalidad o a una parte del epítopo de FGF23 humano, al que se une un anticuerpo producido […]
Producción de vectores de expresión y selección de células de alta capacidad de procesamiento, del 8 de Julio de 2020, de Kymab Limited: Un método para producir células que codifican un repertorio de anticuerpos que comprende cadenas pesadas y cadenas ligeras de anticuerpo cognadas, comprendiendo dicho […]
Biblioteca de péptidos y su uso, del 8 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Una biblioteca de péptidos que comprende una pluralidad de péptidos diferentes en la que los péptidos comprenden cada uno una secuencia de aminoácidos […]
Vacuna de ADN contra pseudotuberculosis en peces marinos, del 1 de Julio de 2020, de NATIONAL UNIVERSITY CORPORATION TOKYO UNIVERSITY OF MARINE SCIENCE AND TECHNOLOGY: Una vacuna de ADN para peces, caracterizada por: - impartir inmunidad contra la pseudotuberculosis causada por Photobacterium damselae subsp. piscicida - que comprende, […]
Vacuna de ADN que contiene un epítopo específico de VEGF y/o un epítopo específico de angiopoyetina-2, del 1 de Julio de 2020, de OSAKA UNIVERSITY: Un vector de expresión que codifica un polipéptido del antígeno del núcleo del virus de la hepatitis B quimérico con una inserción para uso en el tratamiento o la profilaxis […]
Anticuerpo anti-Notch 4 humano, del 1 de Julio de 2020, de EISAI R&D MANAGEMENT CO., LTD: Un anticuerpo anti-Notch4 o un fragmento de unión a Notch4 de este, donde dicho anticuerpo o un fragmento de unión a Notch4 de este comprende cadenas pesadas y ligeras y […]