Métodos para la detección simultánea de antígenos del VHC y anticuerpos para el VHC.
Un método para detectar simultáneamente la presencia de al menos un antígeno del núcleo del VHC y al menos un anticuerpo antinúcleo del VHC en una muestra de ensayo,
consistente en las siguientes etapas:
(a) poner en contacto dicha muestra de ensayo con:
(1) al menos un antígeno del núcleo vírico del VHC depositado sobre una fase sólida, durante un tiempo y bajo unas condiciones suficientes para la formación de complejos anticuerpo/antígeno, donde dicho antígeno del núcleo vírico del VHC es una proteína recombinante que comprende una secuencia de aminoácidos que consiste en la SEC. ID. Nº 6 y substituciones conservadoras de aminoácidos de la misma, y
(2) al menos un anticuerpo antinúcleo del VHC depositado sobre dicha fase sólida, durante un tiempo y bajo condiciones suficientes para la formación de complejos antígeno/anticuerpo, donde dicho al menos un anticuerpo antinúcleo del VHC depositado sobre dicha fase sólida es C11-14;
(b) añadir un conjugado a los complejos anticuerpo/antígeno resultantes de (a) (1) durante un tiempo y bajo unas condiciones suficientes como para permitir que dicho conjugado se una al anticuerpo unido de (a) (1), donde dicho conjugado incluye un segundo anticuerpo unido a un compuesto quimioluminiscente capaz de generar una señal detectable, y añadir simultáneamente un segundo conjugado a los complejos 20 antígeno/anticuerpo resultantes de (a) (2) durante un tiempo y bajo unas condiciones que permitan que dicho conjugado se una al antígeno del núcleo unido de (a) (2), donde dicho segundo conjugado incluye un tercer anticuerpo unido a dicho compuesto quimioluminiscente capaz de generar una señal detectable, donde dicho tercer anticuerpo es C11-10; y
(c) detectar dicha señal generada, indicando la presencia de dicha señal la presencia de dicho al menos un antígeno del núcleo del VHC, de dicho al menos un anticuerpo antinúcleo del VHC o de ambos en dicha muestra de ensayo.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2002/019958.
Solicitante: ABBOTT LABORATORIES.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: Dept. 377/AP6D-2, 100 Abbott Park Road Abbott Park, IL 60064-6050 ESTADOS UNIDOS DE AMERICA.
Inventor/es: LEARY, THOMAS, P., MUERHOFF, A., SCOTT, SHAH, DINESH, O., DAWSON,GEORGE A, JIANG,LILY, GUTIERREZ,ROBIN A, DESAI,SURESH, STEWART,JAMES L.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K14/005 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de origen vírico.
- C07K14/18 C07K 14/00 […] › Togaviridae, p. ej. Flavivirus, virus de la peste, virus de la fiebre amarilla, virus de la hepatitis C, virus de la encefalitis japonesa.
- C12N1/15 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › modificados por la introducción de material genético extraño.
- C12N1/19 C12N 1/00 […] › modificados por la introducción de material genético extraño.
- C12N1/21 C12N 1/00 […] › modificados por la introducción de material genético extraño.
- C12N15/09 C12N […] › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Tecnología del ADN recombinante.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
- C12P21/04 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › Péptidos o polipéptidos cíclicos o puenteados, p. ej. bacitracina.
- G01N21/76 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 21/00 Investigación o análisis de los materiales por la utilización de medios ópticos, es decir, utilizando rayos infrarrojos, visibles o ultravioletas (G01N 3/00 - G01N 19/00 tienen prioridad). › Quimicoluminiscencia; Bioluminiscencia.
- G01N33/543 G01N […] › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › con un soporte insoluble para la inmovilización de compuestos inmunoquímicos.
- G01N33/576 G01N 33/00 […] › para la hepatitis.
PDF original: ES-2409631_T3.pdf
Fragmento de la descripción:
Métodos para la detección simultánea de antígenos del VHC y anticuerpos para el VHC
Antecedentes de la invención
Campo técnico La presente invención se relaciona con métodos para la detección simultánea de antígenos del Virus de la Hepatitis C (VHC) , así como de anticuerpos producidos en respuesta a los antígenos del VHC. Más aún, la presente invención permite detectar antígenos en el estadio agudo precoz de la infección, incluso antes del desarrollo de anticuerpos, permitiendo de este modo la detección precoz de sangre y productos sanguíneos infectados y mejorando de este modo la seguridad del suministro de sangre.
Información sobre antecedentes Recientes estudios epidemiológicos indican que el VHC infecta a más de 170 millones de personas en todo el mundo y que, en más del 50% de los casos, la infección es crónica. En los Estados Unidos, existen aproximadamente 4 millones de personas infectadas y se estima que anualmente se producen 30.000 nuevas infecciones (NIH Conference, Hepatology Suppl. 1:2S (1997) ) . Además, el VHC es responsable de 8.000-10.000 muertes anuales en los Estados Unidos y es el indicador principal para el trasplante de hígado.
El genoma del VHC es una molécula de ARN de una sola hebra de polaridad positiva, que tiene una longitud de aproximadamente 9.400-9.500 nucleótidos. La organización de las regiones codificantes se asemeja a la de otros flavivirus [Major et al., Hepatology 25: 1527 (1997) ], así como a la de los virus GB más recientemente descubiertos [Muerhoff AS, et al., J. Virol. 69: 5621 (1995) ]. El genoma del VHC posee un gran marco abierto de lectura (ORF) codificante de un precursor de poliproteína de 3.010 a 3.033 aminoácidos dependiendo del aislado particular [Choo et al., Proc. Natl. Acad. Sci. USA 88: 2451 (1991) ; Grakoui et al., J. Virol. 67: 1385 (1993) ]. Los genes estructurales del VHC (núcleo y envuelta) son codificados cerca del extremo 5’ del genoma, seguidos de las proteasas y la helicasa, el cofactor de la helicasa y la replicasa. Se encuentran en cada lado del genoma regiones no codificantes (RNC) , que se piensa son importantes en la replicación.
La infección por el VHC se produce primariamente por exposición parenteral, es decir, a través de agujas compartidas, tatuajes o transfusión de sangre o productos sanguíneos contaminados. Tras la exposición, el virus entra en un hepatocito susceptible y se produce la replicación vírica. Existe un período de fase de eclipse de aproximadamente 10 días, durante el cual no hay evidencia de presencia vírica (es decir, no se puede detectar ARN vírico) , los niveles séricos de transaminasas están dentro de límites normales y no hay evidencia de respuesta inmune al VHC [Busch et al., Transfusion 40: 143 (2000) ]. Típicamente, aproximadamente 10 días después de la exposición se puede detectar el ARN del VHC, frecuentemente con cargas víricas de entre 100.000 y 120.000.000 copias de ARN del VHC por ml de suero. Varias semanas después, típicamente se produce un incremento en los niveles de ALT, lo que indica inflamación del hígado; se detectan anticuerpos aproximadamente 70 días tras la exposición como media.
Una de las medidas preventivas empleadas para limitar la propagación de las infecciones por VHC es rastrear la sangre en cuanto a exposición al VHC, ya sea por detección de anticuerpos para el VHC o por detección de moléculas específicas del virus (v.g., ARN del VHC o proteínas del núcleo del VHC) en suero/plasma. Se retiran la sangre o los productos sanguíneos derivados de individuos identificados como expuestos al VHC por medio de estas pruebas del suministro de sangre y no se utilizan para distribución a receptores de productos sanguíneos (véase, v.g., la Patente EE.UU. Nº 6.172.189) . Estas pruebas pueden ser también utilizadas en el marco clínico para diagnosticar una enfermedad hepática atribuible a infección por VHC.
Debido a la falta de disponibilidad de viriones de VHC intactos nativos, las pruebas serológicas de anticuerpos se han basado en antígenos recombinantes o péptidos sintéticos, que representan fragmentos seleccionados de la poliproteína vírica. Las pruebas de rastreo anti-VHC de primera generación se basaban en la detección de anticuerpos dirigidos contra una proteína recombinante (genotipo del VHC 1a) originada a partir de secuencias localizadas en la proteína no estructural NS-4 (C100-3) [Choo et al., Science 244: 359 (1989) ; Kuo et al., Science 244: 362 (1989) ]. Los ensayos de primera generación no podían detectar anticuerpos en aproximadamente un 10% de individuos con infección crónica por VHC y en hasta un 10-30% de individuos con infección aguda por VHC. Los ensayos anti-VHC de segunda generación han incorporado proteínas recombinantes de tres regiones diferentes del genoma del VHC (genotipo del VHC 1a) , que incluyen secuencias de aminoácidos del núcleo, NS3 y la proteína NS4 [Mimms et al., Lancet 336: 1590 (1990) ; Bresters et al., Vox Sang 62: 213 (1992) ], lo que permite un marcado perfeccionamiento con respecto a las pruebas de primera generación en la identificación de donantes de sangre infectados por VHC [Aach et al., N. Engl. J. Med. 325: 1325 (1991) ; Kleinman et al., Transfusion 32: 805 (1992) ]. Los ensayos de segunda generación detectan anticuerpos en prácticamente un 100% de los casos crónicos de VHC [Hino K., Intervirology 37: 77 (1994) ] y en casi un 100% de los casos agudos hacia las 12 semanas posteriores a la infección [Alter et al., N. Engl. J. Med. 327: 1899 (1992) ; Bresters et al., Vox Sang 62: 213 (1992) ]. La prueba de tercera generación incluye una proteína recombinante que expresa secuencias de aminoácidos de la región NS5, así como antígenos del núcleo, NS3 y NS4. Algunos estudios han indicado un ligero perfeccionamiento en cuanto a sensibilidad al comparar las pruebas de tercera generación con las pruebas de segunda generación [Lee et al., Transfusion 35: 845 (1995) ; Courouce et al. Transfusion 34: 790-795 (1994) ], pero este perfeccionamiento es atribuido en gran medida a cambios en la proteína NS3, más que a la inclusión de NS5 [Courouce et al., Lancet 343: 853 (1994) ].
En general, las pruebas de anticuerpos para el VHC de segunda y tercera generación detectan la exposición al VHC aproximadamente 70 días después de la exposición. Como el VHC establece una infección persistente, y en muchos casos de por vida, la detección de anticuerpos para el VHC representa un método muy eficiente para determinar la exposición al VHC. Sin embargo, las pruebas de anticuerpos por sí solas frecuentemente fallarán en la detección de individuos infectados por el VHC durante los primeros 70 días tras la exposición.
Las pruebas existentes para el antígeno del VHC se basan en la detección de la presencia del antígeno del núcleo del VHC en suero o plasma. La proteína del núcleo (o nucleocápside) comprende los primeros 191 aminoácidos de la poliproteína. Se han desarrollado dos tipos diferentes de ensayos serológicos que permiten la detección de antígenos del núcleo del VHC en suero. Un formato de ensayo detecta antígenos del núcleo del VHC en sujetos antes de la seroconversión y se utiliza en el rastreo de donantes de sangre, mientras que el otro formato de ensayo detecta antígenos del núcleo sólo en pacientes con hepatitis C, independientemente de su estado de anticuerpos para el VHC, y se utiliza en laboratorios clínicos para diagnosticar la exposición al VHC o para monitorizar la terapia antivírica.
Datos recientes sobre muestras obtenidas durante el período de preseroconversión indican que la prueba de antígenos del VHC detecta la exposición al VHC significativamente antes que las pruebas de anticuerpos [Aoyagi et al., J. Clin. Microbiol. 37: 1802 (1999) ; Peterson et al., Vox Sang 78: 80 (2000) ; Dawson et al., Transfusion, SD161, 40 (2000) ; Muerhoff et al., 7th International Meeting on Hepatitis C virus and related viruses, 3-7 de Diciembre de 2000] y representa una alternativa a las pruebas de ácidos nucleicos para detectar la exposición al VHC durante el período de preseroconversión. Las ventajas de la detección de antígenos del VHC son que la prueba es rápida y simple, que puede no requerir extracción de muestras u otro pretratamiento y que no es tan propensa a errores de manipulación (v.g., contaminación) como lo que puede ocurrir en las pruebas del ARN del VHC.
En los laboratorios clínicos, la prueba de antígenos del VHC tiene una sensibilidad comparable a la de las pruebas del ADN del VHC en la detección de la exposición al VHC en pacientes infectados con diferentes genotipos de VHC [Dickson et al., Transplantation 68: 1512 (1999) ] y en la monitorización de la terapia antivírica [Tanaka et al., Hepatology 32: 388... [Seguir leyendo]
Reivindicaciones:
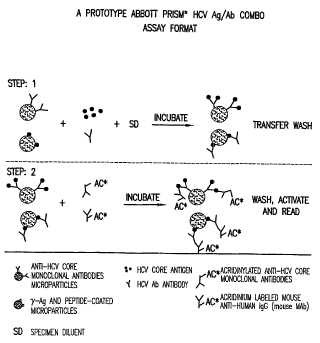
1. Un método para detectar simultáneamente la presencia de al menos un antígeno del núcleo del VHC y al menos un anticuerpo antinúcleo del VHC en una muestra de ensayo, consistente en las siguientes etapas:
(a) poner en contacto dicha muestra de ensayo con:
(1) al menos un antígeno del núcleo vírico del VHC depositado sobre una fase sólida, durante un tiempo y bajo unas condiciones suficientes para la formación de complejos anticuerpo/antígeno, donde dicho antígeno del núcleo vírico del VHC es una proteína recombinante que comprende una secuencia de aminoácidos que consiste en la SEC. ID. Nº 6 y substituciones conservadoras de aminoácidos de la misma, y
(2) al menos un anticuerpo antinúcleo del VHC depositado sobre dicha fase sólida, durante un tiempo y bajo condiciones suficientes para la formación de complejos antígeno/anticuerpo, donde dicho al menos un anticuerpo antinúcleo del VHC depositado sobre dicha fase sólida es C11-14;
(b) añadir un conjugado a los complejos anticuerpo/antígeno resultantes de (a) (1) durante un tiempo y bajo unas condiciones suficientes como para permitir que dicho conjugado se una al anticuerpo unido de (a) (1) , donde dicho conjugado incluye un segundo anticuerpo unido a un compuesto quimioluminiscente capaz de generar una señal detectable, y añadir simultáneamente un segundo conjugado a los complejos antígeno/anticuerpo resultantes de (a) (2) durante un tiempo y bajo unas condiciones que permitan que dicho conjugado se una al antígeno del núcleo unido de (a) (2) , donde dicho segundo conjugado incluye un tercer anticuerpo unido a dicho compuesto quimioluminiscente capaz de generar una señal detectable, donde dicho tercer anticuerpo es C11-10; y
(c) detectar dicha señal generada, indicando la presencia de dicha señal la presencia de dicho al menos un antígeno del núcleo del VHC, de dicho al menos un anticuerpo antinúcleo del VHC o de ambos en dicha muestra de ensayo.
2. El método de la reivindicación 1, donde dicho al menos un anticuerpo monoclonal antinúcleo depositado sobre la fase sólida no es reactivo con dicho al menos un antígeno del núcleo depositado sobre la fase sólida.
3. El método de la reivindicación 1, donde dicha fase sólida es una micropartícula.
4. Un kit consistente en: a) un recipiente que contiene al menos un antígeno del núcleo del VHC depositado sobre una fase sólida, donde dicho antígeno del núcleo vírico del VHC es una proteína recombinante que comprende una secuencia de aminoácidos consistente en la SEC. ID. Nº 6 y substituciones conservadoras de aminoácidos de la misma, y b) un recipiente que contiene al menos un anticuerpo anti-núcleo del VHC depositado sobre una fase sólida, donde dicho al menos un anticuerpo antinúcleo del VHC, depositado sobre dicha fase sólida es C11-14, y donde dicho kit incluye además al menos un conjugado que incluye un compuesto generador de señal unido a un segundo anticuerpo, donde dicho segundo anticuerpo es C11-10.
5. Un kit consistente en un recipiente que contiene: 1) al menos un antígeno del núcleo del VHC depositado sobre una fase sólida, donde dicho antígeno del núcleo vírico del VHC es una proteína recombinante que comprende una secuencia de aminoácidos consistente en la SEC. ID. Nº 6 y substituciones conservadoras de aminoácidos de la misma, y 2) al menos un anticuerpo antinúcleo del VHC depositado sobre dicha fase sólida, donde dicho al menos un anticuerpo antinúcleo del VHC, depositado sobre dicha fase sólida, es C11-14, y donde dicho kit incluye además al menos un conjugado que incluye un compuesto generador de señal unido a un segundo anticuerpo, donde dicho segundo anticuerpo es C11-10.
6. El kit de la reivindicación 4 ó 5, donde dicho compuesto generador de señal es acridinio.
7. Una proteína recombinante que comprende una secuencia de aminoácidos consistente en la SEC. ID. Nº 6 y substituciones conservadoras de aminoácidos de la misma.
8. Una proteína recombinante que comprende una secuencia de aminoácidos codificada por una secuencia de nucleótidos de la SEC. ID. Nº 5.
9. Un vector o construcción que comprende una secuencia de nucleótidos de la SEC. ID. Nº 5.
10. Una célula huésped que contiene dicho vector o construcción de la reivindicación 9.
SEC. ID. Nº 18
SEC. ID. Nº 19
SEC. ID. Nº 20 SEC. ID. Nº 21
SEC. ID. Nº 22
SEC. ID. Nº 23
SEC. ID. Nº 24
SEC. ID. Nº 25 SEC. ID. Nº 26
SEC. ID. Nº 27
SEC. ID. Nº 28
SEC. ID. Nº 29
SEC. ID. Nº 36
SEC. ID. Nº 37
SEC. ID. Nº 38 SEC. ID. Nº 39
SEC. ID. Nº 40
SEC. ID. Nº 41
SEC. ID. Nº 42
SEC. ID. Nº 43
Patentes similares o relacionadas:
Método de determinación de la presencia y/o cantidad de moléculas diana, del 22 de Julio de 2020, de Canopy Biosciences, LLC: Método para el análisis de células individuales en una muestra de sangre mediante la determinación de la presencia y/o cantidad de una o más moléculas […]
Kit de reactivos utilizado para detectar gastrina-17 y método de preparación y aplicación para el kit de reactivos, del 15 de Julio de 2020, de Shenzhen New Industries Biomedical Engineering Co., Ltd: Un kit para detectar gastrina-17, caracterizado porque comprende un componente A y un componente B, en donde el componente A es un primer […]
Un sustrato para inmovilizar sustancias funcionales y un método para preparar las mismas, del 15 de Julio de 2020, de Temasek Polytechnic: Un sustrato sólido que tiene compuestos dispuestos sobre el mismo, en donde se inmoviliza una molécula funcional sobre los compuestos, teniendo cada compuesto una cadena que […]
Dispositivo para la detección de analitos, del 1 de Julio de 2020, de TECHLAB, INC.: Un dispositivo para detectar por lo menos una sustancia de interés en una muestra líquida, comprendiendo el dispositivo: (a) una unidad que […]
Análisis biológico autónomo de alta densidad, del 1 de Julio de 2020, de BioFire Diagnostics, LLC: Recipiente para realizar reacciones de amplificación en un sistema cerrado que comprende una porción flexible que tiene una serie de blísteres […]
Chip de análisis y aparato de análisis de muestras, del 1 de Julio de 2020, de Takano Co., Ltd: Un chip de análisis que comprende: un sustrato conformado sustancialmente en forma de disco; un puerto de inyección formado […]
Estructuras para controlar la interacción de luz con dispositivos microfluídicos, del 3 de Junio de 2020, de Opko Diagnostics, LLC: Un sistema de ensayo múltiplex que comprende: un artículo que soporta ensayos en fase sólida, comprendiendo dicho artículo un sustrato plano rígido y comprendiendo […]
Uso de un estándar para la detección de agregados de proteínas de una enfermedad por plegamiento incorrecto de proteínas, del 27 de Mayo de 2020, de FORSCHUNGSZENTRUM JULICH GMBH: Uso de un estándar, que comprende una nanopartícula inorgánica con un tamaño de 2 a 200 nm, en cuya superficie ya sea mediante i) ácido carboxílico-espaciador-maleimida […]