Cristalización selectiva del ácido 3-piridil-1-hidroxietilideno-1,1-bisfosfónico sódico como hemipentahidrato o monohidrato.
Un proceso para producir selectivamente ácido 3-piridil-1-hidroxietilidén-1,
1-bisfosfónico sódico hemipentadrato y monohidrato, que consta de las etapas de: a) proveer una solución acuosa de ácido 3-piridil-1-hidroxietilidén-1, 1-bisfosfónico sódico; b) calentar la solución acuosa hasta una temperatura que varía desde unos 45ºC hasta unos 75ºC; c) añadir un disolvente a la solución acuosa caracterizada por que el disolvente es seleccionado a partir del grupo formado por alcoholes, ésteres, éteres, cetonas, amidas y nitrilos; y d) opcionalmente enfriar la solución acuosa.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2001/003336.
Solicitante: WARNER CHILCOTT COMPANY, LLC.
Inventor/es: CAZER, FREDRICK, DANA, PERRY, GREGORY, EUGENE, BILLINGS, DENNIS, MICHAEL, REDMAN-FUREY, NANCY, LEE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/663 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Compuestos que tienen varios grupos deácido del fósforo o sus esteres, p. ej. ácido clodrónico, ácido pamidrónico.
- A61K31/675 A61K 31/00 […] › que tienen el nitrógeno como heteroátomo de un ciclo, p. ej. fosfato de piridoxal.
- A61P19/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de problemas del esqueleto.
- A61P19/02 A61P […] › A61P 19/00 Medicamentos para el tratamiento de problemas del esqueleto. › para problemas de las articulaciones, p.ej. artritis, artrosis.
- A61P19/08 A61P 19/00 […] › para las enfermedades óseas, p.ej. raquitismo, enfermedad de Paget.
- A61P19/10 A61P 19/00 […] › para la osteoporosis.
- A61P25/00 A61P […] › Medicamentos para el tratamiento de trastornos del sistema nervioso.
- A61P29/00 A61P […] › Agentes analgésicos, antipiréticos o antiinflamatorios que no actúan sobre el sistema nervioso central, p. ej. agentes antirreumáticos; Antiinflamatorios no esteroideos (AINEs).
- A61P3/14 A61P […] › A61P 3/00 Medicamentos para el tratamiento de trastornos del metabolismo (de la sangre o de fluido extracelular A61P 7/00). › para la homeostasia del calcio (vitamina D A61P 3/02; hormonas paratiroideas A61P 5/18; calcitonina A61P 5/22; osteoporosis A61P 19/10; metástasis oseas A61P 35/04).
- C07F9/58 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07F COMPUESTOS ACICLICOS, CARBOCICLICOS O HETEROCICLICOS QUE CONTIENEN ELEMENTOS DISTINTOS DEL CARBONO, HIDROGENO, HALOGENOS, OXIGENO, NITROGENO, AZUFRE, SELENIO O TELURO (porfirinas que contienen metal C07D 487/22; compuestos macromoleculares C08). › C07F 9/00 Compuestos que contienen elementos de los grupos 5 o 15 del sistema periódico. › Ciclos piridínicos.
PDF original: ES-2225481_T3.pdf
Fragmento de la descripción:
Cristalización selectiva del ácido 3-piridil-1-hidroxietilideno-1,1-bifosfónico sódico como hemipentahidrato o monohidrato.
Campo técnico
La presente invención se refiere al ácido 3-piridil-1-hidroxietilidén-1,1-bisfosfónico sódico hemipentahidrato y monohidrato, a las composiciones que contienen dicho hemipentahidrato y/o monohidrato y a los métodos de cristalización selectiva del hemipentahidrato o monohidrato.
Referencia cruzada
Esta solicitud reivindica prioridad con respecto al documento Título 35, Código de Estados Unidos 119(e) de Serie de Solicitud Provisional nº. 60/179.505, presentada el 1 de Febrero, 2000.
Antecedentes de la invención
Los bisfosfonatos como el ácido 3-piridil-1-hidroxietilidén-1,1-bisfosfónico (RISEDRONATO) han sido propuestos para emplearse en el tratamiento de enfermedades de huesos y metabolismo de calcio. Tales enfermedades incluyen osteoporosis, hiperparatiroidismo, hipercalcemia de malignidad, metástasis ósea osteolítica, miositis osificante progresiva, calcinosis universalis, artritis, neuritis, bursitis, tendonitis y otras afecciones inflamatorias. La enfermedad de Paget y la osificación heterotópica son tratadas satisfactoriamente en la actualidad tanto con EHDP (ácido etano-1-hidroxi-1,1-difosfónico) como con RISEDRONATO.
Los bisfosfonatos contribuyen a inhibir la resorción del tejido óseo, lo cual es beneficioso para los pacientes que sufren de una excesiva pérdida ósea. Sin embargo, pese a ciertas analogías en la actividad biológica, no todos los bisfosfonatos manifiestan el mismo grado de actividad biológica. Algunos bisfosfonatos tienen serios inconvenientes en cuanto al grado de toxicidad en animales y la capacidad de tolerancia o los efectos secundarios negativos en humanos. Las formas de sal e hidrato de los bisfosfonatos alteran tanto su solubilidad como su biodisponi- bilidad.
Es conocido en la bibliografía que algunos ácidos bisfosfónicos y sus sales son capaces de formar hidratos, el risedronato sódico existe en tres estados de hidratación: mono, hemipenta y anhidro. Son deseables los procedimientos de cristalización que producen selectivamente la forma hemipentahidrato o la forma monohidrato. Esta solicitud describe las formas de cristal hemipentahidrato y monohidrato, las composiciones que contienen dichas formas de cristal hemipentahidrato y monohidrato y la formación selectiva de estos cristales.
Compendio de la invención
La presente invención describe el ácido 3-piridil-1-hidroxietilidén-1,1-bisfosfónico sódico hemipentahidrato y monohidrato, las composiciones que contienen dicho hemipentahidrato y/o monohidrato y los métodos de cristalización selectiva del hemipentahidrato o monohidrato. La temperatura de formación de núcleos y la velocidad de cristalización son las variables críticas que controlan la proporción de hidratos formados.
Descripción detallada de la presente invención
La presente invención se refiere al ácido 3-piridil-1-hidroxietilidén-1,1-bisfosfónico sódico hemipentahidrato y monohidrato y a las composiciones que
contienen dichos hemipentahidrato y monohidrato. También se describe un nuevo proceso para la cristalización selectiva del bisfosfonato geminal, risedronato sódico, ácido 3-piridil-1-hidroxietilidén-1,1-bisfosfónico sódico como el hemipentahidrato y como el monohidrato.
El risedronato sódico, la sal mono sódica de risedronato, existe en tres estados de hidratación cristalinos: anhidro, mono y hemipentahidrato. Son preferidos el monohidrato y el hemipentahidrato.
El hemipentahidrato es la forma cristalina termodinámicamente preferida bajo las condiciones típicas de proceso, fundamentado en la observación de que los cristales de monohidrato se convertían en la forma hemipentahidrato.
El peso de agua en el monohidrato varía desde un 5,0% hasta un 7,1%, de forma más preferida desde un 5,6% hasta un 6,5% y el valor más preferido es un 5,6%. El monohidrato además es caracterizado mediante cristalografía de rayos X en monocristal y mediante análisis termogravimétrico. La forma monohidrato también presenta señales identificables cuando es examinada mediante difracción de rayos X en polvo, calorimetría diferencial de barrido, espectroscopía infrarroja por transformada de Fourier o espectroscopía en el infrarrojo cercano.
El peso de agua en el hemipentahidrato varía desde un 11,9% hasta un 13,9%, de forma más preferida desde un 12,5% hasta un 13,2% y el valor más preferido es un 12,9%. El hemipentahidrato además es caracterizado mediante cristalografía de rayos X en monocristal y mediante análisis termogravimétrico. La forma hemipentahidrato también presenta señales identificables cuando es examinada mediante difracción de rayos X en polvo, calorimetría diferencial de barrido, espectroscopía infrarroja por transformada de Fourier o espectroscopía en el infrarrojo cercano.
La temperatura de formación de núcleos y la velocidad de cristalización son las variables críticas que controlan la proporción de hidratos formados. La temperatura de formación de núcleos puede controlarse mediante el control de la relación de agua a soluto, la temperatura de solución, y la relación de disolvente orgánico a agua.
El risedronato sódico hemipentahidrato es la forma termodinámicamente favorecida bajo las condiciones típicas de proceso descritas. Las composiciones contienen risedronato sódico hidrato que en peso varía desde un 50% hasta un 100%, de forma más preferida desde un 80% hasta un 100%, y la más preferida de todas desde un 90% hasta un 100% de risedronato sódico hemipentahidrato y desde un 50% hasta un 0%, de forma más preferida desde un 20% hasta un 0%, y la más preferida de todas desde un 10% hasta un 0% de risedronato sódico monohidrato.
Al alterar las condiciones de proceso como se describe, puede producirse selectivamente la forma de cristal monohidrato. Las composiciones contienen risedronato sódico hidrato que en peso varía desde un 50% hasta un 99%, de forma más preferida desde un 80% hasta un 99%, y la más preferida de todas desde un 95% hasta un 99% de risedronato sódico monohidrato y desde un 50% hasta un 1%, de forma más preferida desde un 20% hasta un 1%, y la más preferida de todas desde un 5% hasta un 1% de risedronato sódico hemipentahidrato.
La invención además comprende composiciones farmacéuticas que contienen los compuestos de hemipentahidrato y monohidrato.
Definiciones y uso de términos
Lo siguiente es una lista de definiciones para términos usados en la presente invención:
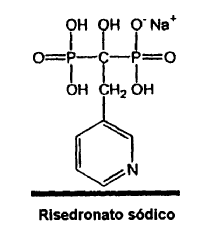
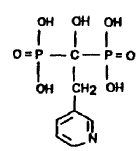
El término risedronato
, como se usa en la presente invención, denota al ácido 3-piridil-1-hidroxietilidén-1,1-bisfosfónico y tiene la siguiente estructura:
El compuesto risedronato es descrito además en la Patente de EE.UU.
5.583.122, Benedict et al., cedida a Procter & Gamble, publicada el 10 de Diciembre, 1996, y en An American Coference, Bisphosphonates: Current Status and future Prospects
, The Royal College of Physicians, Londres, Inglaterra, 21-22 Mayo, 1990, organizado por IBC Technical Services.
Tal y como se usa en la presente invención, disolvente
, es una sustancia capaz de disolver otra sustancia para formar una solución uniforme. El disolvente puede ser tanto polar como no polar. Los disolventes son seleccionados a partir del grupo formado por alcoholes, ésteres, éteres, cetonas, amidas y nitrilos. El más preferido es el isopropanol.
El Proceso
El proceso conforme a la presente invención se caracteriza porque el proceso descrito en la presente invención se adapta fácilmente a la producción industrial. Los siguientes ejemplos, que no son restrictivos, ilustran los procesos de la presente invención.
El grado de hidratación del ácido 3-piridil-1-hidroxietilidén-1,1-bisfosfónico sódico se puede controlar mediante la variación de los parámetros de cristalización para controlar la temperatura de formación de núcleos y la velocidad de cristalización. La proporción de las formas de cristal hemipentahidrato frente a monohidrato en el producto se puede... [Seguir leyendo]
Reivindicaciones:
1. Un proceso para producir selectivamente ácido 3-piridil-1-hidroxietilidén-1,1-bisfosfónico sódico hemipentahidrato y monohidrato, que consta de las etapas de:
a) proveer una solución acuosa de ácido 3-piridil-1-hidroxietilidén-1,1-bisfosfónico sódico;
b) calentar la solución acuosa hasta una temperatura que varía desde unos 45ºC hasta unos 75ºC;
c) añadir un disolvente a la solución acuosa caracterizada por que el disolvente es seleccionado a partir del grupo formado por alcoholes, ésteres, éteres, cetonas, amidas y nitrilos; y
d) opcionalmente enfriar la solución acuosa.
2. El proceso de la Reivindicación 1, caracterizado porque la solución acuosa se calienta hasta una temperatura que varía desde unos 55ºC hasta unos 75ºC.
3. El proceso de la Reivindicación 1, caracterizado porque la solución acuosa se calienta hasta unos 70ºC y la solución acuosa no se enfría.
4. El proceso de la Reivindicación 1, caracterizado porque la solución acuosa se calienta hasta una temperatura que varía desde unos 50ºC hasta unos 70ºC.
5. El proceso de la Reivindicación 4, caracterizado porque la solución acuosa se enfría a una velocidad que varía desde unos 0,1ºC a unos 2ºC por minuto.
6. El proceso de la Reivindicación 1, caracterizado porque la solución acuosa se calienta hasta unos 60ºC y luego se enfría hasta unos 25ºC en unas 2 horas.
7. El proceso de la Reivindicación 1, caracterizado porque la solución acuosa se calienta hasta unos 60ºC y se mantiene en unos 60ºC durante unas 4 horas, luego se enfría hasta unos 25ºC en unas 2 horas.
8. El proceso conforme a cualquiera de las reivindicaciones precedentes, caracterizado porque el disolvente es isopropanol.
9. Una composición farmacéutica que contiene ácido 3-piridil-1-hidroxietilidén-1,1-bisfosfónico sódico, caracterizada porque el ácido 3-piridil-1-hidroxietilidén-1,1-bisfosfónico sódico varía desde un 50% hasta menos de un 100% en hemipentahidrato y desde un 50% hasta más de un 0% en monohidrato.
10. La composición farmacéutica de la Reivindicación 9, caracterizada porque el ácido 3-piridil-1-hidroxietilidén-1,1-bisfosfónico sódico varía desde un 90% hasta menos de un 100% en hemipentahidrato y desde un 10% hasta más de un 0% en monohidrato.
Patentes similares o relacionadas:
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Agente terapéutico para cáncer sólido, del 17 de Junio de 2020, de IDAC Theranostics, Inc: Un agente para uso en el tratamiento de cáncer sólido que comprende como principio activo un anticuerpo anti-CD4 que es un anticuerpo quimérico de tipo humano, un anticuerpo […]
Una terapia de combinación para un injerto estable y a largo plazo usando protocolos específicos para el agotamiento de los linfocitos T/B, del 20 de Mayo de 2020, de YEDA RESEARCH AND DEVELOPMENT CO. LTD.: Una dosis de células hematopoyéticas inmaduras de linfocitos T agotados, en donde dichas células hematopoyéticas inmaduras de linfocitos T agotados comprenden menos de 5 x 105 […]
Profármaco tenofovir éster monobencílico fosfamida, método de preparación y uso del mismo, del 6 de Mayo de 2020, de Jiangsu Tasly Diyi Pharmaceutical Co., Ltd: Un compuesto tenofovir éster monobencílico fosfamida de la fórmula general X, y el hidrato, solvato, sal farmacéuticamente aceptable del mismo o el isómero […]
Agente terapéutico para la disfunción meibomiana, del 6 de Mayo de 2020, de SANTEN PHARMACEUTICAL CO., LTD.: Una composición farmacéutica que comprende sirolimus a una concentración de 0,01 a 0,5% (p/v) como único ingrediente activo para uso en la supresión de la obstrucción de […]
Formulación de doxilamina y piridoxina y/o metabolitos o sales de estas, del 6 de Mayo de 2020, de DUCHESNAY INC.: Una forma de dosificación oral de liberación dual que comprende de 5 mg a 40 mg de doxilamina y/o una sal farmacéuticamente aceptable de esta y de 5 […]
Composición farmacéutica inyectable estable de antagonista del receptor de neuroquinina-1 y procedimiento para su preparación, del 29 de Abril de 2020, de PHARMATHEN S.A.: Una composición farmacéutica de liberación controlada para administración intramuscular o subcutánea que comprende Aprepitant o Fosaprepitant […]
Bisfosfonatos conjugados para el diagnóstico y la terapia de enfermedades óseas, del 22 de Abril de 2020, de SCV GmbH: Compuesto V para la complejación de isótopos metálicos, que comprende un quelante X y uno o varios vectores diana conjugados con el quelante X con la estructura -L1-R1-L2-R2-L3-R3, […]