Composición farmacéutica para la administración parenteral de un antagonista del receptor beta-adrenérgico de acción ultrarrápida.
Uso de una ciclodextrina y/o un derivado funcional de ciclodextrina seleccionados entre el grupo que consis-te en α
-ciclodextrina, ß-ciclodextrina, α-ciclodextrina, (2-hidroxipropil)-ß-ciclodextrina y (sulfobutiléter)-7ß-ciclodextrina y mezclas de las mismas, para mejorar la estabilidad de un antagonista del receptor ß-adrenérgico de acción ultrarrápida, seleccionado entre el grupo que consiste en esmolol, landiolol, flestolol o una de sus sales farmacéuticamente aceptables, en una solución acuosa, adecuada para la administración parenteral y estable durante el almacenamiento
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/AT2008/000470.
Solicitante: AOP ORPHAN PHARMACEUTICALS AG.
Nacionalidad solicitante: Austria.
Dirección: WILHELMINENSTRASSE 91/II F/B 4 1160 WIEN AUSTRIA.
Inventor/es: WIDMANN,RUDOLF STEFAN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/24 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen un grupo amino o nitro.
- A61K31/5377 A61K 31/00 […] › no condensadas y conteniendo otros heterociclos, p. ej. timolol.
- A61K31/724 A61K 31/00 […] › Ciclodextrinas.
- A61K47/40 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Ciclodextrinas; Sus derivados.
- A61K47/48
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
- A61P9/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de trastornos en el aparato cardiovascular.
- B82Y5/00 TECNICAS INDUSTRIALES DIVERSAS; TRANSPORTES. › B82 NANOTECNOLOGIA. › B82Y USOS O APLICACIONES ESPECIFICOS DE NANOESTRUCTURAS; MEDIDA O ANALISIS DE NANOESTRUCTURAS; FABRICACION O TRATAMIENTO DE NANOESTRUCTURAS. › Nano- biotecnología o nano-medicina, p. ej. ingeniería de proteínas o administración de fármaco.
PDF original: ES-2397126_T3.pdf
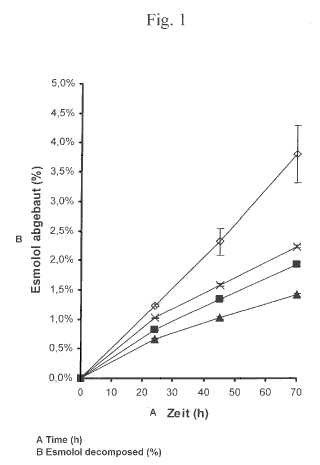
Fragmento de la descripción:
Composición farmacéutica para la administración parenteral de un antagonista del receptor beta-adrenérgico de acción ultrarrápida.
La presente invención se refiere a una composición farmacéutica para la administración parenteral de un antagonista del receptor β-adrenérgico de acción ultrarrápida, en forma de solución de acuerdo con las reivindicaciones, y al uso de una ciclodextrina y/o un derivado funcional de ciclodextrina para elevar la estabilidad de un antagonista del receptor β-adrenérgico de acción ultrarrápida en una solución acuosa, de acuerdo con las reivindicaciones adecuada para la administración parenteral y estable durante el almacenamiento.
Los antagonistas del receptor β-adrenérgico de acción ultrarrápida, tales como clorhidrato de esmolol, clorhidrato de landiolol (dos β1-bloqueantes cardioselectivos) y clorhidrato flestolol, debido a su semivida de eliminación muy corta, se emplean en forma de formulaciones parenterales, especialmente en la anestesia, así como en servicios médicos de urgencias y de cuidados intensivos.
Para los fines de la presente invención, por “acción ultrarrápida” se entiende una sustancia activa, cuya semivida de eliminación es menor que la del β1-bloqueante metoprolol (semivida t1/2 = 90 minutos) . Más particularmente, la semivida de eliminación de los antagonistas del receptor β-adrenérgico de acción ultrarrápida, empleados de acuerdo con la invención, es preferiblemente menor de 20 minutos.
Un problema, por un lado, es la baja estabilidad de estas sustancias activas en soluciones acuosas, ya que se escinden hidrolíticamente en ácidos libres y alcohol (en el caso de esmolol en ácido puro y metanol) [por ejemplo: Ba
aske DM, Dykstra SD, Wagenknecht DM, Karnatz NN, “Stability of esmolol hydrochloride in intravenous solutions”.
Am J Hosp Pharm. 1 de noviembre 1994; 51 (21) :2693-6; Tamotsu Yasuda, Hiroyuki Kamiya, Yoko Tanaka, Go Watanabe, “Ultrashort-acting cardioselective beta-blockade attenuates postischemic cardiac dysfunction in the isolated rat heart”, Eur J Thorac Cardiovasc Surg 2001; 19:647-652].
Por otra parte, la concentración de sustancia activa empleada para la administración, por ejemplo, de esmolol, es tan alta que estas soluciones son frecuentemente hipertónicas. Además, para estabilizar estas soluciones en muchos casos se añade alcohol en concentraciones de aproximadamente 25%. Debido a estos problemas técnicos de formulación, el uso de esmolol en medicina intensiva está asociado con riesgos adicionales.
Sin embargo, el landiolol que está disponible comercialmente, por ejemplo, actualmente solo está disponible en formulaciones sólidas que se tienen que disolver antes de utilizar en medicina intensiva, lo que puede conducir a una pérdida de tiempo innecesaria. Las composiciones liofilizadas que contienen landiolol se conocen a través del documento CN 1827109A.
Los intentos de resolver estos problemas mencionados para esmolol incluyen la adición de dextrosa [Wiest DB, Garner SS, Childress LM., “Stability of esmolol hydrochloride in 5% dextrose injection”. Am J Health Syst Pharm. 1 de abril de 1995; 52 (7) :716-8], ajustar el valor del pH a <6 [Rosenberg LS, Hostetler CK, Wagenknecht DM, Aunet DA, “An accurate prediction of the pH change due to degradation: correction for a "produced" secondar y buffering system”. Pharm. Res. Agosto 1988; 5 (8) :514-7], así como la adición de propilenglicol en concentraciones elevadas [http://www.rxlist.com/cgi/generic3/esmolol.htm].
El documento WO 85/04580 describe soluciones de esmolol con una proporción en peso de 0, 1% a 30%, que también contienen un tampón y etanol en una proporción de 5 a 60%.
En la reivindicación 1 del documento EP 0403578 B1 se reivindica una composición inyectable acuosa para el tratamiento de trastornos cardiacos, que comprende una cantidad eficaz de esmolol (clorhidrato) en una proporción de 1 mg a 250 mg de esmolol/ml de solución y de 0, 01 a 0, 04 M de tampón y tiene un valor de pH en el intervalo de 4, 5 a 5, 5.
El documento de solicitud internacional WO 02/076446 describe una solución de esmolol que contiene de 0, 1 a 500 mg/ml de clorhidrato de esmolol, de 0, 01 a 2 M de tampón y de 1 a 500 mg/ml de un agente de ajuste osmótico.
El documento de solicitud de patente europea EP 1417962 A describe composiciones farmacéuticas que constan de 30 ml a 70 ml de dilución, con una proporción de 1500 mg a 3500 mg de esmolol o una sal farmacéuticamente aceptable de las mismas.
No se conocen tentativas para resolver los problemas mencionados para landiolol.
El objeto de la presente invención es poner a disposición una composición para la administración parenteral de antagonistas del receptor β-adrenérgico de acción ultrarrápida, en particular para la inyección o la infusión, que tiene por un lado una estabilidad elevada durante el almacenamiento y, en segundo lugar, una osmolaridad que es adecuada para la administración. La composición también tiene que tener propiedades lo más vasoprotectoras posibles, lo que es especialmente importante a concentraciones elevadas de sustancia activa (por ejemplo, en el caso de esmolol) .
Sorprendentemente, se ha encontrado que el uso de una ciclodextrina y/o un derivado funcional de ciclodextrina, seleccionado entre el grupo que consiste en α-ciclodextrina, β-ciclodextrina, γ-ciclodextrina, (2-hidroxipropil) -βciclodextrina y (sulfobutiléter) -7β-ciclodextrina, para mejorar la estabilidad de un antagonista del receptor βadrenérgico de acción ultrarrápida, seleccionado entre el grupo que consiste en esmolol, landiolol, flestolol, y/o una sal farmacéuticamente aceptable de los mismos, en una solución acuosa, adecuada para la administración parenteral y estable durante el almacenamiento, cumple el objeto de la invención de forma excelente.
En este aspecto de la presente invención, la solución también puede contener otros excipientes, en particular, tampones, conservantes, disolventes orgánicos miscibles con agua, sales, alcoholes de azúcar y/o azúcares.
En un aspecto adicional, la presente invención se refiere a una composición farmacéutica para la administración parenteral de un antagonista del receptor β-adrenérgico de acción ultrarrápida, en forma de una solución estable durante el almacenamiento, que consiste esencialmente en a) un antagonista del receptor β-adrenérgico de acción ultrarrápida seleccionado entre el grupo que consiste en esmolol, landiolol, flestolol, y/o una sal farmacéuticamente aceptable de los mismos,
b) agua y
c) una ciclodextrina y/o un derivado funcional de ciclodextrina, seleccionados entre el grupo que consiste en αciclodextrina, β-ciclodextrina, γ-ciclodextrina, (2-hidroxipropil) -β-ciclodextrina y (sulfobutiléter) -7β-ciclodextrina.
Los documentos DE 42 07 922 A1 y US 2004/0053894 describen, en general, el uso de ciclodextrina en composiciones farmacéuticas. El uso de ciclodextrina en composiciones farmacéuticas también se describe en los documentos WO 2003/033025 A2, US 2003/0216349 A1 e Ikeda et al., J Pharm Sci. 2004, 93 (7) , 1659-1671.
Se ha encontrado que mediante la adición de ciclodextrina y/o un derivado funcional de ciclodextrina, se puede aumentar significativamente la estabilidad de los antagonistas del receptor β-adrenérgico de acción ultrarrápida en una solución puramente acuosa.
Sorprendentemente, las soluciones de antagonistas del receptor β-adrenérgico de acción ultrarrápida, que consisten solamente en los antagonistas del receptor β-adrenérgico de acción ultrarrápida, ciclodextrina y agua, son suficientemente estables durante el almacenamiento, incluso sin la presencia de excipientes adicionales (tales como tampones o agentes que ajustan la osmolaridad, conocidos, p. ej., a partir de la técnica anterior) , y son adecuadas para la administración en términos de propiedades osmolares. Esto se aplica en particular en el intervalo de pH de 3 a 7, 5, más preferiblemente de 5 a 7.
Para los fines de la presente invención, por "estable durante el almacenamiento", se entiende una solución acuosa que, en contraste con una solución preparada mediante la disolución de un producto liofilizado, se puede almacenar durante un largo período, sin que se produzca una degradación significativa de la sustancia activa contenida. Por “estable durante el almacenamiento” se entienden en particular soluciones acuosas, en las que después de un mes se ha degradado menos del 5% de la sustancia activa.
Tal y como se ha mencionado... [Seguir leyendo]
Reivindicaciones:
1. Uso de una ciclodextrina y/o un derivado funcional de ciclodextrina seleccionados entre el grupo que consiste en α-ciclodextrina, β-ciclodextrina, γ-ciclodextrina, (2-hidroxipropil) -β-ciclodextrina y (sulfobutiléter) -7βciclodextrina y mezclas de las mismas, para mejorar la estabilidad de un antagonista del receptor β-adrenérgico de acción ultrarrápida, seleccionado entre el grupo que consiste en esmolol, landiolol, flestolol o una de sus sales farmacéuticamente aceptables, en una solución acuosa, adecuada para la administración parenteral y estable durante el almacenamiento.
2. Composición farmacéutica para la administración parenteral de un antagonista del receptor β-adrenérgico de acción ultrarrápida en forma de una solución estable durante el almacenamiento, que consiste esencialmente en
a) un antagonista del receptor β-adrenérgico de acción ultrarrápida, seleccionado entre el grupo que consiste en esmolol, landiolol, flestolol o una sal farmacéuticamente aceptable de los mismos,
b) agua,
c) una ciclodextrina y/o un derivado funcional de ciclodextrina, seleccionado entre el grupo que consiste en αciclodextrina, β-ciclodextrina, γ-ciclodextrina, (2-hidroxipropil) -β-ciclodextrina y (sulfobutiléter) -7β-ciclodextrina.
3. Composición farmacéutica de acuerdo con la reivindicación 2, que contiene además otros excipientes seleccionados entre tampones, agentes conservantes, disolventes miscibles en agua, sales, alcoholes de azúcar y/o azúcares.
4. Uso o composición de acuerdo con una de las reivindicaciones 1 a 3, caracterizados porque el valor del pH de la solución es de 3 a 7, 5, preferentemente de 5 a 7.
5. Uso o composición de acuerdo con una de las reivindicaciones 1 a 4, caracterizados porque la concentración de la ciclodextrina o del derivado funcional de la misma es de 0, 1% a 20% (p/v) , preferiblemente de 0, 25% a 7% (p/v) , especialmente preferido de 0, 5% a 4%.
6. Uso o composición de acuerdo con una de las reivindicaciones precedentes, caracterizados porque la concentración del antagonista del receptor β-adrenérgico de acción ultrarrápida o de la sal del mismo es de 0, 1% a 30%.
7. Uso o composición de acuerdo con una de las reivindicaciones precedentes, caracterizados porque la solución tiene una osmolaridad de 270 mOsmol/l hasta 310 mOsmol/l, más preferiblemente de 280 mOsmol/l hasta 300 mOsmol/l.
8. Uso o composición de acuerdo con una de las reivindicaciones precedentes, en donde la composición está presente en forma de unidad de venta seleccionada entre el grupo que consiste en - 1 ml de solución que contiene 10-20 mg de esmolol o una sal del mismo, - 2 ml de solución que contiene 10-100 mg de esmolol o una sal del mismo, - 5 ml de solución que contien.
5. 500 mg de esmolol o una sal del mismo, - 10 ml de solución que contiene 505000 mg, en particular 2500 mg de esmolol o una sal del mismo, - 50 ml de solución que contien.
5. 5000 mg de esmolol o una sal del mismo, - 100 ml de solución que contien.
5. 5000 mg de esmolol o una sal del mismo, - 250 ml de solución que contien.
5. 5000 mg de esmolol o una sal del mismo.
9. Uso o composición de acuerdo con una de las reivindicaciones 1 a 8, en donde la composición está presente en forma de una unidad de venta seleccionada entre el grupo que consiste en - 1 ml de solución que contiene 520 mg de landiolol o flestolol o una sal de los mismos, - 2 ml de solución que contiene 5-100 mg de landiolol o flestolol o una sal de los mismos, -5 ml de solución que contiene 10-500 mg de landiolol o flestolol o una sal de los mismos, - 10 ml de solución que contiene 10-5000 mg de landiolol o flestolol o una sal de los mismos, - 25 ml de solución que contien.
2. 2500 mg de landiolol o flestolol o una sal de los mismos, - 50 ml de solución que contiene lo.
5. 5000 mg de landiolol o flestolol o una sal de los mismos, - 100 ml de solución que contien.
5. 5000 mg de landiolol o flestolol o una sal de los mismos, - 250 ml de solución que contien.
5. 5000 mg de landiolol o flestolol o una sal de los mismos.
10. Uso o composición de acuerdo con una de las reivindicaciones precedentes, para la preparación de un medicamento para reducir la frecuencia ventricular en pacientes con fibrilación auricular, aleteo auricular y en el caso de taquicardia sinusal, de taquicardia atrioventricular y AV nodal, de arritmias taquicárdicas supraventriculares y ventriculares, de taquicardia y/o hipertensión, antes, durante y después de operaciones quirúrgicas, así como en otros casos de urgencias, y para la prevención y la terapia de isquemias perioperatorias, para la terapia de una angina de pecho inestable y de infarto agudo de miocardio.
Patentes similares o relacionadas:
Derivativos del ácido siálico para la derivatización y conjugación de proteínas, del 20 de Diciembre de 2019, de LIPOXEN TECHNOLOGIES LIMITED: Un procedimiento de producción de un derivativo aldehído de un ácido siálico en el que un material de partida que tiene una unidad de ácido siálico en el […]
GELES DE QUITOSANO(A) CONTENIENDO NANOPARTICULAS METALICAS DE COBRE, PLATA Y ANTIBIOTICOS (CIPROFLOXACINO, CEFOTAXIME, GENTAMICINA Y CLOXACILINA), del 12 de Diciembre de 2019, de CARDENAS Y CIA LTDA: En la presente invención se describen geles de quitosano (poli-beta-glucosamina) con propiedades bactericidas y fungicidas en mezcla con nanopartículas […]
Compuestos de polímero de polialquileno y usos de los mismos, del 20 de Noviembre de 2019, de Biogen MA Inc: Una composición farmacéutica que comprende un conjugado y un vehículo, adyuvante, diluyente, conservante y/o solubilizante farmacéuticamente […]
Composiciones y métodos para la liberación dirigida de fármacos in vitro e in vivo a células de mamíferos mediante minicélulas intactas derivadas de bacterias, del 23 de Octubre de 2019, de ENGENEIC MOLECULAR DELIVERY PTY LTD: Una composición que comprende: (a) una pluralidad de minicélulas intactas derivadas de bacterias que tienen paredes celulares intactas, en donde la pluralidad […]
Moléculas con semividas prolongadas, composiciones y usos de las mismas, del 16 de Octubre de 2019, de MEDIMMUNE, LLC: Una molécula modificada que comprende una proteína o agente no de proteína y un dominio constante de IgG, en la que el dominio constante de IgG comprende un dominio CH3 humano […]
Método para la preparación de oligo etilenglicol monodisperso, del 19 de Junio de 2019, de NEKTAR THERAPEUTICS: Un método para preparar un oligo (etilenglicol) monodisperso, comprendiendo dicho método: (i) hacer reaccionar un oligo (etilenglicol) terminado […]
Construcciones de moléculas MHC y sus usos para el diagnóstico y terapia, del 29 de Mayo de 2019, de DAKO DENMARK A/S: Una construcción de moléculas MHC en forma soluble en un medio de solubilización o inmovilizada en un soporte sólido o semi-sólido, comprendiendo dicha construcción de moléculas […]
Usos terapéuticos de anticuerpos monoclonales frente al receptor de la angiotensina II tipo 1, del 17 de Mayo de 2019, de QUEEN MARY AND WESTFIELD COLLEGE: Un anticuerpo monoclonal o un fragmento del mismo que se une al péptido que consiste en la secuencia EDGIKRIQDD para su uso en el tratamiento de la proliferación […]